基于二氧化锡/碳化硅空心球纳米链的电化学传感器检测食用油中黄曲霉毒素B1
吴民富 李 莎 徐振林 孙远明
(1. 佛山职业技术学院食品科学系,广东 佛山 528137;2. 广东省食品安全检测与溯源技术应用公共实训中心,广东 佛山 528137;3. 华南农业大学食品学院,广东 广州 510642;4. 广东省食品质量安全重点实验室,广东 广州 510642)
研究拟利用导电性和生物相容性良好的纳米材料构建传感器,采用直接竞争法对待测物进行分析。在电极基底分别修饰二氧化锡/碳化硅空心球纳米链(SnO2/SiC NCs)、苯胺纳米线和金纳米颗粒(GNPs),抗体探针采用胶体金作为载体,提高检测灵敏度。该传感器快速、检测限低、特异性强、检测过程操作简便,可应用于食用油中黄曲霉毒素B1的快速检测。
1 试验部分
1.1 试剂与仪器
氯金酸:≥99%,美国Sigma-Aldrich公司;
黄曲霉毒素(AFB1、AFB2、AFM1)、赭曲霉毒素A(OTA)、玉米赤霉烯酮(ZEN)、伏马毒素B1(FB1)、脱氧雪腐镰刀菌烯醇(DON):≥96%,北京百灵威科技有限公司;
苯胺、壳聚糖:分析纯,上海阿拉丁试剂有限公司;
黄曲霉毒素B1抗体:山东绿都生物科技有限公司;
黄曲霉毒素B1酶联免疫检测(ELISA)试剂盒:深圳芬德生物技术有限公司;
渐渐地,伟翔变得很沉默了。没有什么朋友,也很少出去应酬,下班回来,除了做家务,跟糖果玩,就是把自己关在书房里。阴沉个脸,像谁欠他八百吊。我更加生气,我累死累活,他倒给我脸色看。
电化学工作站:CHI660D型,上海辰华仪器有限公司;
透射电子显微镜:TECNAI12型,荷兰FEI电子光学有限公司;
扫描电子显微镜:Ultra 55型, 德国卡尔蔡司公司;
紫外可见分光光度计:UV1800型,岛津企业管理(中国)有限公司。
1.2 二氧化锡/碳化硅空心球纳米链(SnO2/SiC NCs)的合成
首先合成SnO2@C纳米链:0.142 g锡酸钠和2.73 gD-葡萄糖溶于17.5 mL去离子水,转移到聚四氟乙烯反应釜,180 ℃恒温加热4 h,产物离心后用去离子水和乙醇冲洗,烘干。氩气保护下置于管式炉中700 ℃ 2 h。合成的SnO2@C纳米链作为前驱体,加入过量硅粉充分混匀。然后置于管式炉中央,在氩气环境中以3 ℃/min的速率加热到1 320 ℃,保持4 h。产物用硝酸∶氢氟酸3∶1溶液处理12 h,除去过量的硅,100 ℃烘干备用[18]。
1.3 金纳米颗粒(GNPs)的制备
采用柠檬酸三钠还原法。100 mL 0.01%的四氯金酸水溶液置于圆底烧瓶,电热套加热至沸腾。持续搅拌下迅速加入2 mL 1%的柠檬酸三钠水溶液,继续搅拌加热3 min,直至溶液呈现透亮的红色。室温下冷却,4 ℃下保存备用。
1.4 辣根过氧化物酶—金纳米颗粒—抗体(HRP-GNPs-Ab)的制备
取上述制备的GNPs 500 μL,用0.1 mol/L的碳酸钾溶液将pH调至9.6。加入1 mL 20 μg/mL的黄曲霉毒素B1抗体和1 mL 0.5 mg/mL的HRP,旋涡混匀30 min后用1 mL 5%的BSA溶液封闭1 h,12 000 r/min 4 ℃离心30 min,沉淀用1 mL 0.01 mol/L pH 7.4的PBS反复洗涤。产物分散于1 mL 0.01 mol/L pH 7.4 的PBS中,4 ℃保存备用。
1.5 修饰电极的制备与检测
直径为3 mm的玻碳电极(GCE)先后在含1.00,0.30,0.05 μm Al2O3粉末的麂皮上抛光至镜面,用50%的HNO3水溶液、无水乙醇和去离子水分别超声清洗电极表面,氮气吹干备用。取1 mg SnO2/SiC NCs超声分散在1 mL去离子水中,取200 μL分散好的SnO2/SiC NCs加入100 μL 0.1% 的壳聚糖(CS)醋酸溶液,斡旋震荡混匀。取5 μL SnO2/SiC NCs/CS滴加到预处理好的玻碳电极表面,37 ℃烘箱中烘干。上述电极置于6 mL含0.5 mmol苯胺的H2SO4溶液(0.5 mol/L)中,采用三电极系统(玻碳电极为工作电极,饱和甘汞电极为参比电极,铂电极为对电极)在0.0~1.0 V的电位区间循环伏安法(CV)扫描16段,使电极表面生成聚苯胺纳米线(PANINW)。去离子水冲洗电极表面,氮气吹干。上述电极置于经N2除氧10 min的含2 mmol/L氯金酸的H2SO4溶液(0.5 mol/L)中,采用三电极系统在-0.1~0.2 V的电位区间CV扫描12段,去离子水冲洗电极表面,氮气吹干。上述电极滴加5 μL一定浓度的包被原,37 ℃孵育3 h。未吸附的包被原用0.01 mol/L pH 7.4的PBST冲洗,氮气吹干后用8 μL 10%的BSA溶液孵育1.5 h封闭未结合位点,防止非特异性吸附。用0.01 mol/L pH 7.4的PBST冲洗电极,置于4 ℃冰箱中备用。
1.6 电化学检测
2.5 μL不同浓度的AFB1和2.5 μL HRP-GNPs-Ab探针先后滴加到上述修饰电极,37 ℃孵育1 h后用PBST冲洗。修饰电极与铂电极、饱和甘汞电极组成三电极体系,置于6 mL 1 mmol/L的对苯二酚缓冲液,在-0.6~0.8 V范围进行循环伏安法(CV)扫描。电化学工作站记录加入25 μL 0.48 mol/L H2O2前后的CV曲线。
1.7 样品处理
2 g待测食用油置于15 mL离心管,加入2 mL正己烷和4 mL甲醇。漩涡震荡提取5 min,6 000 r/min离心5 min,取1 mL下层甲醇溶液加4 mL去离子水混匀待测。
2 结果与讨论
2.1 检测原理
所制备的直接竞争免疫传感器检测原理如图1所示,首先在玻碳电极表面修饰具有良好导电性和生物相容性的壳聚糖、SnO2/SiC NCs、聚苯胺纳米线(PANINW)和金纳米颗粒(GNPs),利用Au—S键固定包被原,卵清蛋白(OVA)封闭未结合位点。同时加入HRP-GNPs-Ab和待测物,采用竞争反应模式,电极上的纳米金标记探针HRP-GNPs-Ab的固定量与待测物浓度呈反比,纳米金标记探针上的HRP酶催化对苯二酚(HQ)和过氧化氢产生电化学信号,通过电化学工作站记录。根据电化学信号与待测物浓度的关系建立检测的标准曲线。

图1 免疫传感器的检测原理
碳化硅(SiC)、二氧化锡(SnO2)和聚苯胺等纳米材料各具优点,在传感器中具有良好的应用前景。SiC纳米材料具有加速电子和质子传递的作用,并且具有良好的稳定性[19-20];二氧化锡纳米材料具有比表面积大、易于功能化和良好的电子传导性能[21],SnO2/SiC NCs作为新型纳米复合材料,兼具SnO2和SiC的优点,目前未有SnO2/SiC NCs纳米复合物在黄曲霉毒素检测中应用的报道。聚苯胺具有良好的生物相容性和导电性,是生物分子的良好受体[22]。通过纳米材料的应用,可提高生物分子的固载,加快电极表面的电子传递速率,提升检测灵敏度。
2.2 二氧化锡/碳化硅空心球纳米链的表征
采用扫描电子显微镜和透射电子显微镜对所制备的SnO2/SiC空心球纳米链(SnO2/SiC NCs)进行表征,由图2可知,SnO2/SiC NCs呈均一的空心簇状球形结构,直径约为80 nm,呈现出立体结构。SnO2/SiC NCs的三维结构使得电极的有效面积大大增加,粗糙的表面有利于苯胺的沉积,更好地固定包被原。

图2 SnO2/SiC空心球纳米链的扫描电子显微镜和透射电子显微镜
2.3 HRP-GNPs-Ab的表征
HRP-GNPs-Ab复合物的紫外—可见光谱如图3所示,HRP酶在405 nm处有吸收峰,抗体在280 nm处有吸收峰,金纳米颗粒在514 nm处有强吸收峰,所制备的HRP-GNPs-Ab吸收峰分别在275,405,536 nm,表明HRP和抗体成功地偶联在金纳米颗粒上[23]。

图3 HRP、Ab、GNPs和HRP-GNPs-Ab的紫外—可见光谱图
2.4 电极组装过程的表征


a. GCE b. SnO2-SiC NCs/CS/GCE c. PANINW/SnO2-SiC NCs/CS/GCE d. GNPs/PANINW/SnO2-SiC NCs/CS/GCE e. Antigen/GNPs/PANINW/SnO2-SiC NCs/CS/GCE
2.5 纳米传感器的信号放大
传感器通过待测物浓度与电化学信号的关系建立标准曲线。二者在一定的条件下呈正相关关系[25]。因此,通过增加反应转移的电子数及增大电极表面的有效面积,可增加响应电流,提高检测的灵敏度。
试验采用纳米材料在基底和探针双重放大信号策略进行信号放大。通过金标记抗体探针上的HRP酶催化过氧化氢产生信号,以对苯二酚(HQ)作为电子转移中介体,研究传感器在HQ溶液中的电化学行为。GNPs/PANINW/SnO2-SiC NCs/CS作为基底修饰材料,多层纳米材料具有优良的生物相容性、导电性及大比表面积,作为基底材料可以更好地固定生物分子,提高电流响应速度。GNPs用于标记探针有利于增加单位抗体上HRP酶的固载量,放大电流信号,提高检测灵敏度。为验证纳米材料对传感器信号的提升作用,对比不同基底修饰和探针对信号的影响,研究不同修饰的电极在含1 mmol/L HQ 的pH 7.4 PBS中的电化学行为。采用直接沉积金和单标记抗体时,电流变化值为14.8 μA[图5(a)];先后加入SnO2-SiC NCs和聚苯胺纳米线后,电流变化值分别增大至21.6 μA[图5(b)]和24.1 μA[图5(c)];采用HRP-GNPs-Ab探针后,电流变化值增大为32.9 μA[图5(d)],说明纳米材料放大了电化学信号,有利于提高反应的灵敏度。
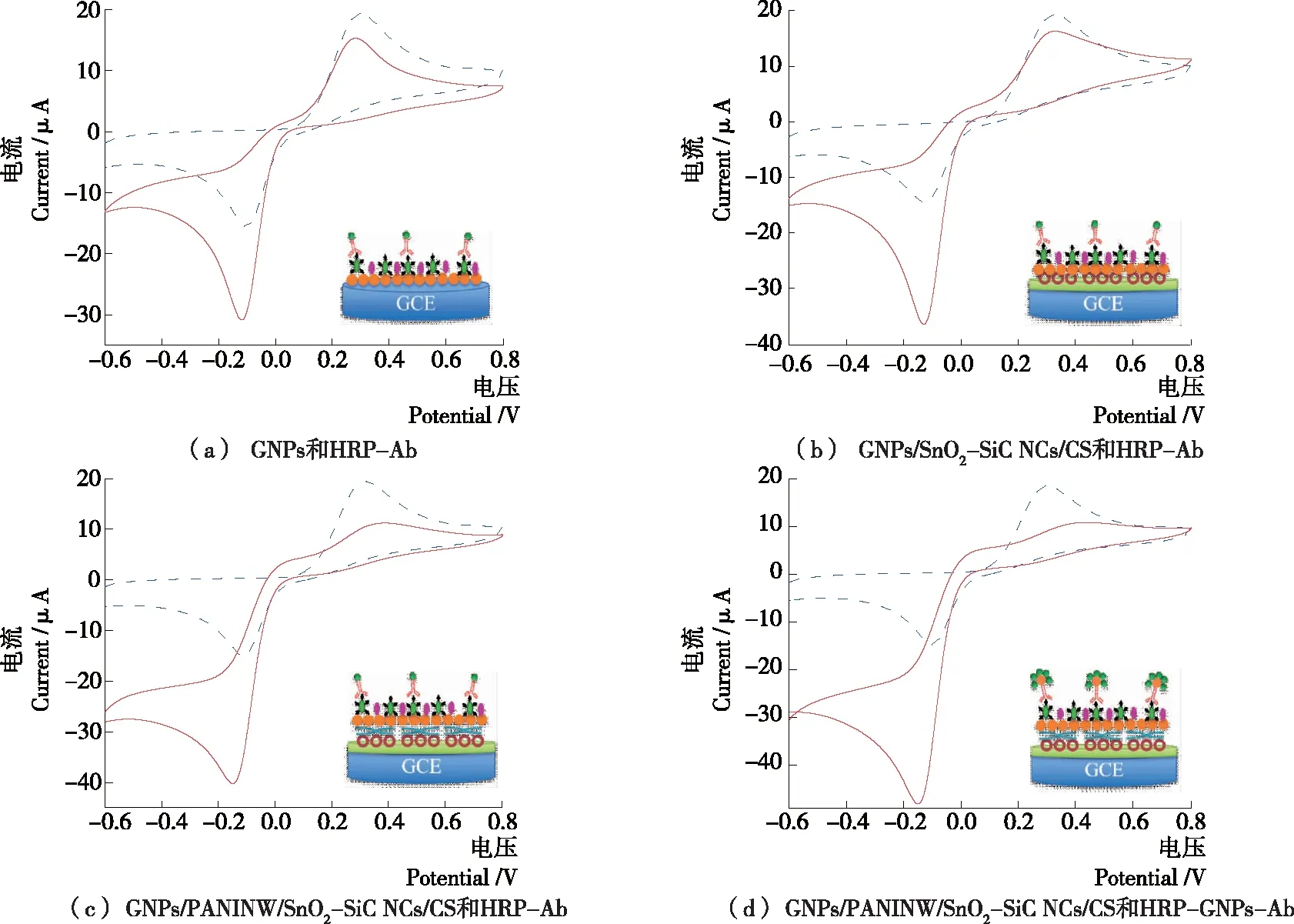
虚线为未添加过氧化氢的循环伏安曲线,实线为添加25 μL过氧化氢后的循环伏安曲线
2.6 反应条件优化
试验对包被原和抗体浓度、pH、反应时间等条件进行优化,结果见图6。包被原过高可能会形成空间位阻,阻碍抗原抗体的结合,过低则会降低电化学信号[26]。1 mg/mL的包被原从200倍开始稀释,稀释1 600倍时达到最大峰电流差[图6(a)]。抗体浓度直接影响检测的灵敏度,所制备的金标记抗体探针稀释40倍时电流变化值最大[图6(b)]。pH值一方面影响抗原—抗体反应的亲和性和抗原和抗体的活性,过高或过低的pH会导致蛋白质的变性;另一方面影响药物的溶解度,从而影响其与抗原抗体的相互作用。当反应的缓冲溶液pH为7.5时,电化学信号变化值最大[图6(c)]。抗原—抗体反应是可逆反应过程,其反应达到平衡需要一定的时间。反应的孵育时间关系到抗原抗体的结合程度。当孵育时间达到30 min后,电化学信号变化基本达到平衡[图6(d)],因此选取30 min作为反应的孵育时间。

图6 包被原和HRP-GNPs-Ab的稀释倍数、pH、孵育时间对免疫传感器性能的影响
2.7 传感器的电流响应
所制备的纳米电化学传感器基于直接竞争免疫反应原理对AFB1进行检测。在最优条件下,不同浓度AFB1引起的电化学响应如图7(a)所示。随着AFB1浓度的降低,还原峰电流增加。以AFB1浓度的对数值为横坐标,以体系加入过氧化氢前后电流变化值为纵坐标作图,采用Origin软件进行线性拟合得到校准曲线[图7(b)]:y=(22.36±0.13)-(4.78±0.07) lgx,R2=0.999 0,线性范围为3.81 pg/mL~1.00 μg/mL,检出限为1.13 pg/mL (S/N=3)。

图7 免疫传感器对AFB1检测的CV响应曲线和校准曲线
所构建的免疫传感器与近两年文献报道的AFB1检测方法相比,具有更宽的线性范围及更低的检测限,表明该传感器具有一定的技术优势(见表1)。

表1 AFB1检测方法比较
2.8 传感器的重现性、稳定性和特异性
稳定性、重现性和特异性是衡量传感器能否在实际检测中应用的重要指标。为评估免疫传感器的重现性,制备的传感器对5个不同浓度的AFB1进行检测。每个样品均做3个重复,相对标准偏差在1.47%~3.54%,表明传感器具有良好的重现性。通过定期测量4 ℃保存的传感器随时间的变化,评估其稳定性。结果表明,传感器在14 d后的电流响应为第1天的81.7%~85.5%,表明修饰的电极具有较高的稳定性。对所构建的AFB1传感器的特异性进行评估,在相同的条件下分别检测AFB1及其结构类似物在1 μg/mL浓度所引起的电流变化值(图8)。结构类似物引起的电流响应变化值为AFB1的0.60%~6.21%,表明该传感器具有良好的特异性。

图8 免疫传感器对AFB1及其结构类似物的电流响应变化值
2.9 实际样品检测
所构建的传感器用于实际样品检测,将其检测结果与ELISA试剂盒进行比对(表2)。结果表明,传感器对样品的检测与ELISA法一致。检测回收率在84.6%~107.6%,变异系数(CV)在5.42%~10.49%,说明所构建的传感器可应用于实际样品的检测。

表2 实际样品添加回收率
3 结论
研究成功构建基于纳米材料的AFB1电化学传感器。试验结果表明,该传感器对黄曲霉毒素B1的检测线性范围在3.81 pg/mL~1.00 μg/mL,检出限为1.13 pg/mL,对实际样品的检测添加回收率在84.6%~107.6%,与ELISA检测结果基本相符。所构建的传感器与文献(表1)报道的AFB1检测方法相比,具有较宽的线性范围和较低的检测限。该传感器快速、灵敏,操作简便,特异性强,准确性高,可应用于实际样品的检测。

