缺氧诱导因子-1α在人与小鼠口腔癌形成过程中的表达分析▲
陈凤强 刘正武 于大海 李 晶 王 洁
(1 南宁市第二人民医院口腔科,广西南宁市 530031;2 广西医科大学第一附属医院口腔科,广西南宁市 530021;3 南宁市第二人民医院科教部,广西南宁市 530031)
近年来,由于环境、生活压力、遗传等多方面因素的影响,口腔颌面部肿瘤发病率有所增高,尤其以恶性肿瘤最为明显。在全世界范围内,每年大约有65万新增病例和35万死亡病例为头颈部恶性肿瘤患者,位居人类常见恶性肿瘤的第六位[1]。缺氧是癌症发生的重要始动因素,血管内皮生长因子(vascular endothelial growth factor,VEGF)是肿瘤诱导产生新生血管的最重要因子。癌症形成初期,癌细胞处于细胞增殖与凋亡的动态平衡中,肿瘤生长极其缓慢,但当癌细胞周围微环境发生改变,局部缺氧激活了缺氧诱导因子-1α(hypoxia-irducible factor-1α,HIF-1α), HIF-1α进而对促红细胞生成素(erythropoietin,EPO)和VEGF的表达进行调控,促进机体EPO增加。VEGF表达上调,使肿瘤局部毛细血管和淋巴管通透性增加,刺激内皮细胞移行增殖,诱导血管和淋巴管的生成,促进了癌细胞的迅速增殖[2-4]。临床病理学证实,口腔癌患者的预后、生存率与肿瘤的血管和淋巴管生成计数呈负相关,同时HIF-1α的表达与血管、淋巴管生成计数呈正相关[5-7]。还有研究发现,HIF-1α在肿瘤细胞分化过程中发挥着重要的调控作用,HIF-1α的过度表达在肿瘤发生、发展及预后中发挥重要作用[8]。本实验对比分析HIF-1α在人与小鼠正常口腔黏膜上皮、异常增生、高分化鳞癌及其转移淋巴结中的表达情况,进一步了解HIF-1α在口腔癌形成过程中的作用。现将结果报告如下。
1 材料与方法
1.1 主要材料 前期实验[9]确立并制备好的BALB/c小鼠正常口腔黏膜上皮、异常增生、高分化鳞癌原发灶及颌下淋巴结转移灶标本各20份。人口腔癌旁正常组织标本、口腔上皮异常增生标本、口腔高分化鳞癌原发灶及其颌下淋巴结转移灶标本各取20份,来源于2010年1月至2012年10月广西医科大学附属口腔医院手术切除经病理证实的口腔癌及口腔黏膜异常增生患者。纳入标准:术前未接受放疗、化疗、生物治疗及任何其他治疗;口腔上皮异常增生或口腔鳞癌经2名病理医师确诊。排除标准:接受过放化治疗者;非原发于口腔的转移癌者;口腔癌复发的患者。患者年龄28~78岁,平均年龄53岁。将选取的标本迅速放入10%甲醛溶液中,常规行石蜡包埋和切片,做HE染色及免疫组化染色。
1.2 试剂 兔抗人HIF-1α多克隆抗体购自武汉博士得生物有限公司;羊抗鼠抗兔通用型二抗购自上海长岛公司;磷酸盐缓冲液(phosphate buffered saline,PBS)0.01 mol/L,pH值7.2~7.4,购自福州迈新生物技术有限公司;EDTA缓冲液购自福州迈新生物技术有限公司;DAB显色剂购自北京中杉金桥生物工程有限公司;3%H2O2购自北京中杉金桥生物工程有限公司;二甲苯购自上海振华化工厂;防脱玻片购自福州迈新新生物技术有限公司。
1.3 方法 采用免疫组织二步法常规操作。小鼠颌下淋巴结石蜡切片置于67 ℃烘箱中,烘片2 h,脱蜡至水,用0.01 mol/L PBS冲洗3次,每次3 min,胰蛋白酶修复抗原,3% H2O2室温孵育10 min,阻断内源性过氧化物酶的活性,蒸馏水冲洗3次,滴一抗HIF-1α(按1 ∶100稀释),于4 ℃冰箱过夜。PBS冲洗3遍,每次3 min,滴二抗酶标抗鼠聚合物,室温下孵育30 min,PBS冲洗3次,每次3 min,滴加新鲜配制的DAB溶液,显微镜下观察并控制显色时间,用HIF-1α抗体已知阳性组织做阳性对照,PBS代替一抗作为阴性对照。
1.4 结果判定 HIF-1α阳性显色为棕黄色细颗粒,主要为胞浆着色,少量为核着色,按综合染色强度和阳性细胞占总细胞数的百分比进行半定量处理。染色强度按下列标准评分:着色弱但明显强于阴性对照者为1分,染色清晰者为2分,染色强者为3分;阳性细胞占总细胞数的10%~50%为2分,占51%~80%为3分,>80%为4分。上述两项评分相加,不管其染色强度,只要阳性细胞数<10%为(-);3分为弱阳性(+);4~5分为中阳性(++);6~7分为强阳性(+++)[10]。
1.5 统计学分析 运用SPSS 17.0统计学软件进行数据分析,计数资料用例数和百分率[n(%)]表示,组间比较采用χ2检验、秩和检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1 HIF-1α在正常口腔黏膜组织的表达情况 20份人及小鼠正常口腔黏膜上皮均未见细胞质或细胞核有棕黄色着色,HIF-1α为阴性表达(图1A、图2A),PBS阴性对照未见染色。
2.2 HIF-1α在口腔异常增生中的表达情况 20份人口腔黏膜异常增生标本中有5份HIF-1α表达阳性(图1B),其中4份为基底膜附近部分细胞胞浆及个别细胞胞核染色强于阴性对照,呈淡黄色着色,HIF-1α为弱阳性表达;1份为基底膜附近多个细胞胞浆或胞核呈现清晰的棕黄色着色,HIF-1α为中阳性表达。20份小鼠口腔黏膜异常增生标本中有6份HIF-1α表达阳性(图2B),其中4份为基底膜附近部分细胞胞浆及个别细胞胞核染色强于阴性对照,呈淡黄色着色,HIF-1α为弱阳性表达;2份为基底膜附近多个细胞胞浆或胞核呈现清晰的棕黄色着色,HIF-1α为中阳性表达。
2.3 HIF-1α在口腔高分化鳞癌中的表达情况 20份人口腔高分化鳞癌标本中HIF-1α全部表达阳性,阳性表达表现为癌巢区大部分细胞的胞浆呈现棕黄色着色(图1C);12份弱阳性表达,5份中阳性表达,3份强阳性表达。20份小鼠口腔黏膜癌标本中HIF-1α有19份表达阳性,表现为癌巢区大部分细胞的胞浆呈现出棕黄色着色(图2C),其中13份为弱阳性表达,4份为中阳性表达,2份为强阳性表达,在多个癌巢的角化珠着色强,呈现明显的棕黄色着色。
2.4 HIF-1α在口腔高分化鳞癌颌下淋巴结转移灶中的表达情况 20份人口腔高分化鳞癌颌下淋巴结转移灶中有3份HIF-1α弱阳性表达,表现为转移灶中部分细胞胞浆及个别胞核呈现淡黄色着色(图1D)。20份小鼠口腔高分化鳞癌颌下淋巴结转移灶中有2份HIF-1α弱阳性表达,表现为转移灶中大部分细胞的胞浆呈现淡黄色着色(图2D)。
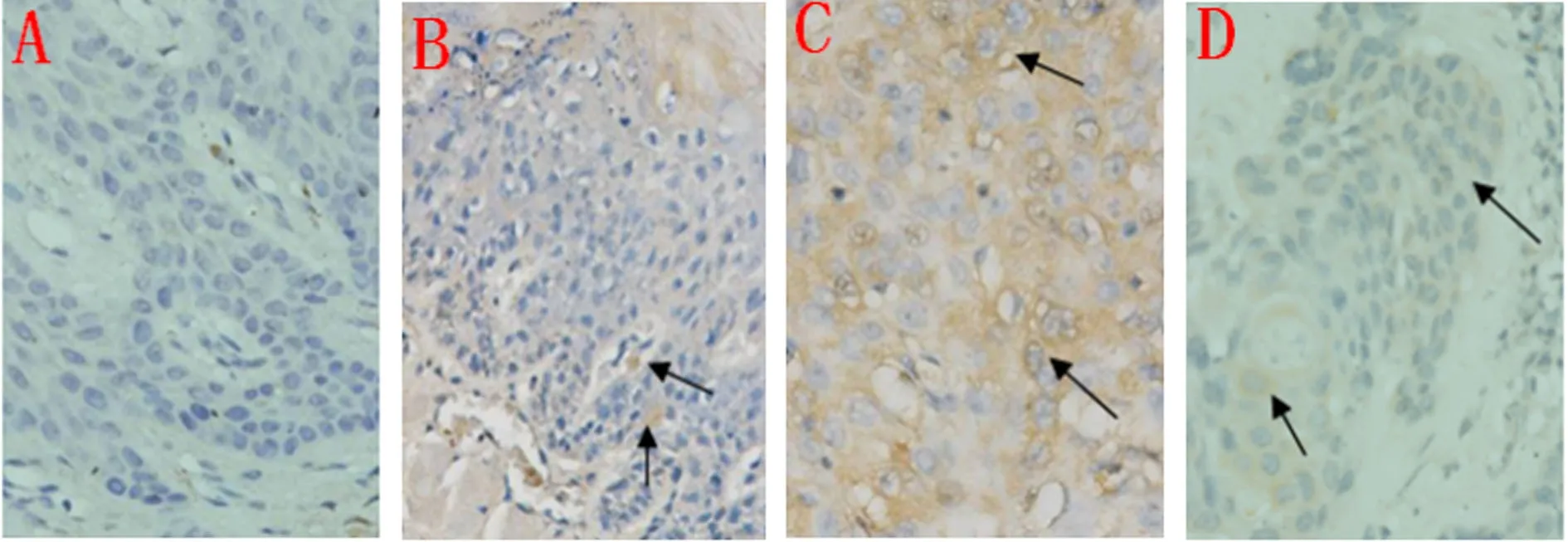
图1 HIF-1α在人口腔正常上皮、异常增生、高分化鳞癌及其颌下淋巴结转移灶中的表达情况

图2 HIF-1α在小鼠口腔正常上皮、异常增生、高分化鳞癌及其颌下淋巴结转移灶中的表达情况
2.5 HIF-1α在正常口腔黏膜、异常增生、高分化鳞癌及其颌下淋巴结转移灶表达的比较 人和小鼠HIF-1α阳性表达率均呈由正常口腔黏膜上皮、异常增生到口腔高分化鳞癌的上升趋势,但颌下淋巴结转移灶表达较原发灶明显降低。HIF-1α阳性表达率在正常口腔黏膜上皮与口腔高分化鳞癌、异常增生与口腔高分化鳞癌、口腔高分化鳞癌与颌下淋巴结转移灶的差异具有统计学意义(均P<0.05), HIF-1α阳性表达率在正常口腔黏膜与异常增生、正常口腔黏膜与颌下淋巴结转移灶、异常增生与颌下淋巴结转移灶的差异无统计学意义(均P>0.05)。见表1。

表1 HIF-1α在人和小鼠口腔正常上皮、异常增生、高分化鳞癌及其颌下淋巴结转移灶中阳性表达情况
3 讨 论
目前研究发现,HIF-1α在人类多种恶性肿瘤中存在过表达情况[11]。Aebersold等[12]用免疫组化方法检测98例人口腔鳞癌组织中HIF-1α的表达情况,发现94%的肿瘤组织中都存在着HIF-1α高表达。王世霞[13]采用免疫组化法检测10例正常口腔黏膜组织和58例口腔鳞癌中HIF-1α的表达情况,发现HIF-1α在正常口腔黏膜中几乎不表达,在口腔鳞癌中表达明显增强,口腔鳞癌中HIF-1α表达与肿瘤大小、年龄、性别无相关关系,但与其病理分级、临床分期及淋巴结转移呈显著正相关,提示HIF-1α在口腔鳞癌的发生发展过程中发挥了重要作用。王霞[14]通过检测地鼠颊囊癌模型中HIF-1α及相关基因在癌变过程中的表达情况,发现HIF-1α在单纯增生组、轻度和中度异常组及正常组均未见表达,在重度异常增生组和鳞癌组出现异常表达,鳞癌组与重度异常增生组相比HIF-1α的表达有增高趋势,说明HIF-1α在黏膜癌的发生发展过程中起重要作用。
因此,我们推断不论是人类或是小鼠,HIF-1α在口腔癌的发生发展过程中起重要的作用。在癌症形成的早期,局部缺氧使HIF-1α出现了阳性表达,促进了机体EPO增加和VEGF表达增强,使肿瘤局部的毛细血管和淋巴管通透性增加,促进了癌细胞的迅速增殖,使癌症的恶性程度逐渐增强,但是当癌症发展到一定阶段后,由于周围丰富的毛细血管和淋巴管为癌细胞提供了良好的血运,不再存在缺氧的条件,因而HIF-1α的表达也就不再增强甚至出现表达缺失,但癌组织却在不断发展,恶性程度继续增高。
本实验采用免疫组化法在人类和小鼠正常口腔黏膜上皮均未见有细胞呈现棕黄色着色,HIF-1α在正常口腔黏膜中几乎不表达,与王世霞[13]的检测结果相一致。本研究中,在人类和小鼠口腔黏膜异常增生组织中,HIF-1α阳性率较低,分别为25%和30%,且多为弱阳性表达,表现为基底膜区细胞的胞浆及个别细胞的胞核呈淡黄色着色;在人类和小鼠口腔高分化鳞癌中HIF-1α阳性表达较高,分别为100%和95%,表现为原发灶区大部分细胞的胞浆呈现棕黄色着色,在1例小鼠口腔黏膜癌中我们还发现有多个癌巢的角化珠呈现明显的棕黄色着色;在人类和小鼠口腔高分化鳞癌颌下淋巴结转移灶中分别有3例和2例转移灶中的细胞胞浆及个别胞核呈现淡黄色着色,HIF-1α均为弱阳性表达,阳性率分别为15%和10%。通过比较,我们发现人类与小鼠在正常上皮、异常增生、高分化鳞癌和淋巴结转移灶相应阶段中HIF-1α阳性表达相似。HIF-1α的阳性表达率及着色强度由正常上皮→异常增生→高分化鳞癌逐渐升高增强,在人高分化鳞癌组织中HIF-1α阳性表达率达到100%。我们检测的小鼠中HIF-1α在异常增生阶段的阳性表达结果与王霞[14]的HIF-1α在地鼠颊囊癌模型轻中度异常组未见表达不同,与重度异常增生组和鳞癌组出现的异常表达相同,我们推测可能与实验所用的鼠类不同有关。同时,我们检测的人和小鼠口腔高分化鳞癌颌下淋巴结转移灶中分别仅有3例和2例HIF-1α阳性表达,推测尽管原发灶癌细胞缺氧程度较深而导致HIF-1α表达明显增高,但是尚属早期的鳞癌淋巴结转移灶血运良好,癌细胞微环境并未受到明显改变,不存在明显的缺氧,因而不会诱导基质金属蛋白酶上调和抑制E-钙黏蛋白表达,使癌细胞失去粘连并降解基质,启动播散过程,因此也就不会导致HIF-1α的表达上升,所以HIF-1α的阳性表达率较低。
通过检测人类与小鼠在正常口腔黏膜上皮、异常增生、高分化鳞癌及其颌下淋巴结转移灶中的HIF-1α表达,使我们对口腔黏膜病变的发生发展有了进一步的了解,同时也有助于我们判断病变的性质并做出正确的诊疗措施。总之,HIF-1α是我们了解口腔黏膜病变的可靠指标。

