甲酸生物利用的研究进展
徐蓉,邓王姝颖,姜卫红,顾阳
1 中国科学院分子植物科学卓越创新中心 植物生理生态研究所 合成生物学重点实验室,上海 200032
2 中国科学院大学,北京 100039
传统工业微生物发酵主要以糖基类原料作为碳源,未来的发展趋势是采用更为廉价的碳资源以提高生物制造路线的市场竞争力。一碳原料来源丰富、价格低廉,是良好的代糖原料。甲酸是主要的有机一碳化合物,也是重要的化工原料,来源广泛,如二氧化碳 (CO2) 的电化学还原[1-2]、CO2的氢化[3-4]、生物质的选择性氧化[5-6]、天然气的部分氧化、天然气和合成气的水合作用等[7]。现阶段,工业上通常采用电解水[8]或水煤气变换技术[9]将CO2和氢气转化为甲酸 (图1)。近年来,受下游制造行业需求波动的影响,甲酸生产经常面临产能过剩的问题,因此,亟待发展新的甲酸利用技术来实现产业链的拓展和延伸。
如上所述,在化工生产过程中,甲酸可由CO2直接还原获得。同时,甲酸又是一种可被甲基营养菌利用的有机一碳化合物[10]。因此,构建以甲酸为发酵原料的微生物细胞工厂并用于合成各类化学品可有效联结化工生产和生物制造两大技术领域,从而有望解决甲酸产能过剩问题以及实现工业微生物发酵原料替代、降低制造成本的目标。
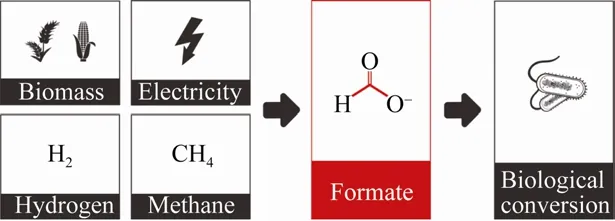
图1 甲酸生产及生物利用 (甲酸可以通过 CO2电化学还原、CO2氢化、生物质的选择性氧化、天然气部分氧化等方式生产,进而由天然或人工生物转化途径实现利用)Fig. 1 Production and bioutilization of formic acid.Formic acid is produced by electrochemical reduction or hydrogenation of CO2, selective oxidation of biomass,and partial oxidation of natural gas; then, formic acid can be further utilized via natural or artificial biological processes.
1 天然甲酸同化途径
甲酸的生物利用方式可主要归结为两类反应:1) 甲酸氧化为CO2,从而为微生物的生长提供还原力[11]。由于还原电势较低[12],甲酸是一种理想的电子供体。不足之处是,甲酸被氧化为CO2释放后,其碳原子本质上并没有被微生物同化吸收,造成代谢过程中的碳损失。2) 甲酸同化,即生物体内的甲酸与另一种代谢中间体缩合形成新的产物。该过程主要包含两种反应方式:甲酸和四氢叶酸经甲酸-四氢叶酸连接酶(Formatetetrahydrofolate ligase,FTL)催化合成甲酰-四氢叶酸(10-formyl-THF);或者甲酸和乙酰辅酶 A经丙酮酸-甲酸裂合酶 (Pyruvate formate-lyase,PFL)催化合成丙酮酸 (图2)。

图2 主要的甲酸同化反应 (FTL: 甲酸-四氢叶酸连接酶;PFL: 丙酮酸-甲酸裂合酶)Fig. 2 The major formate-assimilating reactions. FTL:formate tetrahydrofolate ligase; PFL: pyruvate formate-lyase.
PFL(EC 2.3.1.54) 是一类对氧敏感的丙酮酸-甲酸裂合酶蛋白家族的成员。通常情况下,在生物体内该酶能够催化丙酮酸和辅酶A生成甲酸和乙酰辅酶A,并且该过程能够产生ATP分子[13]。而这一反应的逆过程可实现甲酸同化。但需要指出的是,尽管研究者已经通过体外和体内实验证明了 PFL可以催化上述逆反应过程[14-15],但在生物体内该酶催化甲酸同化的效率较低[15],有待进一步优化。因此,目前已知的生物体内的甲酸同化主要是基于 FTL催化的丝氨酸循环、还原性乙酰辅酶 A途径以及还原性甘氨酸途径实现。例如,甲基杆菌和产乙酸菌能够分别通过丝氨酸循环和还原性乙酰辅酶 A途径利用甲酸作为碳源生长。此外,基于 FTL的甲酸同化途径以及催化后续反应的还原性甘氨酸途径也被引入大肠杆菌中用于实现甲酸利用,但所构建的工程菌需补充除甲酸以外的其他有机碳源才能正常生长[16]。
1.1 丝氨酸循环
丝氨酸循环是一种 ATP消耗较多的甲酸代谢途径。如图3所示,甲酸通过多步催化反应首先生成活性中间体——甲基四氢叶酸(Methylene-THF);甲基四氢叶酸将其一碳单元转移至甘氨酸从而生成丝氨酸,并经后续多步催化被依次转化为磷酸烯醇丙酮酸 (Phosphoenolpyruvate)、草酰乙酸 (Oxaloacetate)、苹果酸 (Malate) 等重要中间体;苹果酸则与辅酶A反应生成苹果酰辅酶A,再进一步生成乙酰辅酶A。乙酰辅酶A作为中心代谢物可进入后续各类代谢途径中,支持微生物生长及相关产物的合成。
许多甲基营养菌 (例如扭脱甲基杆菌Methylobacterium extorquensAM1) 可通过丝氨酸循环来代谢利用甲酸,具有潜在工业应用价值[17]。Kim等在大肠杆菌中构建了甲酸同化、丝氨酸合成以及转化为磷酸甘油酸 (Phosphoglyceric acid)的人工途径,并结合适应性进化的策略实现了工程菌利用甲酸合成乙醇的目标[18]。然而,丝氨酸循环与中心代谢有较多重叠 (草酰乙酸、苹果酸都是重要的中心代谢物),因而在对该代谢途径进行人工设计和改造时需要更多地考虑如何减少对中心代谢途径的扰动。此外,丝氨酸循环生成一分子乙酰辅酶A理论上需要消耗3分子NAD(P)H和 2分子 ATP[10],还原力和 ATP消耗较多,因此不被认为是实现甲酸高效生物利用的首选路径。因此,Liao研究组改造了天然的丝氨酸循环用于大肠杆菌的甲酸同化;他们通过引入丝氨酸脱水酶实现丝氨酸一步生成丙酮酸。相比于天然的丝氨酸循环,新途径反应步骤较少,且消除了影响甲酸同化效率的潜在主要副反应[19]。
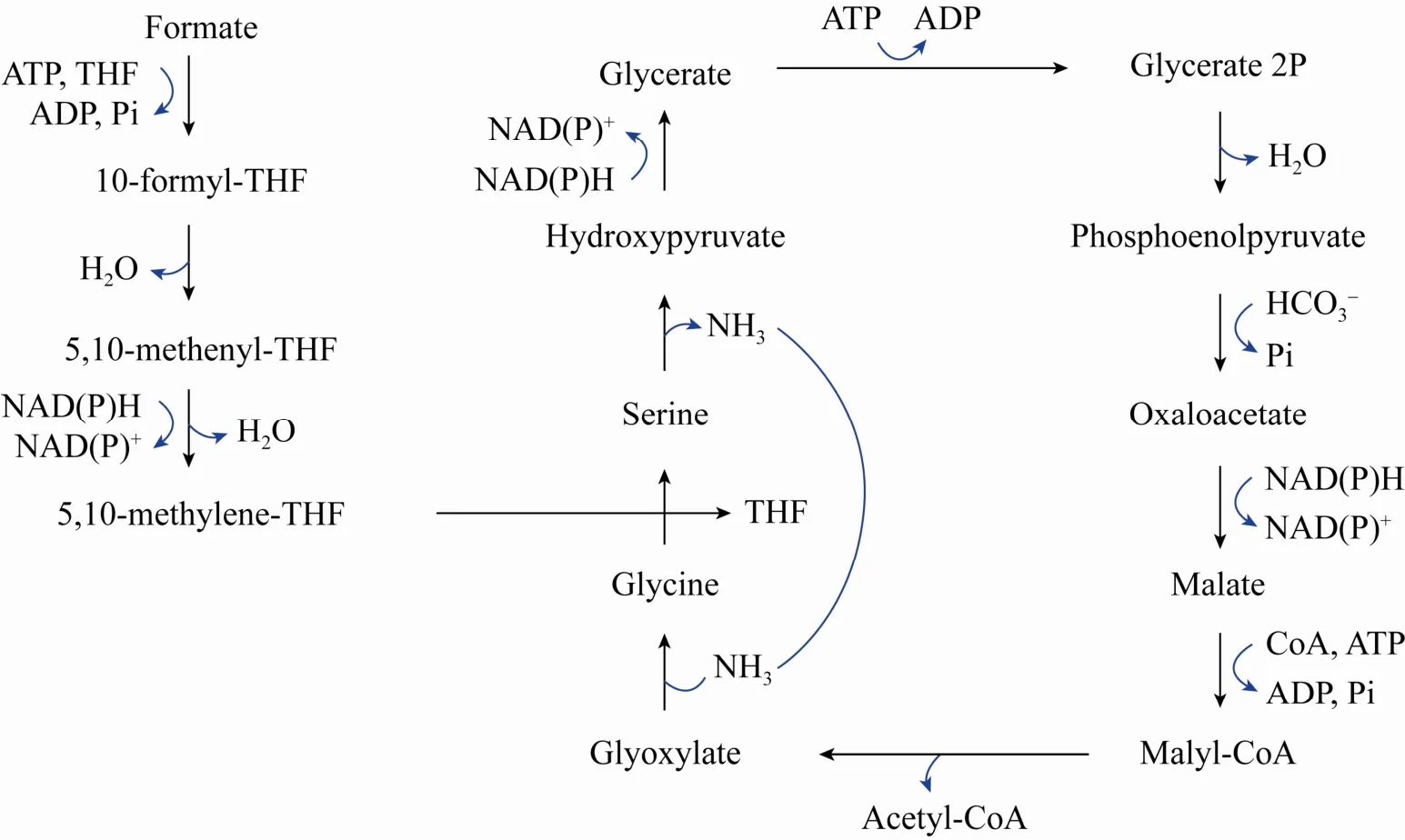
图3 丝氨酸循环Fig. 3 Serine cycle.
1.2 还原性乙酰辅酶A途径
还原性乙酰辅酶 A途径 (通常又被称为Wood-Ljungdahl途径) 是一种反应步骤少、能量消耗低的甲酸同化代谢途径 (图 4)。该途径代谢一分子甲酸理论上仅需要消耗1分子ATP、2分子NAD(P)H[10]。但由于途径中的一些关键酶对氧敏感,因而主要存在于厌氧微生物中。如图4所示,甲酸经由该途径代谢时,首先与四氢叶酸(THF) 经FTL催化后生成10-甲酰-四氢叶酸,继而经多步催化反应后生成 5-甲基-四氢叶酸(5-methyl-THF)。5-甲基-四氢叶酸的一碳单位与辅酶A以及CO基团在乙酰辅酶A合酶的催化下生成乙酰辅酶 A。在整个反应过程中,每生成1分子乙酰辅酶 A消耗4个甲酸分子 (1个被同化,3个提供NAD(P)H)[10],原子经济性要优于上述丝氨酸循环。
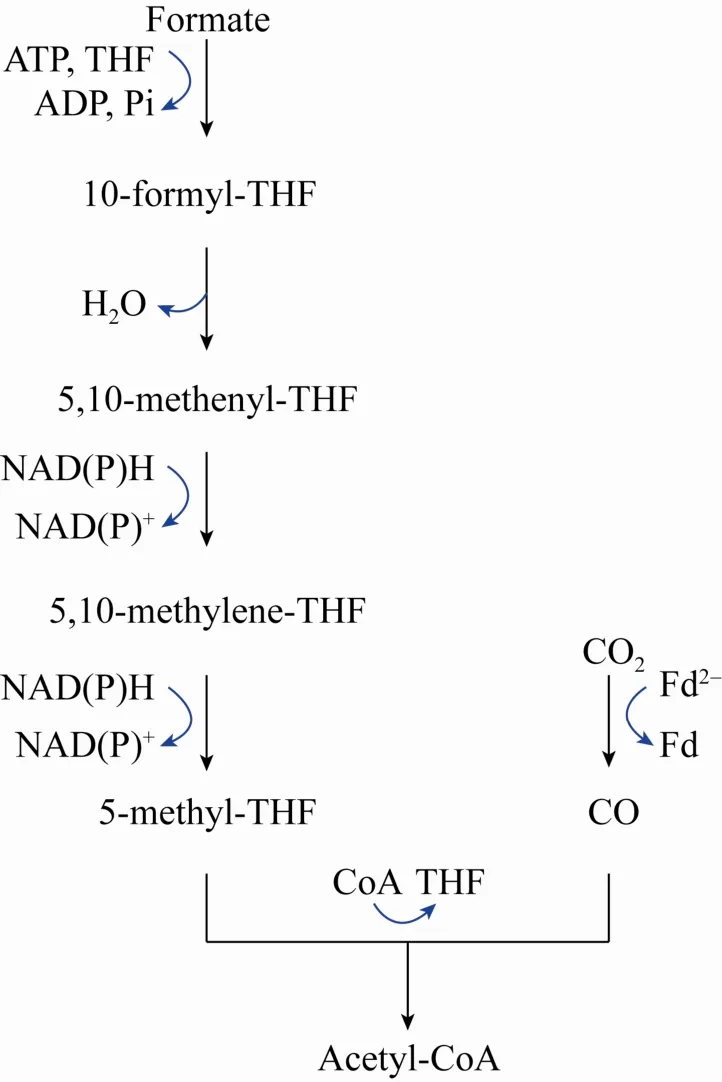
图4 Wood-Ljungdahl途径Fig. 4 Wood–Ljungdahl pathway.
目前,一些典型的产乙酸菌,如永达尔梭菌Clostridium ljungdahlii、伍氏醋酸杆菌Acetobacterium woodii等,已被报道可以通过还原乙酰辅酶A途径以甲酸作为碳源进行生长和代谢[20]。但这些微生物的产物种类较为有限 (乙酸和乙醇为主),并且与大肠杆菌和酿酒酵母等模式微生物相比,遗传改造相对困难,因此限制了工程菌的开发进度,其甲酸利用效率距离实际工业应用尚有较大差距[21]。近年来,针对这些难改造微生物的分子遗传操作技术取得了一定的进展[22],使得人工设计和重构胞内还原性乙酰辅酶A途径以及相关代谢网络成为可能。作者所在的课题组近期也陆续建立了重要自养型产乙酸菌C. ljungdahlii的一系列新型分子遗传操作技术[23-24],实现了高效的基因组编辑,为后续优化该菌的甲酸代谢途径以及合成目标产物提供了技术保证。
1.3 还原性甘氨酸途径
还原性甘氨酸途径在生物体内多种氨基酸和嘌呤代谢中发挥作用[25-26]。甲酸经由该途径代谢时涉及的一个关键功能模块是甘氨酸裂解系统(Glycine cleavage system,GCS)。甘氨酸裂解系统是生物体响应体内甘氨酸浓度变化并调节甘氨酸代谢平衡的主要模块[27],其催化的甘氨酸代谢是一个可逆的过程,即存在“裂解”和“合成”两个方向。如图 5所示,“裂解”反应是甘氨酸和丝氨酸分解代谢的主要途径,形成的5,10-亚甲基四氢叶酸 (5,10-methylene-THF) 是生物体重要的一碳单位,也是核苷酸合成的重要原料;“合成”反应则与之相反,催化5,10-亚甲基四氢叶酸结合1分子CO2和NH3形成甘氨酸,继而形成丝氨酸进入中心代谢途径。显然,沿“合成”反应方向运行,甲酸可被代谢并最终生成丙酮酸。与还原性乙酰辅酶A途径不同,还原性甘氨酸途径中没有对氧敏感的酶,且大多数酶在生物体内普遍存在。此外,该代谢途径与中心代谢途径的重叠部分较少。因此,在生物体内引入或改造该途径可有效减少对原有代谢网络的干扰。

图5 还原甘氨酸途径Fig. 5 Reductive glycine pathway.
上述甘氨酸裂解系统已被证明在体外和体内均有催化甘氨酸生成的功能,也被认为是许多原核生物中甘氨酸的唯一来源[27]。但当研究者在大肠杆菌中重构还原性甘氨酸途径以实现菌株代谢利用甲酸时发现,该途径的引入不足以支持宿主菌以甲酸为唯一碳源进行生长,在发酵前期仍需添加少量的葡萄糖[28]。因此,目前看来,甲酸通过还原性甘氨酸途径代谢的整个通路仍不畅通,加之能量供应不足,无法有效合成丙酮酸来支持宿主菌的生长,后续需要对还原性甘氨酸途径以及胞内能量代谢体系进一步优化,消除或减少甲酸代谢时对其他有机碳源的依赖。在此方面,适应性进化是值得重点考虑的策略之一,并已经在优化大肠杆菌还原性甘氨酸途径的反应效率中发挥效果[29]。
2 非天然甲酸同化途径
如上所述,天然甲基营养菌的甲酸同化能力存在不足,加之遗传改造较为困难,快速改变现状的难度较大。作为替代方案,在一些易于遗传改造的模式微生物中引入甲酸代谢途径并实现甲酸高效利用是值得重点考虑的方向。
2.1 在微生物中构建异源天然甲酸同化途径
还原性甘氨酸途径广泛存在于微生物体内,并且ATP消耗低,对氧不敏感,因此适合导入模式微生物中用于甲酸同化。Yishai等首次提出了在大肠杆菌中构建还原性甘氨酸途径以实现工程菌利用甲酸作为碳源生长的策略[10]。之后,该研究组又通过整合来自扭脱甲基杆菌的甲基四氢叶酸连接酶、5,10-亚甲基-四氢叶酸-环化水解酶和5,10-亚甲基-THF脱氢酶以及过表达甘氨酸裂解系统的4种蛋白质 (H蛋白、T蛋白、P蛋白和L蛋白) 实现了甲酸代谢合成甘氨酸和丝氨酸;同时,研究者还引入甲酸脱氢酶 (FDH) 来优化胞内的还原力供给,以及敲除若干旁路的代谢酶,最终实现大肠杆菌工程菌共利用甲酸和CO2进行生长[30]。该研究组也在甘氨酸缺陷型的酿酒酵母中构建了还原性甘氨酸途径,通过13C同位素示踪实验证明了该菌株生成的甘氨酸全部来自于甲酸,但并未实现甲酸的高效利用[31]。Lee研究组也尝试在大肠杆菌中构建还原性甘氨酸途径以实现大肠杆菌对甲酸的利用;他们通过引入M. extorquens的甲基四氢叶酸连接酶、5,10-亚甲基四氢叶酸-THF环化水解酶、5,10-亚甲基-THF脱氢酶和过量表达催化甘氨酸裂解反应的基因gcvTHP以及敲除该裂解反应的抑制基因gcvR,实现了细胞内甘氨酸的高效合成;最后,再通过引入了甲酸脱氢酶(FDH)优化胞内的还原力供给,实现大肠杆菌工程菌能够利用甲酸和CO2维持基本生长[28]。
与还原性甘氨酸途径类似,还原性乙酰辅酶A途径 (Wood-Ljungdahl途径) 是已知的反应步骤少、ATP消耗少的一种天然甲酸同化途径。有研究者尝试在丙酮丁醇梭菌中异源表达该途径所有酶及辅因子,但发现其中的一氧化碳脱氢酶/乙酰辅酶A合酶复合物在丙酮丁醇梭菌中的活性很低,使得该途径无法发挥作用[32]。因此,该途径的异源表达目前仍然存在一些难点有待克服。
虽然甲酸同化途径——还原性甘氨酸途径已在大肠杆菌和酿酒酵母中构建成功并被证明可以发挥作用,但依然存在反应步骤多、能量需求大、甲酸利用率低等不足,造成需要额外补充其他碳源供菌体代谢利用。因此,设计全新的甲酸代谢途径来克服上述缺陷是值得考虑的策略,同时也是一项具有挑战性的工作。
2.2 设计新的甲酸同化途径
2.2.1 甲酸-甲醛途径
与甲酸相比,甲醛是一种高活性化合物,更容易作为前体物质被代谢途径所吸收。甲酸转化为甲醛有多种策略,一种是将甲酸一步还原成甲醛 (图6)。Singh等[33]在多噬伯克霍尔德氏菌BurkholderiaMultivorans中发现了能够高效催化甲酸还原成甲醛的甲醛脱氢酶 (BmFaldDH),甲酸通过该酶可以催化生成甲醛。另一种策略是通过两步反应催化甲酸还原为甲醛 (图 6)。大肠杆菌或Pyrobaculum aerophilum来源的乙酰辅酶A合酶能够催化甲酸与辅酶A结合生成甲酰辅酶A[34-35]。甲酰辅酶A则可以被乙酰化的乙醛脱氢酶催化生成甲醛。但是,天然的甲酰辅酶A合酶的反应速率较慢,可能成为催化过程的一个限速步骤[36-37]。当甲酸转化为甲醛后,后续的甲醛代谢可考虑通过单磷酸核酮糖途径(Ribulose monophosphate pathway,RuMP)来催化完成 (图6),从而彻底打通甲酸代谢途径。
此外,甲醛对微生物的毒性也是构建这一新途径时需要考虑的问题[38]。在发酵过程中采用低速流加甲酸的策略可以控制细胞内甲醛的合成量,从而部分地解决上述问题,但这可能会限制发酵强度。从菌株遗传改造的角度考虑,如引入某些解毒机制[39],来提高对甲醛的耐受能力是值得考虑的另一个方面。但解毒机制的引入也可能会造成甲醛的损耗,降低碳利用率,这就需要在设计改造策略时综合平衡。

图6 甲酸代谢途径的人工设计 (左侧:甲酸被还原为甲醛,进而催化生成乙酰辅酶A;右侧:甲酸被催化形成甲酰辅酶A以进入代谢)Fig. 6 Artificial formate-assimilating pathways. Left: formic acid is reduced to formaldehyde and further converted to acetyl-CoA; Right: formic acid is converted to formyl-CoA.
研究人员已在大肠杆菌中利用RuMP实现了甲醛同化,即在阻断木糖代谢中间产物5-磷酸核酮糖的下游代谢途径的基础上,同时引入单磷酸核酮糖途径来催化胞内累积的5-磷酸核酮糖与外源添加的甲醛反应生成6-磷酸己酮糖(3-hexulose-6-phosphate),并继而进入中心代谢[40-41]。此外,江会锋研究组基于化学合成原理,创建了一条从甲醛经3步反应合成乙酰辅酶A的新途径(图6),即甲醛经乙醇醛合酶缩合成乙醇醛(Glycolaldehyde),乙醇醛经乙酰磷酸合酶转化为乙酰磷酸,最后乙酰磷酸通过磷酸乙酰转移酶生成乙酰辅酶A[42]。这也是今后构建人工甲酸同化途径时值得考虑的策略。
2.2.2 甲酸-甲酰辅酶A-丝氨酸途径
构建新的甲酸同化途径的另一个策略是将甲酸转化为甲酰辅酶A,再构建基于甲酰辅酶A 的下游代谢途径 (图 6)。前期研究表明,甲酸可直接与辅酶A反应生成甲酰辅酶A[34-35]。由甲酸激活生成的甲酰辅酶A再与甘氨酸缩合生成氨丙酸半醛 (Aminomalonate semialdeyhde)[43-44],之后氨丙酸半醛可以被多种酶(例如大肠杆菌的苏氨酸脱氢)还原为丝氨酸。丝氨酸则可通过丝氨酸循环或丝氨酸-苏氨酸循环生成重要中间体——乙酰辅酶A。
3 总结与展望
通过生物炼制将廉价碳资源转化为高值化学品和燃料是未来绿色制造发展的重要方向。甲酸作为主要的有机一碳资源,来源广泛,且可被微生物利用。大力发展甲酸生物利用技术,对于拓展现有甲酸下游产业链,提升市场竞争力具有重要意义。
自然界中存在一些天然甲酸利用微生物(表1),但甲酸利用能力不足。目前,研究者对天然甲酸利用微生物的遗传改造仍不同程度地存在技术瓶颈,效率较低。因此,在易于改造的模式微生物中引入和构建甲酸代谢途径是值得考虑的重要方向。近年来,甲酸代谢途径已被引入一些模式微生物中,并发挥了功能 (表1)。受限于宿主微生物原有的物质和能量代谢体系及调控网络,这些改造的工程菌尚无法实现对甲酸的高效利用和转化。进一步优化底盘细胞,并设计新的、反应步骤少、受宿主天然代谢及调控网络影响小的甲酸代谢途径是解决上述问题的关键。
综上,目前关于微生物代谢利用甲酸这一有机一碳资源的研究较少,且缺乏对代谢途径以及调控网络的全面、深入了解,从而无法有效实施对菌株的代谢工程设计和改造。许多重要问题,如微生物的甲酸毒性耐受机制、甲酸代谢过程的物质和能量调控以及重塑策略等,都有待认识和解答。此外,分子技术平台的进一步完善和优化对于甲酸生物利用的基础性以及应用性研究均至关重要,这方面仍有极大的提升空间,值得我们去探究。
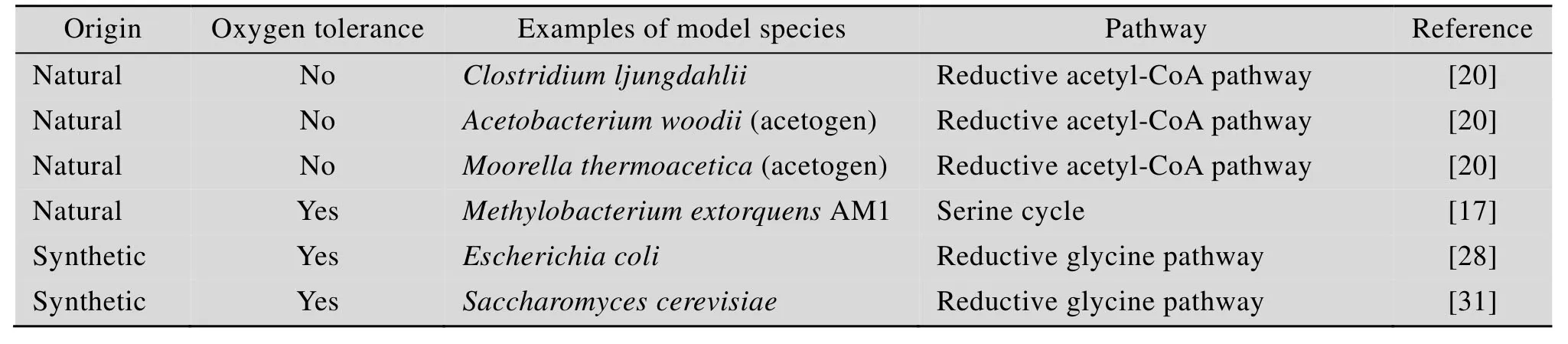
表1 可利用甲酸的天然和人工微生物Table 1 Natural and artificial microorganisms capable of using formic acid

