反应条件对啤酒中双乙酰检测结果的影响
张宗煜,李亚淑,李瑞云,郭兴旺
(1. 天津市工业微生物研究所有限公司 天津300462;2. 天津实发中科百奥工业生物技术有限公司 天津300462;3. 天津市工业微生物工程技术中心 天津300462;4. 天津市工业微生物企业重点实验室 天津300462;5. 天津量信检验认证技术有限公司 天津300462)
1 双乙酰简介
双乙酰,又名丁二酮、2,3-丁二酮、二甲基乙二酮等。在自然界,丁二酮天然发现于草莓、奶油、牛奶、咖啡、当归、肉豆蔻、覆盆子、鸢尾油、月桂油、葡萄酒、芹菜籽油等产物中。它是黄油和其他一些天然产物香味的主要成分。
1.1 啤酒中的双乙酰
双乙酰是一种天然发酵副产品,常在含酒精饮料中自然生成。双乙酰在啤酒中的含量是决定啤酒品质的重要指标之一。国标 GB/T 4927—2008对淡色啤酒,即色度在2~14EBC的啤酒中(EBC指国际通用色标,即欧洲酿酒协会European Brewery Convention规定的,用来对啤酒色度进行分级的色度单位)双乙酰含量有着明确的要求,即优级品≤0.10mg/L,一级品≤0.15mg/L,并且特别规定了如果双乙酰含量不合格,该啤酒样品属于严重瑕疵,如果有一项严重瑕疵,且复验仍存在,可以判定该批样品为不合格[1-2]。
1.2 其他食品中的双乙酰
啤酒中的丁二酮是在发酵过程产生的,除了啤酒,丁二酮在其他食品中也是允许添加的食品添加剂,常作为食品添加剂以增加黄油口味,丁二酮在食品工业中用作糖果、饼干、人造黄油等食品的增香剂,也可用作明胶的硬化剂。丁二酮与3-羟基-2-丁酮(乙偶姻)一样,是可以使黄油带上其独特口感的化合物。正因如此,食品生产商在人造黄油或类似油类食品终产品中添加丁二酮与 3-羟基-2-丁酮(同时添加β-胡萝卜素以增加黄色),在低度酒精饮料如啤酒或葡萄酒中少量添加丁二酮有助于增加滑溜的口感。随着添加量的增多,会造成一种类似黄油或奶油的味道,天然奶油也含有少量的丁二酮。丁二酮是发酵合成缬氨酸的副产物,在合成过程中,酵母产生的 α-乙酰乳酸从细胞内放出并自发脱羧生成丁二酮,酵母重新吸收丁二酮并还原其羰基生成无味的 3-羟基-2-丁酮与 2,3-丁二醇。啤酒生产有时会有“丁二酮休息”,即发酵完成后两三天略微提高温度,以使酵母能吸收先前发酵历程中生成的丁二酮。有的葡萄酒生产商,为了其口感有意促进丁二酮的生成。国标GB 2760—2014把它作为“允许使用的食品用合成香料”[3],美国香味料和萃取物制造者协会(Flavour and Extract Manufacturers Association,FEMA)把双乙酰作为“一般认为安全”(generally recognized as safe,GRAS)的食品添加剂,并规定了双乙酰在一些食品中的允许使用限量(mg/kg,ppm)[4],见表1。

表1 FEMA规定的双乙酰在食品中的允许使用限量Tab.1 Allowable use limits of diacetyl in food specified by FEMA
2 现行双乙酰的检测方法及可能存在的问题
在国标GB/T 4928—2008中,双乙酰的检测是通过蒸馏,将啤酒中的双乙酰与其他杂质分离,再使蒸出的双乙酰与邻苯二胺[o-C6H4(NH2)2]反应,生成2,3-二甲基喹喔啉,并在 335nm 下测定产物的吸光度[5]。所涉及的反应如图 1—图 3所示(R1、R2、R3代表不同基团)。
邻苯二胺[o-C6H4(NH2)2]属于芳香族伯胺,与羰基化合物生成的亚胺稳定性相对较高,可以分离出来。特别是在双乙酰的检测中,当反应进行到氨基醇脱水形成亚胺(图 2)这一阶段时,由于碳氮双键和苯环共轭,再加上 1,2-二酮与 1,2-二胺这种特殊的空间位置,生成了一个稳定性很高的芳香杂环化合物。在这个过程中,产物 2,3-二甲基喹喔啉的芳香性促进了反应朝正向进行,而不会在酸性水溶液中水解。反应历程如图4、图5所示。

图1 伯胺与羰基化合物生成氨基醇Fig.1 Formation of amino alcohols from primary amines and carbonyl compounds

图2 氨基醇脱水形成亚胺Fig.2 Dehydration of amino alcohol to form imine

图3 亚胺在酸性条件水解Fig.3 Hydrolysis of imine in acid condition
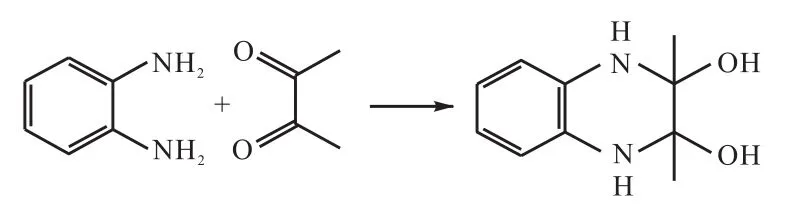
图4 双乙酰与邻苯二胺生成氨基醇Fig.4 Formation of amino alcohol by diacetyl and ophenylenediamine

图5 2,3-二甲基喹喔啉的生成Fig.5 Formation of 2,3-dimethyl quinoxaline
由反应方程式可以看出,该反应会生成水。根据化学反应平衡移动原理,如果能在反应过程中及时把水移出反应体系,会促进反应正向进行。但在国标GB/T 4928—2008中,要用 4mol/L的盐酸配制邻苯二胺溶液,再用这个溶液和双乙酰反应。因为邻苯二胺/盐酸溶液中的邻苯二胺含量较低,所以该反应体系中大部分是水,理论上会抑制反应的进行。为了验证这个想法,我们设计了实验:按照国标 GB/T 4928—2008进行操作;将蒸馏出来的双乙酰与邻苯二胺/乙醇溶液反应,并对比2个实验的结果;根据该实验结果确定比较好的反应溶剂,再进行邻苯二胺使用量的相关实验。
3 双乙酰检测研究回顾
在以往的文献中,对比色法检测啤酒中双乙酰含量有一些研究。
张祥强[6]研究认为啤酒中双乙酰的含量会随着样品保存温度、消泡剂使用量、反应温度、反应时间、比色时间的增加而升高,反应不避光要比避光时检测结果高,脏的比色皿会使检测结果偏高,使用不同消泡剂对检测结果也有影响。
邓凤仙[7]研究认为啤酒及蒸馏水(空白)中双乙酰的含量均会随着消泡剂使用量的增加而升高,消泡剂种类对样品及蒸馏水(空白)的检测结果也都有影响。
祝美云等[8]研究认为啤酒中双乙酰的含量会随着比色时间、样品保存温度的增加而升高,甚至可以达到不合格的标准,但这种“双乙酰不合格”的啤酒,感官仍然合格。啤酒中双乙酰的含量会随着啤酒开瓶后放置时间的延长而升高,且此时感官也不合格。
曹利平[9]的研究是将啤酒在低于 5℃条件下,用2个烧杯以细流方式来回倾倒5次,将处理后的啤酒转移到密闭容器中,于 60℃恒温 1h,冷却后再按照国标法进行检测,认为国标法不能有效反映啤酒中双乙酰和 α-乙酰乳酸的总量,经过文献的方法处理后,再检测可以有效反映啤酒中双乙酰和 α-乙酰乳酸的总量。
在以上文献研究中,对于双乙酰和邻苯二胺的反应均是按照国标法操作。但没有对于反应溶剂、邻苯二胺用量等方面的研究,因此本文对这些方面进行了研究。
为保证反应物双乙酰的均一性,本文中的实验方法及操作与国标法不同,所以只能通过检测结果分析和化学反应相关的问题,而不能以任何一个检测结果来判断某个啤酒样品中的双乙酰含量是否合格。
4 试验部分
4.1 试验药品与仪器
试验药品:邻苯二胺(分析纯),天津市光复精细化工研究所;乙醇(分析纯),天津市富宇精细化工有限公司;浓盐酸(分析纯),利安隆博华(天津)医药化学有限公司;一级水,自制。
试验仪器:U-3010紫外可见分光光度计,日本日立公司;优普超纯水制造系统,成都超纯科技有限公司。
4.2 反应溶剂对比试验
4.2.1 溶液配制
4mol/L盐酸:用浓盐酸与一级水按 GB/T 601配制。
10g/L邻苯二胺盐酸溶液:称取邻苯二胺0.100g,用4mol/L盐酸溶解,并定容到10mL。
10g/L邻苯二胺乙醇溶液:称取邻苯二胺0.100g,用无水乙醇溶解,并定容到10mL。
4.2.2 蒸馏
蒸馏装置见图6。

图6 双乙酰蒸馏装置Fig.6 Diacetyl distillation unit
蒸馏过程:向 5L蒸汽发生瓶中加入 1.5~2L水,从进样口中倒入样品,将进样口塞住后再进行水封,夹紧废液排放管处的簧夹,打开冷却水,用电炉加热蒸汽发生瓶。收集器为 50mL比色管(外加冰浴)。
4.2.3 反应
加 1~2滴消泡剂于 100mL量筒中,注入未经除气的预先冷却至 5℃的酒样 100mL,迅速转移到蒸馏器中进行蒸馏,直至馏出液在 50~60mL时取下比色管,恢复至室温后混匀。分别吸取10mL馏出液于 4支干燥的 10mL比色管中,并于第 1支管中加入邻苯二胺盐酸溶液 0.5mL,第 2支不加(做空白),第 3支管中加入邻苯二胺乙醇溶液 0.5mL,第4支不加(做空白),摇匀后放置暗处反应 20~30min,反应后于第 1支管中加入 4mol/L的盐酸2mL,于第 2支管中加入 4mol/L的盐酸 2.5mL,于第 3支管中加入无水乙醇 2mL,于第 4支管中加入无水乙醇2.5mL,混匀后于335nm波长下比色。
4.2.4 比色
将第2支比色管中的液体倒入10mm石英比色皿,放入紫外可见分光光度计,调零,再将第 1支比色管中的液体倒入 10mm石英比色皿,放入紫外可见分光光度计,测定吸光度。此数值为国标法测定双乙酰的吸光度结果,并根据国标中的公式计算样品中双乙酰的含量。
将第4支比色管中的液体倒入10mm石英比色皿,放入紫外可见分光光度计,调零,再将第 3支比色管中的液体倒入 10mm石英比色皿,放入紫外可见分光光度计,测定吸光度。此数值为用邻苯二胺乙醇溶液测定啤酒中双乙酰的吸光度结果,并根据国标中的公式计算样品中双乙酰的含量。
4.2.5 结果与分析
我们随机抽取市售的8批啤酒,按照上述实验步骤进行该实验,测出的吸光度结果及计算出的双乙酰含量见表2。

表2 反应溶剂对检测结果的影响Tab.2 Effect of reaction solvent on test results
由上面的实验结果可见,用邻苯二胺乙醇溶液所测定的值均比用邻苯二胺盐酸溶液测定的值要高,部分甚至大于 2倍,说明在乙醇溶液中,双乙酰与邻苯二胺的反应比在盐酸溶液中更为彻底。据此可以认为,双乙酰和邻苯二胺在乙醇溶液中反应,所得到的检测结果更能表示啤酒中双乙酰的真实含量。因此在上述试验结果的基础上,继续用乙醇作为反应溶剂进行后续试验。
4.3 邻苯二胺浓度对比实验
考虑到增加邻苯二胺的量也会促进反应正向进行,在确定乙醇是更合适的反应溶剂后,又重新设计了实验:邻苯二胺/乙醇溶液的浓度及用量遵守国标GB/T 4928—2008;邻苯二胺/乙醇溶液的用量不变,浓度改成饱和邻苯二胺/乙醇溶液(计划将浓度改成国标中的5倍,配制过程中发现该浓度下邻苯二胺不能完全溶于乙醇)。
4.3.1 溶液配制
10g/L邻苯二胺乙醇溶液:称取邻苯二胺0.100g,用无水乙醇溶解,并定容到10mL。
饱和邻苯二胺乙醇溶液:称取邻苯二胺 0.500g于 10mL比色管中,加无水乙醇至刻度,超声涡旋至固体不再溶解,过滤后使用。
4.3.2 蒸馏及反应
蒸馏装置及蒸馏过程同 4.2.2,蒸馏结束并将蒸出液混匀后,分别吸取 10mL于 3支干燥的 10mL比色管中,并于第 1支管中加入 10g/L邻苯二胺乙醇溶液 0.5mL,第 2支管中加入饱和邻苯二胺乙醇溶液 0.5mL,第 3支管不加(做空白),摇匀后放置暗处反应 20~30min,反应后于第 1、2支管中加入乙醇 2mL,于第 3支管中加入乙醇 2.5mL,混匀后于335nm波长下比色。
4.3.3 比色
将第3支比色管中的液体倒入10mm石英比色皿,放入紫外可见分光光度计,调零,再将第 1支比色管中液体倒入 10mm 石英比色皿,放入紫外可见分光光度计,测定吸光度,此数值为用 0.5mL 10g/L邻苯二胺乙醇溶液测定啤酒中双乙酰的吸光度结果,并根据国标中的公式计算双乙酰的含量。
将第2支比色管中的液体倒入10mm石英比色皿,放入紫外可见分光光度计,测定吸光度,此数值为用 0.5mL饱和邻苯二胺乙醇溶液测定啤酒中双乙酰的吸光度结果,并根据国标中的公式计算双乙酰的含量。
4.3.4 结果与分析
我们随机抽取市售的8批啤酒,按照上述实验步骤进行该实验,测出的吸光度结果及计算出的双乙酰含量见表3。
由上面的实验结果可见,当反应溶剂都是乙醇,且加入体积一样时,随着邻苯二胺的浓度增大,测定结果随之升高。说明浓度低时,体系中有双乙酰未参加反应;当浓度增大时,更多的双乙酰参加了反应,导致检测结果升高。

表3 邻苯二胺浓度对检测结果的影响Tab.3 Effect of o-phenylenediamine concentration on test results
在以上实验结果的基础上,我们进一步加大了邻苯二胺的用量。
4.4 邻苯二胺用量对比实验1
蒸馏装置及蒸馏过程同 4.2.2,蒸馏结束并将蒸出液混匀后,分别吸取 10mL于 4支干燥的 10mL比色管中,并于第 1支管中加入 10g/L邻苯二胺乙醇溶液 0.5mL,第 2支管中加入饱和邻苯二胺乙醇溶液 0.5mL,第 3支管中加入饱和邻苯二胺乙醇溶液 2.5mL,第 4支管不加(做空白),摇匀后放置暗处反应 20~30min,反应后于第 1、2支管中加入乙醇2mL,第 3支管不加,于第 4支管中加入乙醇2.5mL,混匀后于335nm波长下比色。
我们随机抽取市售的8批啤酒,按照上述实验步骤进行该实验,测出的吸光度结果及计算出的双乙酰含量见表4。
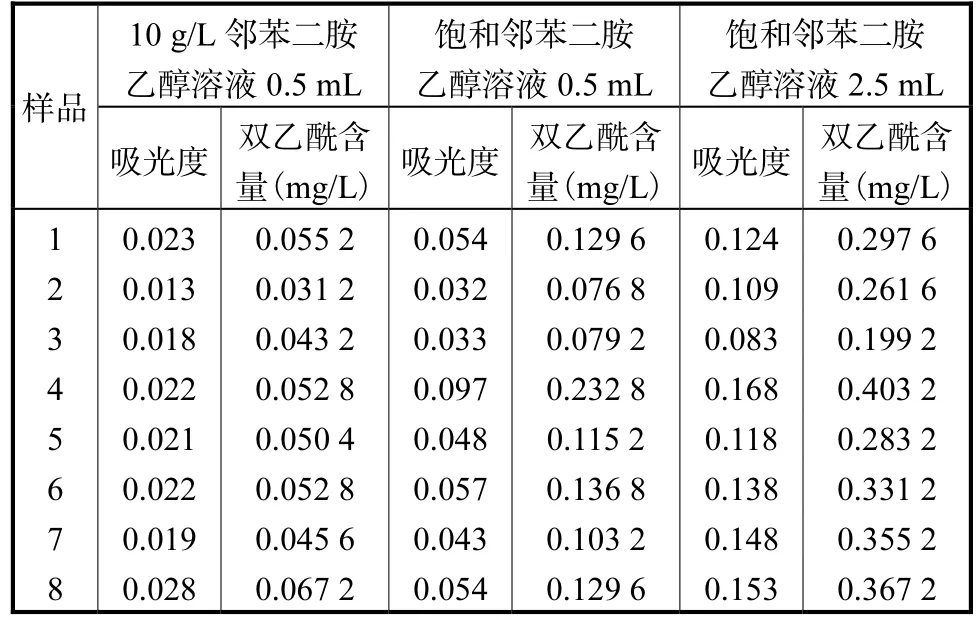
表4 邻苯二胺用量对检测结果的影响1Tab.4 Effect of o-phenylenediamine dosage on test results(1)
由实验结果可见,当反应溶剂都是乙醇,且加入体积一样时,随着邻苯二胺的浓度增大,测定的结果随之升高。在邻苯二胺溶液浓度相同时,随着加入体积的增加,测定的结果进一步升高。说明邻苯二胺用量少时,体系中有双乙酰未参加反应;随着邻苯二胺用量增大,更多的双乙酰参加了反应,导致检测结果升高。
在以上实验结果的基础上,我们将邻苯二胺的用量加大到“极限”。
4.5 邻苯二胺用量对比实验2
蒸馏装置及蒸馏过程同 4.2.2,蒸馏结束并将蒸出液混匀后,分别吸取 10mL于 5支干燥的 25mL比色管中,并于第 1支管中加入 10g/L邻苯二胺乙醇溶液 0.5mL,第 2支管中加入饱和邻苯二胺乙醇溶液 0.5mL,第 3支管中加入饱和邻苯二胺乙醇溶液 2.5mL,用饱和邻苯二胺乙醇溶液将第 4支管定容至 25mL,第 5支管不加(做空白),摇匀后放置暗处反应 20~30min,反应后于第 1、2支管中加入乙醇 2mL,第 3、4支管不加,于第 5支管中加入乙醇2.5mL,混匀后于335nm波长下比色。
我们随机抽取市售的8批啤酒,按照上述实验步骤进行该实验,测出的吸光度结果及计算出的双乙酰含量见表5。

表5 邻苯二胺用量对检测结果的影响2Tab.5 Effect of o-phenylenediamine dosage on test results(2)
由上面的实验结果可见,当反应溶剂都是乙醇,且加入体积一样时,随着邻苯二胺的浓度增大,测定的结果随之升高;在邻苯二胺浓度相同时,随着加入体积的增加,测定的结果进一步升高。说明邻苯二胺用量少时,体系中有双乙酰未参加反应;随着邻苯二胺用量不断增大,更多的双乙酰参加了反应,导致检测结果不断升高。
5 结论及展望
根据实验结果可以看出,由于双乙酰和邻苯二胺的反应会生成水,而 4mol/L盐酸中大部分是水,因而用 4mol/L盐酸作为反应溶剂,在一定程度上会抑制反应的进行。用无水乙醇作为反应溶剂,双乙酰和邻苯二胺的反应会更为彻底。在后面进行的邻苯二胺浓度及用量的对比实验中,随着邻苯二胺浓度和用量的提高,测得的双乙酰数值也在上升。可以预见当邻苯二胺的用量进一步提高时,双乙酰的含量还会进一步上升。但由于 25mL以上的比色管没有 10mL刻度,如用移液管、移液枪等设备,其精密度较高,而比色管的精密度比较低,为了避免精密度原因导致结果的偏差,就没有进一步加大邻苯二胺的用量。
使用饱和邻苯二胺乙醇溶液 0.5mL、2.5mL和定容至 25mL,邻苯二胺的用量比为 1∶5∶30,在最后一个实验中,对比 3种用量的检测结果可知,双乙酰含量的增加倍数低于邻苯二胺的用量的增加倍数。这可能是因为啤酒中的双乙酰含量有一个“极限”值,当邻苯二胺的用量达到某个数值时,即使用量再增加,双乙酰的含量也基本不变了,这个数值可以看成是啤酒蒸出馏分中,双乙酰的“真实”含量。
国标 GB/T 4928—2008对双乙酰的检测是通过双乙酰和邻苯二胺反应,检测其产物 2,3-二甲基喹喔啉的吸光度,因为喹喔啉类化合物的合成有多种方法,为了确保检测过程中两者能够完全反应,我们专门查阅了用联二酮类和邻苯二胺类合成喹喔啉类化合物相关的文献:
龚宁等[10]的合成方法是以乙醇为溶剂,回流(约80℃)反应2h可以反应完全。
王东方等[11]、高文涛等[12]合成了一系列不同取代的喹喔啉类化合物,均是以乙酸为溶剂,回流(约120℃)反应并随时监控,直到反应完全。这也符合一般化学反应的规律,即在反应未达到平衡时,延长反应时间可使反应进行得更为彻底,提高反应温度有利于提高反应速度。
高文涛等[12]对喹喔啉类化合物的合成进行了工艺改进研究,将反应溶剂乙酸改成了水,但在该反应体系中,原料不溶于水,需要加入相转移催化剂才能反应,其产物也不溶于水,相当于及时将产物移出反应体系,也会促进反应正向进行。而在双乙酰和邻苯二胺的反应过程中,所有物料均能溶于反应体系,和上述文献中的情况不同。因此,上述文献中的这个反应条件对于双乙酰的检测中反应条件的确定几乎没有参考意义。
基于该反应生成水,李廷希等[13]的合成方法是将联二酮与邻苯二胺溶于正丁醇,因正丁醇和水不互溶,可以进行回流分水,这样才能使反应进行完全,这也符合该反应的平衡移动条件。
以上文献中的反应条件均是高温或者长时间反应。也有文献报道[14],馏出液在接触空气的条件下,随着放置时间的延长,或者放置温度的提高,其中的双乙酰前驱物 α-乙酰乳酸均会转化为双乙酰,使检测结果变大;国标GB/T 4928—2008中也提到,在蒸馏(高温)过程中部分前驱体会转化为联二酮[5],两者相互印证。因此本文没有对高温及延长时间这 2个条件进行相关实验。
在国标GB/T 4928—2008的附录C.9中,有气相色谱法检测双乙酰,但该方法只能检测双乙酰和2,3-戊二酮,蒸馏法则可以检测联二酮类化合物及部分前驱体,因此2种方法的检测结果无法互相参考或印证。

