亚热带不同植被恢复阶段林地凋落物层现存量和养分特征
陈金磊,张仕吉,李雷达,辜 翔,刘兆丹,王留芳,方 晰,2,3,*
1 中南林业科技大学生命科学与技术学院,长沙 410004 2 南方林业生态应用技术国家工程实验室,长沙 410004 湖南会同杉木林生态系统国家野外科学观测研究站,会同 438107
凋落物(或枯落物)的分解是陆地生态系统物质循环的关键过程[1- 2],是连结地上与地下生态过程的重要“纽带”,也是土壤肥力的自然来源之一[3- 4],对维持生态系统物质循环和养分均衡起着重要作用[5- 6]。此外,凋落物在地表形成的凋落物层具有良好的保水性和透水性,在水土保持和水源涵养方面起着极其重要的作用,直接或间接地影响地上植物生长、地下生态过程。因此,凋落物及其凋落物层是生态学、土壤学、生物地球化学的重要研究内容。凋落物层通常由未分解、半分解及已分解的凋落物组成,是生态系统的重要组成部分,其构成和数量及其动态因植物群落类型、组成结构、环境条件和人为干扰活动等不同而存在较大的差异[7- 9],凋落物层组成及其储量的消长反映着植物群落间的差别及其动态特征。然而,目前的研究主要集中在凋落物产量及其分解两个方面[10- 12],对地表凋落物层现存量[13- 14]、养分动态及其与各生态因子[15- 16]相关性的研究仍少见报道,特别是随着植被恢复演替,凋落物层现存量和养分动态的研究报道更为少见[17- 19]。
中国亚热带地区水热条件优越,森林资源丰富,但由于频繁且高强度的人为干扰,导致该地区常绿阔叶林破坏严重。1998年以来,为了保护该地区生物多样性和提升森林生态系统功能,全面开展天然林保护、退耕还林(草)等林业生态工程,森林生态功能退化趋势得到有效控制。由于干扰强度不同,形成了处于不同恢复阶段的多种次生植物群落。亚热带森林皆伐后,植被恢复演替的通常模式为:次生裸地—杂草丛—灌草丛—灌木丛—马尾松针叶林—马尾松针阔混交林—常绿阔叶林[20- 24]。沿着亚热带森林植被恢复演替梯度,一方面,群落树种增加,阔叶树比例增大,凋落物数量和质量改变;另一方面,群落垂直结构趋于复杂,立地微生境显著改善,凋落物分解速率不同,从而形成不同的凋落物层[18]。凋落物层的研究对保护该地区生物多样性和提升森林生态系统功能,促进森林植被恢复至关重要。但由于有关亚热带不同植被恢复阶段林地凋落物层现存量及其养分动态的研究较少,因而随着植被恢复,地表凋落物层现存量、构成比例及其养分含量、储量如何演变,它们的变化格局是否一致,生态系统物质循环过程是否逐渐优化等问题仍不十分明确。为此,本研究在湖南省中东部丘陵区选取地域相邻,生境条件基本一致的檵木+南烛+杜鹃灌草丛(Loropetalumchinense+Vacciniumbracteatum+Rhododendronsimsiiscrub-grass-land,LVR)、檵木+杉木+白栎灌木林(L.chinense+Cunninghamialanceolata+Quercusfabrishrubbery,LCQ)、马尾松+柯+檵木针阔混交林(Pinusmassoniana+Lithocarpusglaber+L.chinenseconiferous-broad leaved mixed forest,PLL)、柯+红淡比+青冈常绿阔叶林(L.glaber+Cleyerajaponica+Cyclobalanopsisglaucaevergreen broad-leaved forest,LAG)为作为一个恢复序列[25],研究凋落物层现存量、主要养分元素动态特征及其与群落植物多样性的关系,揭示亚热带森林植被自然恢复过程中,凋落物层现存量及其养分元素储存能力的演变,可以为深入研究亚热带森林生态系统物质循环、能量转换规律提供理论依据,对科学地认识亚热带森林植被恢复的驱动机制和管理林地土壤肥力具有重要意义。
1 材料与方法
1.1 研究地概况
研究地位于湖南省中东部的长沙县(113.28°—113.45°E,28.23°—28.40°N),为典型低山丘陵区,海拔为55—550 m,坡度多在20—30°;属于亚热带大陆性季风气候,年平均气温17.0℃,无霜期216—269 d,年降水量为1412—1559 mm,主要分布在4—7月,年平均日照时间1440 h;成土母岩主要为板岩和页岩等,土壤以酸性红壤为主,地带性植被为常绿阔叶林。由于人类活动频繁,干扰强度各异,地带性植被破坏严重[25]。20世纪90年代初,全面实施封山育林,形成了灌草丛(无林地,面积约为35 km2)、灌木林(不含灌木经济林,面积约为80 km2)、马尾松针阔混交林(含人工林,面积约为260 km2)、常绿阔叶林(含人工林,面积约为103 km2)等植物群落,为开展亚热带森林植被恢复演替研究提供了良好的场所。
1.2 研究方法
1.2.1 样地设置和群落调查
采用空间代替时间的方法,选取檵木+南烛+杜鹃灌草丛(LVR),檵木+杉木+白栎灌木林(LCQ),马尾松+柯+檵木针阔混交林(PLL)和柯+红淡比+青冈常绿阔叶林(LAG)4种植物群落作为一个恢复序列。在LVR设置4个20 m × 20 m样地,LCQ设置3个20 m × 20 m样地,PLL、LAG分别设置3个30 m × 30 m样地[25],如图1所示。
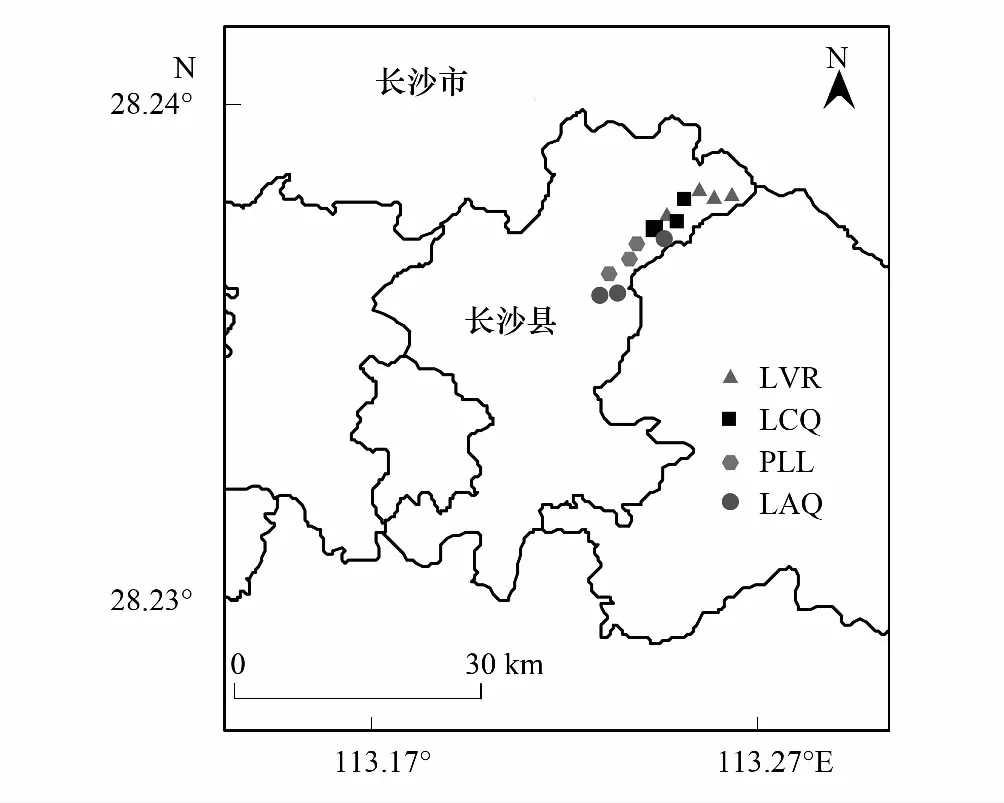
图1 4种植被恢复阶段固定样地的地理位置及其分布 Fig.1 The geographical location and distribution of the sample plots of four vegetation restoration stagesLVR:檵木+南烛+杜鹃灌草丛 Loropetalum chinense + Vaccinium bracteatum + Rhododendron mariesii scrub-grass-land;LCQ:檵木+杉木+白栎灌木林 Loropetalum chinense + Cunninghamia lanceolata + Quercus fabri shrubbery;PLL:马尾松+柯+檵木针阔混交林 Pinus massoniana + Lithocarpus glaber + Loropetalum chinense coniferous-broad leaved mixed forest;LAG:柯+红淡比+青冈常绿阔叶林 Lithocarpus glaber + Cleyera japonic + Cyclobalanopsis glauca evergreen broad-leaved forest
2016年10—11月落叶树种落叶前,采用样方调查法进行群落调查,具体调查方法详见参考文献[25]。调查统计4种林地的基本特征及其主要树种组成,如表1所示。
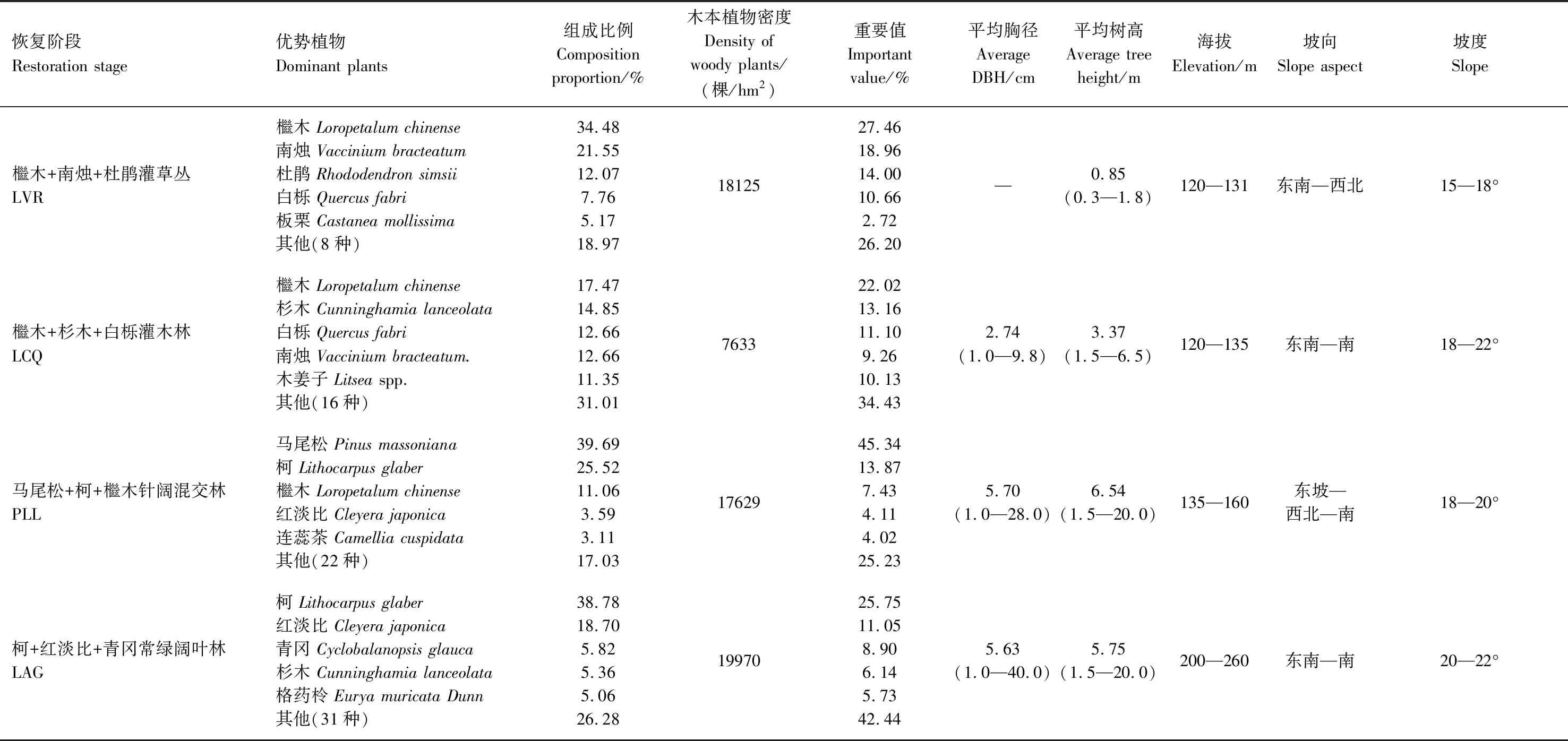
表1 不同植被恢复阶段林地的基本特征
1.2.2 凋落物层现存量的测定及分析样品采集、处理
为了避免偶然性,分别在2015年12月和2016年4、6、10月测定凋落物层现存量和采集分析样品,取4次采样测定的平均值作为最终测定结果。在每一块固定样地内沿着坡面对角线均匀布置3个1 m×1 m小样方,根据凋落物层分层标准[26],按未分解层、半分解层、已分解层(分别记作U层、S层、D层,下同)收集小样方内凋落物,带回实验室称量湿重,分别采集各分解层凋落物的分析样品(约1.0 kg)。将同一样地内3个小样方同一分解层凋落物等量混合为一个样品,置于80℃下烘干至恒重,测定分析样品的含水率。根据分析样品的含水率,计算各样方不同分解层凋落物的干重,估算不同恢复阶段各分解层凋落物及凋落物层现存量。将烘干称重后的凋落物分析样品经植物粉碎机磨碎,过60目筛孔保存,用于测定全氮(N)、全磷(P)、全钾(K)、全钙(Ca)、全镁(Mg)的含量。
1.2.3 养分元素含量的测定
凋落物样品中的N用K9840自动凯氏定氮仪测定,P用碱熔钼锑抗比色法测定,K、Ca、Mg用Hp3510原子吸收分光光度计测定[25]。
1.2.4 年凋落物量的收集与测定
在每1块固定样地,沿着上坡、中坡、下坡分别安装3个1 m2圆形收集器。从2017年8月—2018年7月,每月收集凋落物1次,收集12个月。每次收回的凋落物按叶、枝、果、碎屑分类,在80℃恒温下烘至恒重后称重,计算每1块固定样地各组分单位面积的干重,取同种林地不同固定样地同一组分的平均值作为该林地各组分的月凋落物量,再计算不同林地各组分的年凋落量,测定结果如图2所示。
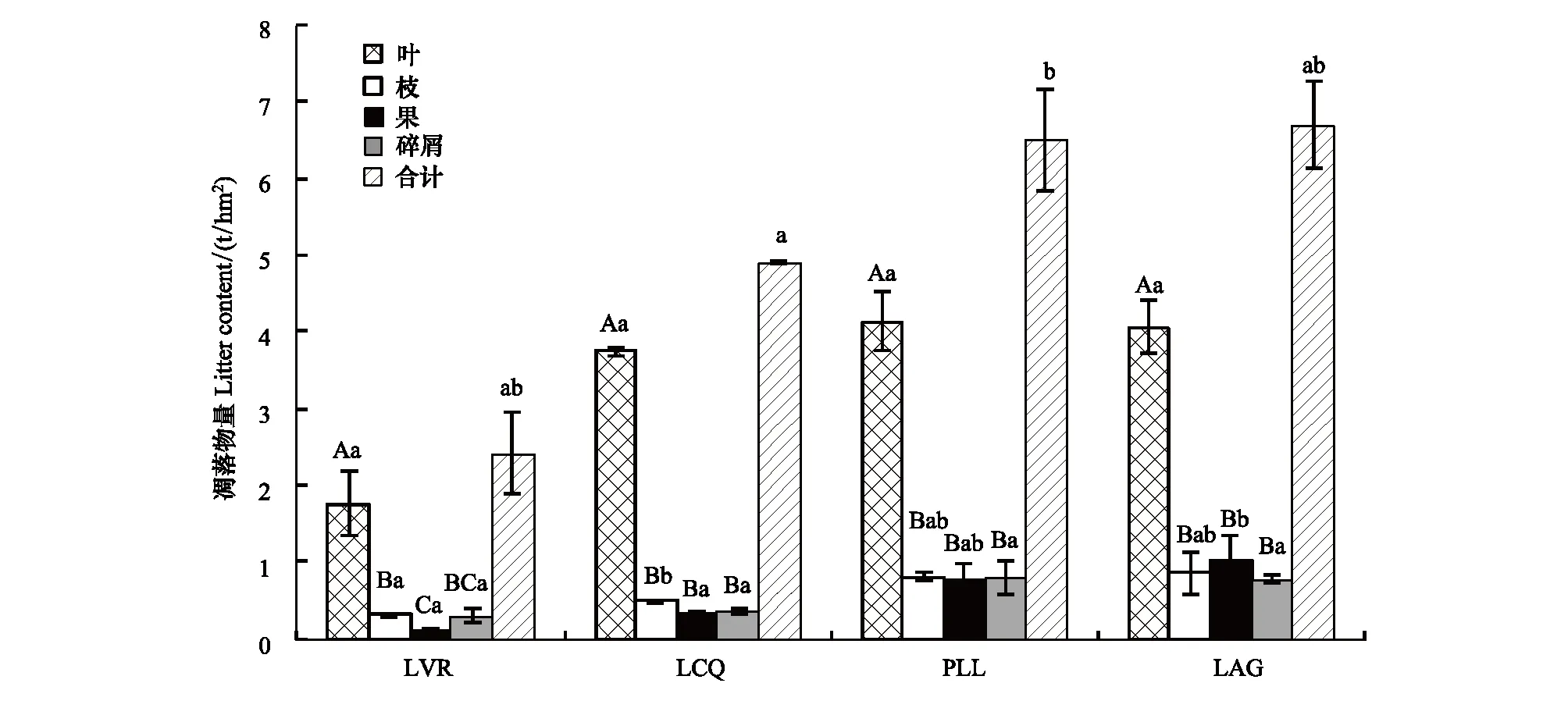
图2 不同恢复阶段林地年凋落物量及其组成Fig.2 The amount and composition of annual litter size at different vegetation restoration stages不同大写字母表示同一恢复阶段不同组分之间差异显著(P<0.05),不同小写字母表示同一组分不同恢复阶段之间差异显著(P<0.05)
1.2.5 数据处理
(1)样地乔木层、灌木层、草本层植物多样性的统计采用Margalef指数(E),Shannon-Wiener指数(H′),Simpson指数(D)和Pielou指数(J)4个指标表征。各指数计算公式详见参考文献[27]。
不同植被恢复阶段乔木层、灌木层、草本层的植物多样性指数,结果如表2所示。
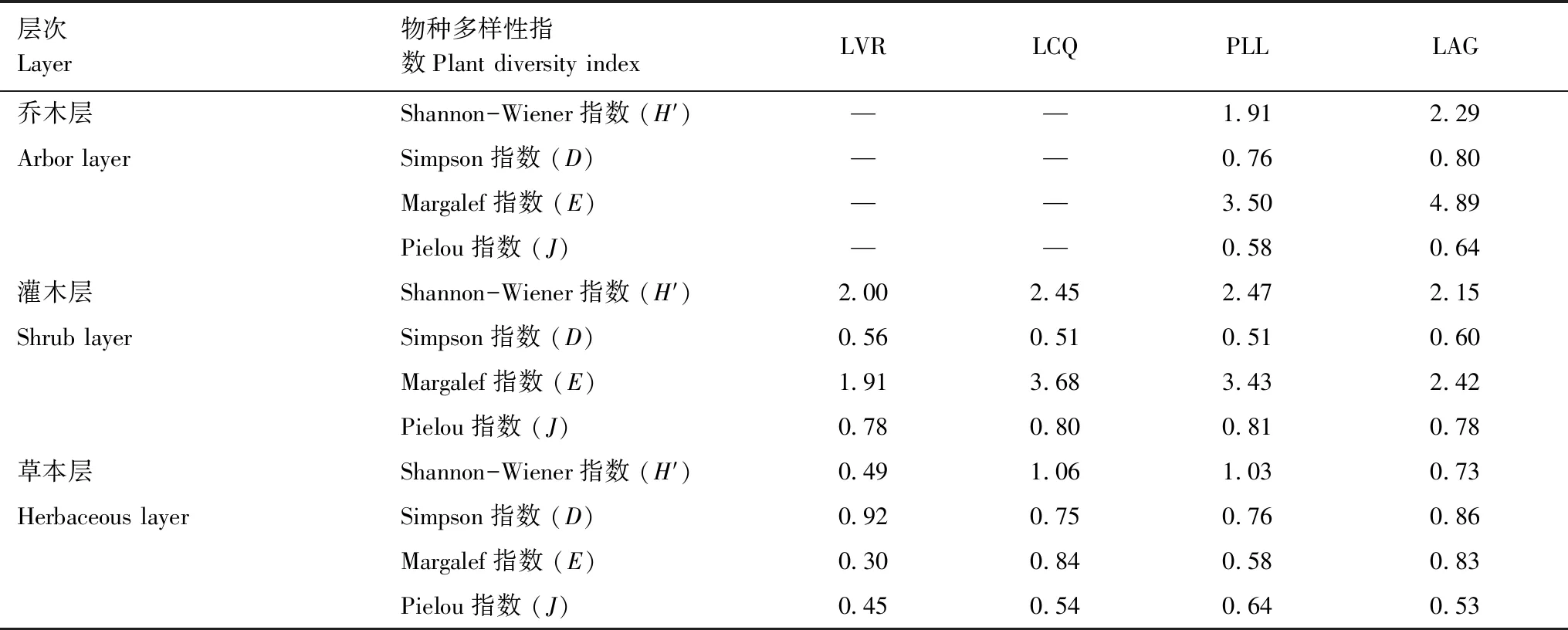
表2 不同恢复阶段林地乔木层、灌木层和草本层植物多样性指数
(2)凋落物层积累量是凋落物层现存量与年凋落物量的差值,公式如下:
M=SL-L
(1)
式中,M为凋落物层积累量(t/hm2),SL为凋落物层现存量(t/hm2);L为年凋落物量(t/hm2)。
(3)凋落物周转期和分解率(或周转率)计算公式详见参考文献[28]。
(4)凋落物层及各分解层凋落物养分元素储量用公式(2)计算:
(2)
式中,Dij为i分解层凋落物j养分元素的储量(kg/hm2),Wi为i分解层凋落物现存量(kg/hm2),Cij为i分解层凋落物j养分元素的含量(g/kg)。
(5)养分元素释放率是该分解层凋落物养分元素储量的变化与上一层凋落物养分元素储量的比值[29],D层凋落物分解后转化为土壤有机物质,因此本研究不计算D层养分元素释放率。U(或S)层凋落物养分元素的释放率,用公式(3)计算:
(3)
式中,αi为U(或S)层凋落物i种养分元素的释放率,Ai为U(或S)层与S(或D)层凋落物i种养分元素储量之差(kg/hm2),Bi为U(或S)层i种养分元素的储量(kg/hm2)。
用SPSS 22.0统计软件中的单因素方差(one-way ANOVA)的最小显著差数法(LSD,P<0.05)分析不同恢复阶段林地凋落物层现存量、养分元素含量及其储量的差异显著性检验,用Pearson分析法分析相关性。用Excel 2010软件统计各项指标的平均值、标准偏差,并制图。
2 结果与分析
2.1 凋落物层现存量及其分布特征
如图3所示,凋落物层现存量随着植被恢复而增加,最高(LAG)是最低(LVR)的4.97倍,且LVR与LCQ、PLL、LAG差异显著(P<0.05)。不同恢复阶段凋落物层分层明显,均具有U层、S层和D层,同一分解层凋落物现存量总体上也随着植被恢复而增加。其中U层,PLL最高,LVR最低,且LVR与LCQ、PLL、LAG之间,LCQ与PLL之间差异显著(P<0.05);S层、D层,LAG最高,LVR最低,且LVR与LCQ、PLL、LAG差异显著(P<0.05)。同一恢复阶段不同分解层凋落物现存量均表现为:D层 > S层 > U层,不同分解层之间的差异总体上随着植被恢复而增大。其中,LVR不同分解层之间差异不显著(P>0.05),LCQ的U层、S层与D层差异显著(P<0.05),PLL的U层与D层差异显著(P<0.05),LAG不同分解层两两之间差异显著(P<0.05)。U层凋落物现存量占凋落物层现存量的百分比最低,为20.19%—27.30%,其次为S层(27.67%—31.11%),而D层最高(41.59%—51.02%)。表明近70%凋落物已被分解为半分解和已分解,有40%以上已被分解为腐殖质。
如图3所示,不同恢复阶段凋落物分解率为0.44—0.61,周转期为1.65—2.28 a。其中,LVR凋落物分解率最高(0.61),周转期最短(1.65 a),其次是PLL和LAG,而LCQ凋落物分解率最低,周转期最长。LCQ凋落物的积累量最高(1.38 t/hm2),其次是LAG(1.09 t/hm2),LVR最低(-0.86 t/hm2)。
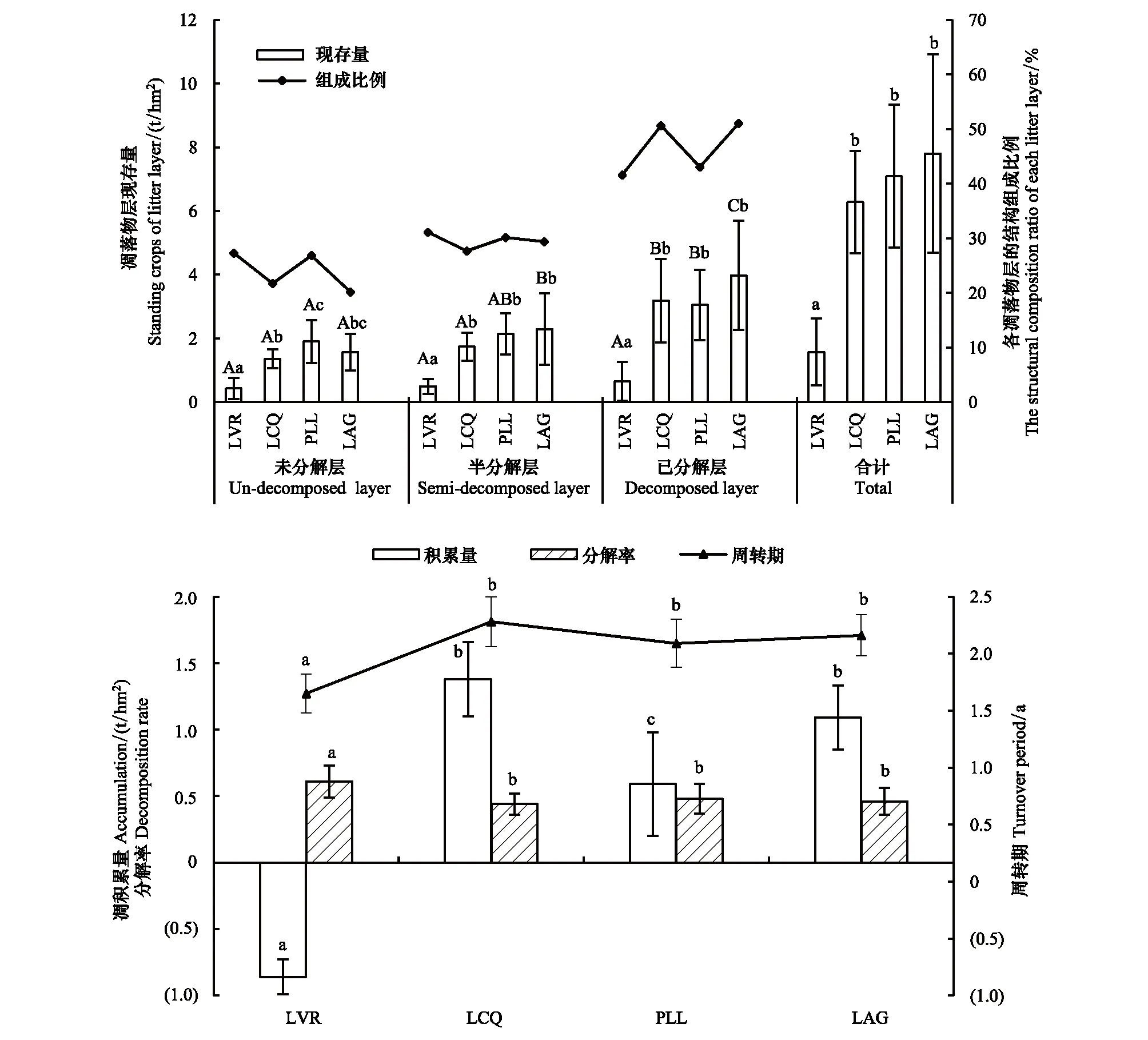
图3 不同恢复阶段林地凋落物层现存量及其积累量、分解率和周转期Fig.3 Standing crops, accumulation, decomposition rate and turnover period of litter layer at different vegetation restoration stages不同大写字母表示同一恢复阶段不同分解层之间的差异(P<0.05),不同小写字母表示不同恢复阶段之间差异显著(P < 0.05)
2.2 凋落物层养分元素的含量
从图4可以看出,凋落物层及同一分解层凋落物不同养分元素含量均表现为:N>Ca>Mg>K>P,且各养分元素的含量随着植被恢复呈现出不同的变化特征。N含量随着植被恢复而增加,且LVR、LCQ、PLL(除D层外)与LAG差异显著(P<0.05);P含量总体上也随着植被恢复而增加,且LVR与LAG差异显著(P<0.05),与LCQ(除U层外)、PLL(除D层外)差异不显著(P>0.05);K含量不同恢复阶段之间凋落物层及同一分解层凋落物的差异不显著(P>0.05);LCQ凋落物层及其各分解层凋落物Ca含量最高,PLL最低,但仅LCQ凋落物层与PLL差异显著(P<0.05);LAG凋落物层及其各分解层(除U层外)凋落物Mg含量最高,其次是LCQ,LVR最低,其中LVR、PLL凋落物层、U层和S层与LCQ、LAG差异显著(P<0.05)。随着植被恢复,N、Ca、Mg含量变化较大,而P、K含量变化较小。同一恢复阶段N、P(除PLL、LAG外)、K、Ca、Mg含量均随着凋落物分解而下降,PLL各分解层凋落物P含量以S层最高,U层最低,LAG则依次为:S层 > U层 > D层,但各养分元素含量不同分解层之间的差异显著性因养分元素不同而异。
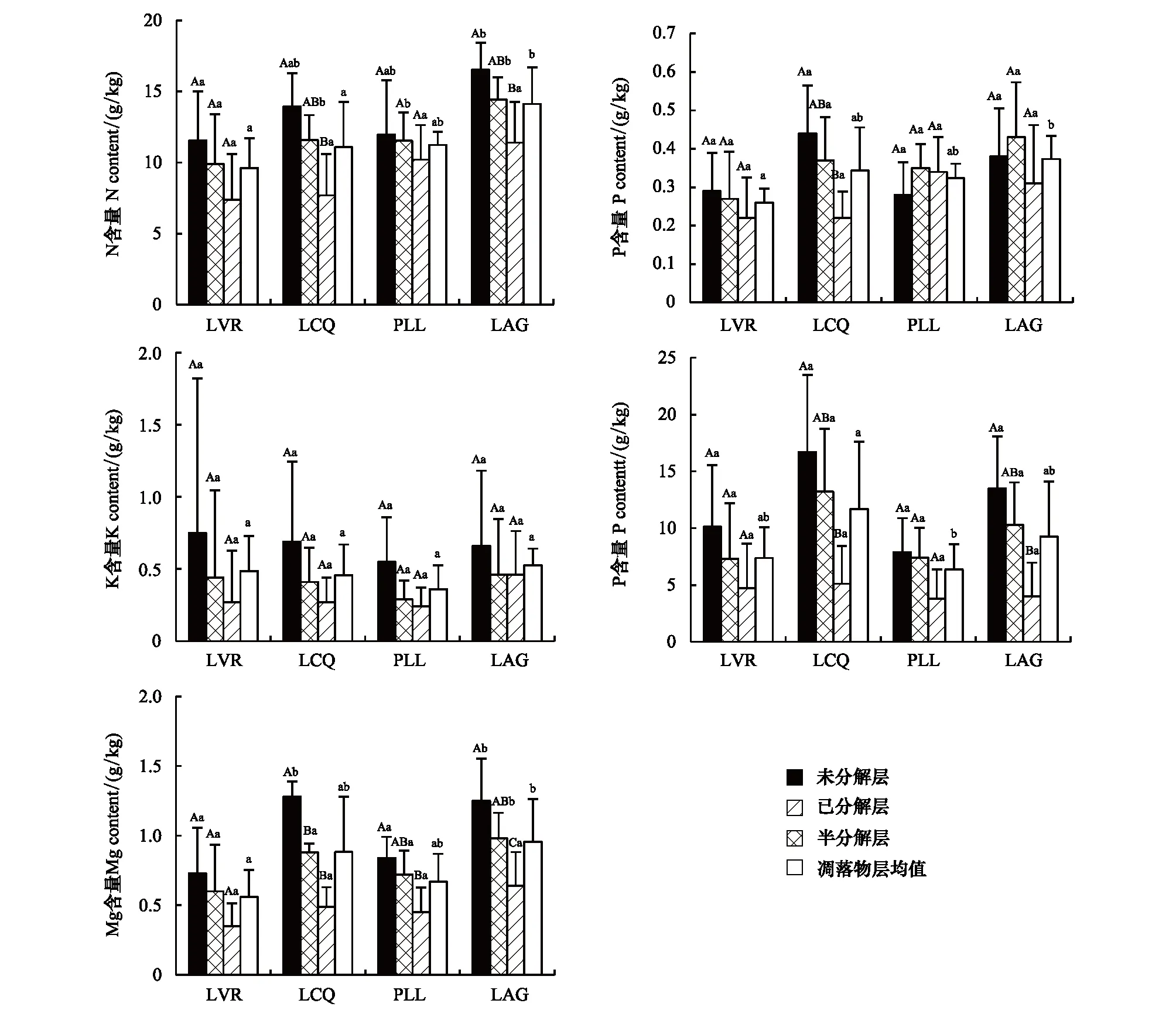
图4 不同恢复阶段凋落物层养分元素的含量Fig.4 Nutrient content of litters at different vegetation restoration stages不同大写字母表示同一恢复阶段不同分解层之间差异显著(P<0.05),不同小写字母表示不同恢复阶段之间差异显著(P<0.05)
2.3 凋落物层主要养分元素的储量及其释放率
如表3所示,凋落物层养分元素总储量总体上随着植被恢复而增加,从LVR到LAG,增加了151.13 kg/hm2,且LCQ、PLL、LAG均明显高于LVR;随着植被恢复,S层、D层养分元素总储量占凋落物层养分元素总储量的百分比呈递增趋势,分别为32.85%—34.07%和30.68%—37.43%,U层呈递减趋势,为28.50%—36.48%(图5)。凋落物层及同一分解层凋落物各养分元素的储量总体上也随着植被恢复而增加,其中N、P、K、Mg的储量以LAG最高,分别为104.38、2.81、3.92、6.77 kg/hm2,Ca以LCQ最高,为62.55 kg/hm2;从LVR到LAG,N储量变化最大,增加了89.80 kg/hm2,其次是Ca,而P的变化最小,仅增加了2.42 kg/hm2。同一恢复阶段,凋落物层及各分解层凋落物不同养分元素的储量依次为:N>Ca>Mg>K>P,凋落物层及各分解层凋落物养分元素总储量主要是由N、Ca贡献,分别占总储量的46.96%—60.33%和32.57%—42.60%,而P、K、Mg储量分别仅占1.42%—1.78%、1.85%—2.55%和3.02%—3.79%。同一恢复阶段随着凋落物的分解,N、P储量呈增加趋势,而K、Ca、Mg储量在LVR、LCQ、PLL呈下降趋势,在LAG呈增加趋势(表3)。表明随着植被恢复,凋落物层的养分元素储存能力和转化归还能力提高,特别是N。
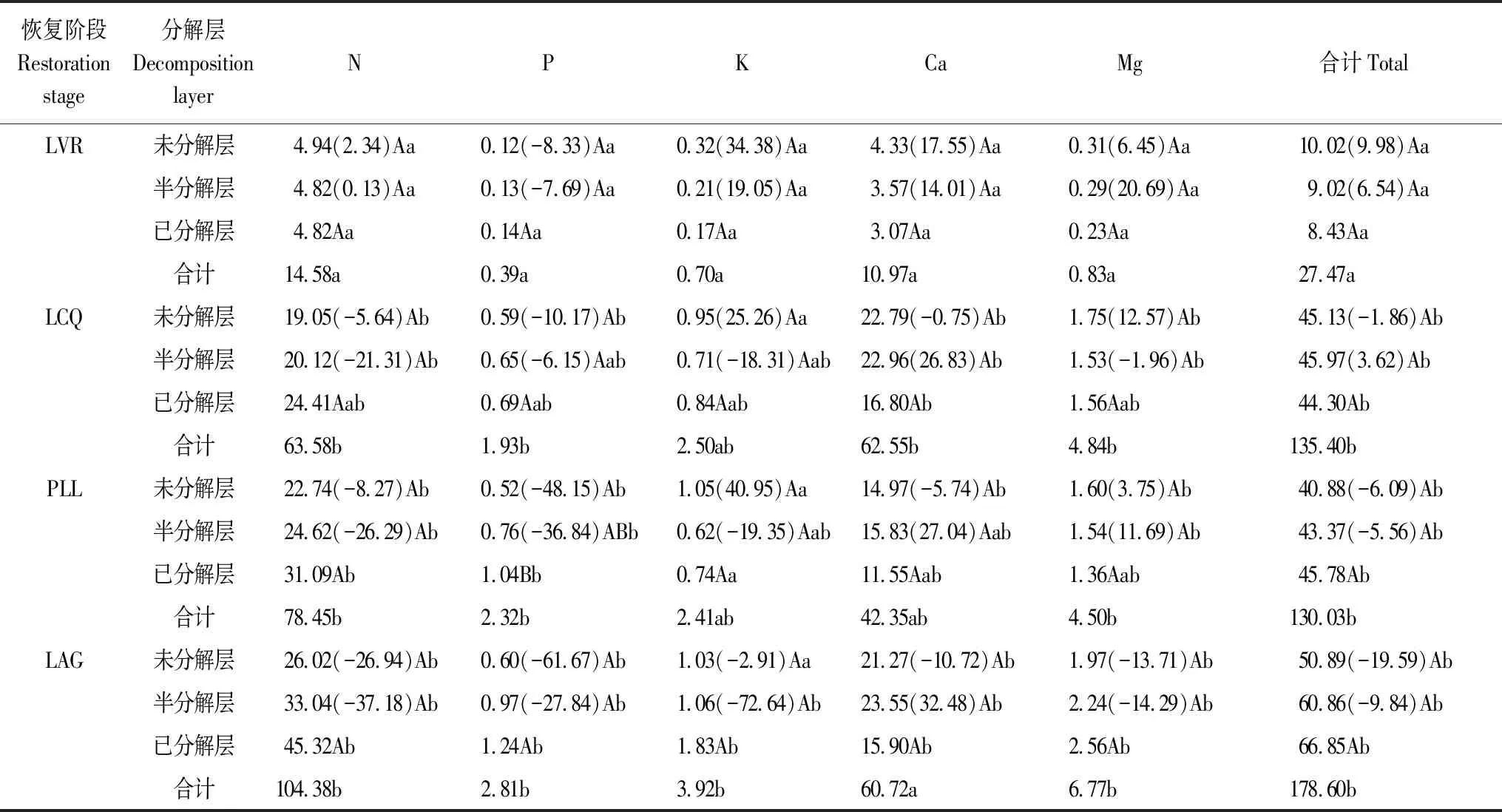
表3 不同恢复阶段样地凋落物层养分元素的储量及其释放率/(kg/hm2)
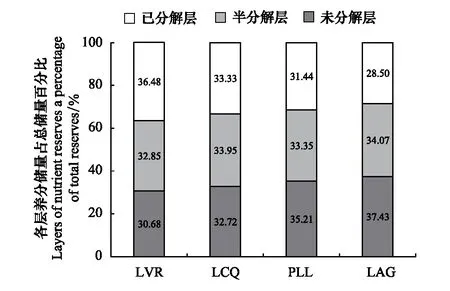
图5 不同恢复阶段养分元素总储量在不同分解层凋落物的分布Fig.5 The nutrient element reserve and its distribution in different decomposition layers at different vegetation restoration stages
LVR、LCQ、PLL、LAG从U层到S层养分元素总释放率分别为9.98%、-1.86%、-6.09%、-19.59%,从S层到D层分别为6.54%、3.62%、-5.56%、-9.84%,除LVR外,LCQ、PLL、LAG的S层养分元素总释放率比U层明显增强。同一恢复阶段不同养分元素从U层到S层的释放率为-61.67%—40.95%,其中K最高,其次是Ca、Mg,而P最低;从S层到D层为-72.64%—32.48%,LVR以Mg最高,其次是K,而P最低,LCQ、PLL、LAG以Ca最高,其次为Mg,而P最低(表3)。表明随着植被恢复,养分元素总释放率下降,但随着凋落物的分解而加快,有利于养分的保持。
2.4 物种多样性指数与凋落物层现存量、养分元素含量的相关性分析
对每种林地样地调查数据进行统一合并后,计算不同植被恢复阶段乔木层、灌木层和草本层物种多样性与凋落物层现存量、养分元素含量的相关性,如表4所示,乔木层物种多样性指数与凋落物层现存量、N、P(除Simpson指数外)含量呈显著(P<0.05)或极显著(P<0.01)正相关,与Mg、K、Ca含量不存在相关(P>0.05)。除Shannon-Wiener、Simpson指数与K含量呈显著负相关(P<0.05)外,灌木层物种多样性指数与各项指标不存在显著相关性(P>0.05)。除Simpson指数与凋落物层现存量、N、P含量呈显著(P<0.05)或极显著(P<0.01)负相关外,草本层物种多样性指数与其他指标不存在显著相关性(P>0.05)。表明乔木层、灌木层、草本层物种多样性指数对凋落物现存量、养分元素含量的影响不同,其中乔木层物种多样性的影响最明显。
3 讨论
3.1 植被恢复对凋落物层现存量的影响
研究表明,凋落物层现存量主要取决于凋落物量及其分解速率,与凋落物量呈正相关,与分解速率呈负相关[30]。因而凋落物层现存量受到生物因素、非生物因素以及植物自身特性等的共同影响[31]。同一气候条件下,不同林地物种组成、凋落物量及其分解速率不同,因而不同林地凋落物层及其各分解层凋落物现存量也存在差异[8,32-33]。当前关于凋落物层现存量随着植被恢复的变化趋势,不同的研究有不同的结果。如马文济等[18]、黄宗胜等[30]的研究表明,由于人类砍伐影响,大量凋落物,特别是细小枯枝滞留在地表面,不易分解,演替初期地表凋落物层现存量最高,随着常绿阔叶林次生演替的进行,地表凋落物层现存量显著降低。而张庆费和徐绒娣[34]、齐泽民等[35]、吕晓涛等[36]、周序力等[37]的研究发现,凋落物层现存量随着植被恢复而逐渐增加。此外,逯军峰等[38]研究表明,凋落物层现存量随林龄增大而增加,凋落物层现存量与林龄基本呈正相关关系。本研究中,凋落物层现存量随着植被恢复而增加。究其原因可能是:一方面,随植被恢复,植物种类增加,木本植物多样性提高,大型树木比例增大(表1),群落层次结构逐渐完备和稳定以及物种新陈代谢加快,使得凋落物量增加(图2),有利于地表凋落物积累,这也被凋落物层现存量与乔木层植物多样性指数呈显著或极显著正相关的分析结果(表4)所证实。另一方面,随植被恢复,群落内微环境(光照、温度、湿度等)改变,凋落物的分解率下降(图3),有利于地表凋落物积累。
本研究中,同一分解层凋落物现存量总体上随着植被恢复而增加,与张庆费和徐绒娣等[34]、郑路和卢立华[26]的研究结果基本一致。研究表明,U层凋落物现存量除了受群落凋落物量影响外,还受外界环境条件和凋落物特性的影响[34]。由于PLL以马尾松为优势树种(表1),凋落物以马尾松针叶为主,分解速率较低,U层凋落物积累多;而LAG凋落物以阔叶树叶为主(表1),分解速率较高,U层凋落物被分解为S层和D层凋落物而积累较少,导致PLL的U层凋落物现存量高于LAG,而S层和D层低于LAG,甚至D层低于LCQ,表明随着植被恢复,LAG凋落物能迅速分解转移为腐殖质,更有利于土壤养分保持与积累。
研究表明,不同林地凋落物分解强度不同,且不同分解层凋落物现存量随着凋落物的分解而增加,占凋落物层现存量的百分比增大,可能与各分解阶段凋落物的分解速率有较大关系[39]。本研究中,不同恢复阶段同一分解层现存量占凋落物层现存量的百分比不同,S层、D层的百分比高于U层,且随着植被恢复,百分比增加,表明随着植被恢复,U层凋落物向S层和D层迁移能力增强,凋落物分解速率提高[18],土壤微生物活动增强,被分解的凋落物越来越多,U层凋落物现存量越来越少。究其原因可能是:凋落物分解是一个复杂而又漫长的过程,包括物理、化学和微生物3种分解方式[40]。分解初期,水溶性物质和碳水化合物快速淋失与降解,凋落物分解速率较高;随着凋落物分解,纤维素、木质素等难以降解的物质不断积累,使得分解中期或后期凋落物分解速率下降[41],导致S层或D层凋落物的积累。
3.2 植被恢复对凋落物层养分元素含量的影响
研究表明,凋落物养分元素含量取决于植被对土壤养分的吸收,而植被对养分的吸收与植物自身特性、土壤养分元素含量有关[16]。中国森林[26]、亚热带樟树—马尾松林[42]、贵州龙里马尾松人工林[43]凋落物层养分元素含量从高到低的排序为:N、Ca、K、Mg和P;而茂兰喀斯特地区原始林[44]则为:Ca、N、Mg、K和P。本研究中,LVR、PLL、LAG凋落物层以N含量最高,其次是Ca,随后是Mg、K和P;LCQ以Ca含量最高,其次是N,随后是Mg、K和P。可能是由于本研究区林地土壤N相对丰富,而P相对缺乏。此外,树叶凋落前,N、P、K发生内转移,其中K的内转移量最大,而Ca则相对富集[45],导致凋落物层N、Ca含量较高,K含量较低,而P含量最低[46]。本研究中,凋落物层N、P含量总体上随着植被恢复而增加,与潘复静等[47]、马文济等[18]的研究结果基本一致。随着植被恢复,K平均含量的变化不显著,而Ca、Mg含量呈现增加—下降—增加的波动趋势,可能与不同植被恢复阶段树种组成(表4)以及该养分元素的迁移、再吸收利用和转化性质有关,有待于进一步研究。本研究中,PLL凋落物层养分元素含量均低于LAG,与陈法霖等[48]研究结果一致。本研究中,除LVR外,凋落物层平均N含量(11.07—14.12 g/kg)高于全球木本植物凋落叶N(10.9 g/kg)含量,而P平均含量(0.26—0.37 g/kg)低于全球木本植物凋落叶P(0.85 g/kg)含量[49],表明研究区凋落物层N含量均处于较高水平,而P含量处于较低水平。
研究表明,随着凋落物分解,各养分元素含量的变化与其释放模式相关[50]。其中,N含量随着凋落物分解的变化有两种模式:一种先富集后释放[51],另一种随着凋落物分解而下降[18];K[16]、Ca、Mg[50,52]含量随着凋落物分解而下降;而P含量由于受植被生长季节、微生物分解与利用、降水淋溶等影响,随着凋落物分解而表现出不同模式[53]。本研究中,N含量均随着凋落物分解而降低,可能是由于研究区雨水丰沛,气候湿润温暖,淋溶作用强烈[54];另一方面,在天然恢复模式下,凋落物能与土壤充分接触,有利于土壤动物觅食、微生物活动和植物生长吸收利用,分解速率加快,导致N含量下降[55]。K含量随分解而降低,与K自身在植物体内呈离子状态及其在分解过程中极易移动有关[56]。同样,Ca、Mg含量随凋落物分解而降低,一方面可能易受淋洗影响,另一方面可能受微生物控制[57- 58]。P含量随着凋落物分解而表现出不一致规律,可能与凋落物层N/P比有关[59]。本研究中,凋落物层(特别是U层)N/P比均大于30,且随着植被恢复而增加,表明研究区不同植物恢复阶段,凋落物分解不受N限制,受P限制[47,60],且随着植被恢复P的限制性增大,因而LVR、LCQ凋落物分解受P限制相对较弱,没有富集过程,而PLL、LAG受P限制相对较强,先富集后释放,这可能也是N含量随着凋落物分解而下降的原因之一。
3.3 植被恢复对凋落物层养分元素储量的影响
凋落物层养分储量与凋落物层现存量和各养分含量有关。本研究中,随着植被恢复,凋落物现存量增加量(图3)明显高于各养分含量的增加量(图4)。因此,凋落物养分元素总储量均随着植被恢复而增加,与郑路[26]的研究结果一致,主要受凋落物现存量直接影响[18]。也由于凋落物层N、Ca的含量明显高于P、K、Mg,因而凋落物层养分总储量主要是由N、Ca来贡献,与刘蕾等[61]和卢晓强等[44]的研究结果一致。本研究中,凋落物层N、P、Ca、Mg储量随着植被恢复的变化趋势与其含量变化一致,而K储量与其含量不一致。表明N、P、Ca、Mg储量是由其含量和凋落物层现存量共同影响,而K储量主要受凋落物层现存量影响。
研究表明,凋落物分解过程中产生的化合物对养分元素有螯合作用,使养分难以释放,因而贫瘠土壤的植物群落凋落物层养分元素储量会大量聚集在已分解层[8,62]。本研究中,随着植被恢复,U层凋落物养分元素总储量减少,S、D层逐渐增加。究其原因可能有:1)LVR凋落物分解率较高(图3),养分释放率较大(表3),随着植被恢复,LCQ、PLL和LAG分解率、养分释放率下降(表3),因而LVR养分积累主要在U层,而随着植被恢复,养分积累主要向S层、D层转移。2)随着凋落物分解,尽管养分含量下降,但凋落物现存量逐渐增加(图3),因而养分元素主要储存在S层、D层,与刘文耀等[52]、施昀希等[50]的研究结果一致。表明随着植被恢复,凋落物层养分逐渐向腐殖质层转移,有利养分的归还和固持。
研究表明,凋落物分解过程即是养分释放过程,也是养分积累过程,包括淋溶、积累和转化3个过程[29]。本研究中,同一恢复阶段,各养分元素释放率随凋落物分解的变化各异(表3)。随着凋落物分解,凋落物层N和P储量总体上增加,K、Mg和Ca则呈现不稳定的变化,与郭平等[63]的研究结果一致。随着凋落物分解,凋落物层N储量增加,分解速率下降,导致养分释放率减小,以及与微生物对养分的固持有关[64]。随着凋落物分解,P储量逐渐增加,是因为P储量的增长量大于其相对释放量。K、Mg和Ca具有不稳定规律,原因可能是不同植被恢复阶段树种组成结构的差异,导致凋落物组成和质量及其分解速率的不同,进而影响其养分元素的释放特性[46]。
4 结论
随着植被恢复,凋落物层及各分解层凋落物现存量逐渐增加,LAG是LVR的4.97倍;凋落物分解率下降,未分解层凋落物向半分解层和已分解层的迁移能力增强,41.59%—51.02%凋落物已被分解为腐殖质。凋落物层及各分解层凋落物主要养分元素含量随着植被恢复呈现不同的变化特征,其中N、P含量总体上增加,K含量变化不大,Ca、Mg含量呈一定波动性。随着植被恢复,凋落物层养分元素总储量增加,从LVR到LAG,增加了151.13 kg/hm2,主要是由N、Ca贡献,分别占总储量的46.96%—60.33%和32.57%—42.60%,且养分储量向腐殖质层转移增强,养分元素释放率下降,有利于养分的积累和储存。乔木层、灌木层、草本层植物α多样性指数对凋落物层现存量、养分元素含量的影响不同,其中乔木层的影响最为明显。表明植被恢复提高了凋落物层养分储存能力,有利于土壤养分的保持与积累,促进生态系统养分循环过程和自我维持机制,生态系统物质循环随着植被恢复逐渐优化。因此,促进植被恢复,提高群落树种多样性,形成完备和稳定的层次结构,增加凋落物层现存量及养分的储存,是恢复和维持林地土壤肥力的重要途径。

