改良CarbaNP法和CIM法在耐碳青霉烯类抗生素鲍曼不动杆菌和铜绿假单胞菌检测中的应用价值分析
杨华 牛翠

[摘要] 目的 探讨改良CarbaNP法和碳青霉烯酶失活法(CIM)在耐碳青霉烯类抗生素鲍曼不动杆菌和铜绿假单胞菌检测中的应用价值。 方法 收集2014年1月~2015年6月河北省邢台市第三医院臨床分离的120株鲍曼不动杆菌和100株铜绿假单胞菌。采用全自动微生物仪进行细菌鉴定和药敏试验;采用改良CarbaNP法和CIM法检测细菌碳青霉烯酶,后采用基因检测进行验证。 结果 120株鲍曼不动杆菌中,碳青霉烯类抗生素耐药株和敏感株分别占61.67%和38.33%;100株铜绿假单胞菌中,碳青霉烯类抗生素耐药株和敏感株分别占60.00%和40.00%。在鲍曼不动杆菌中,OXA-23基因携带率为94.59%(70/74),以其为标准,改良CarbaNP法和CIM法与基因检测法比较,差异无统计学意义(P > 0.05)。改良CarbaNP法和CIM法分别与基因检测结果比较,CIM法的敏感性和特异性均略高于改良CarbaNP法,但差异无统计学意义(P > 0.05)。在铜绿假单胞菌中,VIM-1阳性携带率为93.33%(56/60),以其为标准,改良CarbaNP法和CIM法与基因检测法比较,差异无统计学意义(P > 0.05)。改良CarbaNP法和CIM法分别与基因检测结果比较,CIM法的敏感性和特异性均略高于改良CarbaNP法,但差异无统计学意义(P > 0.05) 结论 改良CarbaNP法和CIM法在鲍曼不动杆菌和铜绿假单胞菌耐碳青霉烯类抗生素快速检测中均具有一定价值,以后者检测效能较好。
[关键词] 鲍曼不动杆菌;铜绿假单胞菌;改良CarbaNP;碳青霉烯酶失活法
[中图分类号] R446.5 [文献标识码] A [文章编号] 1673-7210(2020)06(a)-0024-05
[Abstract] Objective To investigate the application value analysis of modified CarbaNP method and carbapenems enzyme inactivation method (CIM) in the detection of carbapenem-resistant antibiotics Acinetobacter baumannii and Pseudomonas aeruginosa. Methods A total of 120 strains of Acinetobacter baumannii and 100 strains of Pseudomonas aeruginosa were collected from Xingtai Third Hospital, Hebei Province from January 2014 to June 2015. Bacteria identification and drug susceptibility test were carried out with automatic microbiological instrument. Modified CarbaNP method and CIM method were used to detect bacterial carbapenems, and then gene test was used for validation. Results Among the 120 Acinetobacter baumannii strains, carbapenems antibiotic resistant strains and sensitive strains accounted for 61.67% and 38.33%, respectively. Among the 100 strains of Pseudomonas aeruginosa, carbapenems antibiotic resistant strains and sensitive strains accounted for 60.00% and 40.00% respectively. In Acinetobacter baumannii, the OXA-23 gene carrying rate was 94.59% (70/74), which was taken as the standard, and there was no significant difference between the modified CarbaNP method and the CIM method and the gene detection method (P > 0.05). The modified CarbaNP method and the CIM method were compared with the results of the genetic test respectively which showed that the sensitivity and specificity of the modified CarbaNP method and the CIM method were slightly higher than that of the modified CarbaNP method, but the differences were not statistically significant (P > 0.05). In Pseudomonas aeruginosa, the positive carrying rate of VIM-1 was 93.33% (56/60), which was taken as the standard, and there was no significant difference between the modified CarbaNP method and the CIM method and the gene detection method (P > 0.05). The modified CarbaNP method and the CIM method were compared with the results of the genetic test respectively which showed that the sensitivity and specificity of the modified CarbaNP method and the CIM method were slightly higher than that of the modified CarbaNP method, but the differences were not statistically significant (P > 0.05). Conclusion The modified CarbaNP method and CIM method have some value in the rapid detection of carbapenem-resistant Antibiotics acinetobacter baumannii and Pseudomonas aeruginosa, and the latter has better detection efficiency.
[Key words] Acinetobacter baumannii; Pseudomonas aeruginosa; Modified CarbaNP; Carbapenems enzyme inactivation method
鲍曼不动杆菌和铜绿假单胞菌是临床常见的一种非发酵条件下致病的革兰阴性杆菌,当患者免疫力下降,其可侵袭机体,引发呼吸道、泌尿道及伤口等处感染,严重时可进展为败血症、脓毒血症等,威胁患者生命[1-2]。近年来数据统计显示,院内鲍曼不动杆菌检出率不断升高,仅次于铜绿假单胞菌,甚至在某些医院其检出率已超过铜绿假单胞菌[3]。亚胺培南和美罗培南等碳青霉烯类抗菌药物是临床抗革兰阴性杆菌感染的最后防线,但近年来由于此类药物广泛且大量的应用,大多数鲍曼不动杆菌和铜绿假单胞菌可产生碳青霉烯酶,导致对碳青霉烯类抗生素耐药,使临床抗感染治疗及医院感染控制面临严峻的挑战[4-5]。因此尽快检测并鉴定其耐药性,为临床选择合适抗生素,减少医疗消耗及耐药株是目前医院感染控制的主要任务之一。目前,临床多采用改良Hodge法和商品化Etest试纸条等检测碳青霉烯酶,操作步骤复杂、耗时长、假阴性和假阳性率较高,因此临床急需一种简单、快速且诊断效能较高的检测方法[6]。改良CarbaNP法和碳青霉烯酶失活法(CIM)是检测细菌碳青霉烯酶的两种新型方法,但尚未在临床广泛推广运用[7]。本研究收集河北省邢台市第三医院(以下简称“我院”)临床分离的120株鲍曼不动杆菌和100株铜绿假单胞菌,旨在探讨改良CarbaNP法和CIM法在耐碳青霉烯类抗生素鲍曼不动杆菌和铜绿假单胞菌检测中的应用价值。
1 资料与方法
1.1 菌株来源
收集2014年1月~2015年6月于我院临床标本分离的120株鲍曼不动杆菌和100株铜绿假单胞菌,分别来自于急诊室、呼吸内科、肝胆外科、神经外科及重症加强护理病房等科室,包括血液、痰液、尿液、咽拭子、胆汁及引流液等标本。
1.2 方法
1.2.1 细菌鉴定及药物敏感检测 严格按照《全国临床检验操作规程(第3版)》[8]操作规程完成临床标本的采集、接种和分离,经纯培养后,采用VITEK-2 COMPACT全自动细菌分析仪(购自法国梅里埃公司)对菌种进行鉴定和药敏检测,统一采用美洛培南和亚安培南纸片法(药敏纸片购自北京索莱宝科技有限公司,生产批号:201312DT)检测是否碳青霉烯类抗生素耐药,任意一种抗生素耐药即可判定为碳青霉烯类抗生素耐药,后用无菌纸片将其保存于-20℃冰箱。
1.2.2 改良CarbaNP法 參照CLSI M100-S25文件[9]推荐方法进行检测,每株菌2管——A管(对照管)和B管(试验管)。结果判读:①阴性(非产碳青霉烯):A管和B管均为红色;②阳性(产碳青霉烯):A管红色、B管变为黄色/橙色;③无效:A管和B管均变为黄色/橙色。其中阳性和阴性对照分别为肺炎克雷伯菌ATCC BAA-1705和ATCC BAA-1706。
1.2.3 CIM法 参考文献[10]进行CIM实验,结果判读:①阳性(产碳青霉烯):药敏片周围无抑菌环;②阴性(非产碳青霉烯):药敏片周围有抑菌环。其中阳性和阴性对照分别为肺炎克雷伯菌ATCC BAA-1705和ATCC BAA-1706,空白对照为无菌水浸泡的美洛培南纸片。
1.2.4 碳青霉烯酶基因检测 严格按照细菌基因组DNA提取试剂盒(北京天根生化科技有限公司,生产批号:201311PX)说明书完成DNA提取,并以此为模版检测鲍曼不动杆菌和铜绿假单胞菌碳青霉烯酶相关编码基因,其中引物设计参考文献[11],在本研究中检测的鲍曼不动杆菌耐碳青霉烯酶基因包括:A类:KPC和GES;B类:IMP和VIM;D类:OXA-23,铜绿假单胞菌耐碳青霉烯酶基因包括VIM-1、IMP-4、KPC-2和NDM-1,后续具体操作参考文献[12]进行耐药基因PCR扩增,并将产物送至上海吉凯生物有限公司进行测序鉴定。引物序列见表1。
1.3 统计学方法
采用SPSS 20.0统计学软件对所得数据进行分析,计数资料采用百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 耐药情况
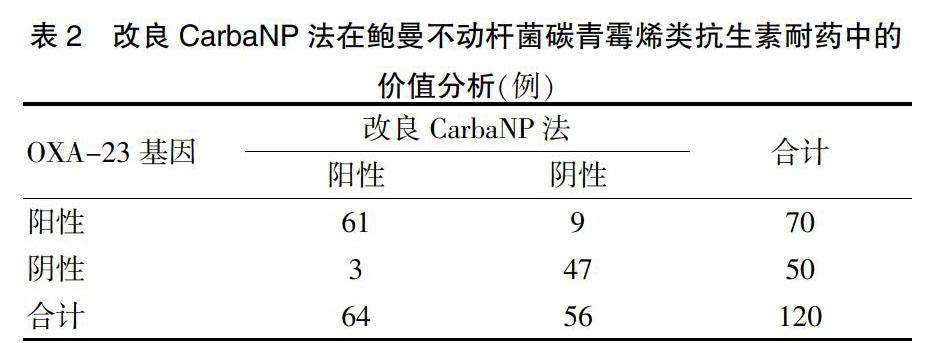
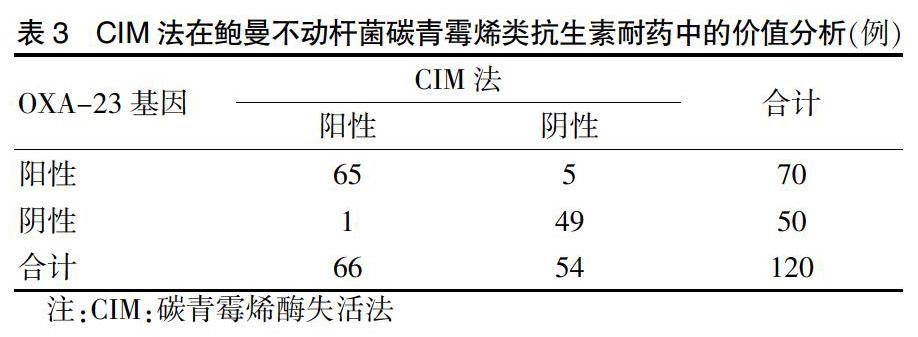
120株鲍曼不动杆菌中,74株碳青霉烯类抗生素耐药,占比为61.67%;46株碳青霉烯类抗生素敏感,占比为38.33%。100株铜绿假单胞菌中,60株碳青霉烯类抗生素耐药,占比为60.00%;40株碳青霉烯类抗生素敏感,占比为40.00%。
2.2 碳青霉烯酶相关编码基因检测结果
74株碳青霉烯类抗生素耐药鲍曼不动杆菌中,碳青霉烯酶A类基因检测均为阴性,碳青霉烯酶B类基因中,IMP基因阳性1株,碳青霉烯酶D类基因中,OXA-23基因阳性70株;46株碳青霉烯类抗生素敏感中,OXA-23基因阴性44株,碳青霉烯酶A类和B类均为阴性;60株碳青霉烯类抗生素耐药铜绿假单胞菌中,VIM-1阳性56株,IMP-4阳性1株,KPC-2和NDM-1检测均为阴性;40株碳青霉烯类抗生素敏感铜绿假单胞菌中,VIM-1阴性37株,KPC-2和NDM-1检测均为阴性。
2.3 改良CarbaNP法和CIM法检测结果
120株鲍曼不动杆菌中,改良CarbaNP阳性64株,阴性56株;CIM法阳性66株,阴性54株。100株铜绿假单胞菌中,改良CarbaNP阳性55株,阴性45株;CIM法阳性56株,阴性44株。
2.4 改良CarbaNP法和CIM法在鲍曼不动杆菌中的检测效能比较
在鲍曼不动杆菌中,OXA-23基因携带率为94.59%(70/74),以其为标准,在检测鲍曼不动杆菌碳青霉烯类抗生素耐药方面上,基因检测法与改良CarbaNP法比较,差异无统计学意义(χ2 = 2.736,P = 0.098)。见表2。基因检测法与CIM法比较,差异无统计学意义(χ2 = 2.551,P = 0.110)。见表3。改良CarbaNP法和CIM法分别与基因检测结果比较,CIM法的敏感性(90.74%,49/54)和特异性(98.48%,65/66)均略高于改良CarbaNP法的敏感性(83.93%,47/56)和特异性(95.31%,61/64),但差异无统计学意义(χ2 = 1.149, P = 0.284;χ2 = 1.096,P = 0.295)。见表2~3。
2.5 改良CarbaNP法和CIM法在铜绿假单胞菌中的检测效能比较
在铜绿假单胞菌中,VIM-1阳性携带率为93.33%(56/60),以其为标准,在检测铜绿假单胞菌碳青霉烯类抗生素耐药方面上,基因检测法与改良CarbaNP法比较,差异无统计学意义(χ2 = 0.364,P = 0.546)。见表4。基因检测法与CIM法比较,差异无统计学意义(χ2 = 0.324,P = 0.569)。见表5。改良CarbaNP法和CIM法分别与基因检测结果比较,CIM法的敏感性(95.56%,43/45)和特异性(98.18%,54/55)均略高于改良CarbaNP法的敏感性(86.96%,40/46)和特异性(92.59%,50/54),但差异无统计学意义(χ2 = 3.751,P = 0.053;χ2 = 1.945,P = 0.163)。见表4~5。
3 讨论
近年,鲍曼不动杆菌和铜绿假单胞菌分离率呈上升趋势,多见于有基础疾病、有重大外科手术史或长期住院患者,不利于疾病的恢复及预后[13]。有数据统计,院内鲍曼不动杆菌和铜绿假单胞菌感染可明显提高患者死亡率,可高达40%,并与多重耐药相关[14]。研究发现,细菌对碳青霉烯类药物的耐药机制主要包括产碳青霉烯酶、外膜孔蛋白通透性下降,外排泵的过度表达和药物作用靶位改变3种,前者是其主要机制[15]。碳青霉烯酶是指能够明显水解至少一类-β内酰胺酶(亚胺培南或美罗培南),主要由碳青霉烯酶编码基因决定,根据Amble分子分类法,将其分为丝氨酸酶-A类,包括KPC,金属酶-B类,包括VIM和IMP和D类,包括OXA[16]。研究发现,D类的水解作用是鲍曼不动杆菌耐碳青霉烯类的最重要原因,尤以OXA-23多见[17]。而IMP和VIM在铜绿假单胞菌中常见[18]。本研究选取KPC、GES、IMP、VIM与OXA-23作为鲍曼不动杆菌碳青霉烯酶检测基因,选取VIM-1、IMP-4、KPC-2和NDM-1作为铜绿假单胞菌碳青霉烯酶检测基因,发现OXA-23基因携带率为94.59%,VIM-1基因携带率为93.33%,与前述结论基本一致,并作为本研究鲍曼不动杆菌和铜绿假单胞菌碳青霉烯酶耐药的金标准,而其他鲍曼不动杆菌虽表现为碳青霉烯类药物耐药,但其耐药基因表型不是D类,可能是由其他机制介导。
鉴于临床鲍曼不动杆菌和铜绿假单胞菌感染的严峻形势,2015年CLSICarba NP试验作为碳青霉烯酶的生化检测方法,多用于流行病学调查和感染控制,并展现了其在肠杆菌和绿脓种的价值,但对不动杆菌产生的大量D类碳青霉烯酶不敏感,与蛋白抽提液有关,改良CarbaNP法则用高渗5 mol/L NaCl取代蛋白抽提液,使细菌完全溶解,菌量和酶释放量明显增加[19-23]。CIM法是由Kim van der Zwaluw等研究的一种新型碳青霉烯酶表型检测方法,目前在对VIM、IMP、OXA-23、KPC、NDM和OXA-48基因介导的碳青霉烯酶耐药与基因检测结果符合率基本一致[24]。在本研究鮑曼不动杆菌和铜绿假单胞菌碳青霉烯酶检测中,改良CarbaNP法与基因检测法比较,差异无统计学意义(P > 0.05),CIM法和基因检测法比较,差异无统计学意义(P > 0.05),提示改良CarbaNP法和CIM法在鲍曼不动杆菌和铜绿假单胞菌碳青霉烯酶检测中均具有一定价值,与前述结论基本一致。但本研究还发现,CIM法敏感性和特异性均略高于改良CarbaNP法,提示CIM法在鲍曼不动杆菌和铜绿假单胞菌碳青霉烯酶检测中优于改良CarbaNP法,但本研究标本量有限,暂未发现其显著性差异,后续可继续探讨。
综上认为,改良CarbaNP法和CIM法在鲍曼不动杆菌和铜绿假单胞菌耐碳青霉烯类抗生素快速检测中均具有一定价值,以后者检测效能较好。
[参考文献]
[1] 邱万臣,杨靖,时东彦,等.应用Carba NP方法检测耐碳青霉烯类抗生素鲍曼不动杆菌和铜绿假单胞菌[J].河北医科大学学报,2017,38(7):847-850.
[2] 刘丽,白光锐,冯春晓,等.2015年齐齐哈尔市第一医院细菌耐药性监测[J].中国感染与化疗杂志,2017,17(4):433-438.
[3] 乔甫,宗志勇.世界卫生组织《医疗机构耐碳青霉烯的肠杆菌科细菌、铜绿假单胞菌和鲍曼不动杆菌防控指南》介绍[J].华西医学,2018,33(3):259-263.
[4] 邓杰伦,敖科萍,王远芳,等.2012-2016年鲍曼不动杆菌季度性耐药规律分析[J].四川医学,2019,40(3):245-248.
[5] 戴璧然,曲琳琳,李善骥,等.2006年与2016年某院神经外科鲍曼不动杆菌临床耐药性分析[J].中国实验诊断学,2017,21(8):1323-1324.
[6] 马维佳,徐绣宇,孙坤玲,等.Carba NP法与改良Hodge试验检测产碳青霉烯酶肠杆菌的方法学评价[J].中华微生物学和免疫学杂志,2016,36(1):64-65.
[7] 张保荣,毕茹茹,顾兵.肠杆菌科细菌碳青霉烯酶表型检测方法研究进展[J].中国感染控制杂志,2018,17(2):175-180.
[8] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:645-650.
[9] 张雅薇,王辉.2015年CLSI M100-S25主要更新内容介绍[J].中华检验医学杂志,2015,38(4):229-232.
[10] 杨靖,牛翠,赵建宏,等.评价CIM方法在肠杆菌科细菌碳青霉烯酶表型检测中的临床应用价值[J].中华检验医学杂志,2016,39(12):969-971.
[11] Shibata N,Doi Y,Yamane K,et al. PCR typing of geneticde-terminants for metallo-beta-lactamases and integrases carried by gram-negative bacteria isolated in Japan,with focus on the class 3 integron [J]. J Clin Microbiol,2003,41(12):5407-5413.
[12] 陈志雄,林峰,林艳,等.鲍曼不动杆菌碳青霉烯酶基因分布与耐药相关性研究[J].中国微生态学杂志,2018, 30(2):177-180.
[13] 彭立悦,孙建萍,张京岚.呼吸机相关性肺炎病原学及感染耐碳青霉烯类革兰阴性菌危险因素与预后分析[J].心肺血管病杂志,2017,36(9):721-727.
[14] Peleg AY,Seifert H,Paterson DL. Acinetobacter baumannii:Emergence of a Successful Pathogen [J]. Clin Microbiol Rev,2008,21(3):538-582.
[15] 甘泳江,陆芸芸,韦香妮.我院2016年碳青霉烯类抗生素使用强度与革兰阴性杆菌耐药率相关性分析[J].药物流行病学杂志,2017,26(11):771-773.
[16] 张春玲,陈慧红,牛津,等.碳青霉烯类抗菌药物耐药鲍氏不动杆菌分布和耐药基因检测[J].中华医院感染学杂志,2017,27(1):24-27.

