不同培养介质中N-二甲基亚硝胺对干酪乳杆菌生长影响
王淑梅,易华西,邸 维,谢玉峰,蔺彬彬,张兰威
(1.哈尔滨学院 食品工程学院,黑龙江 哈尔滨 150086;2.中国海洋大学食品科学与工程学院,山东 青岛 266100;3.广东科贸职业技术学院 食品与生物工程学院,广东 广州 510430)
N-亚硝基化合物具有很强的致癌作用,是食源性致癌物之一[1-2]。其中的N-二甲基亚硝胺(N-dimethyl nitrosamine,NDMA)具有最强的致癌能力,能直接损伤组织细胞脱氧核糖核酸(deoxyribonucleic acid,DNA),摄入后不需代谢活化即可在消化道接触部位水解为活性物质而诱发癌症。
乳酸菌是人体有益菌,在N-亚硝基化合物诱发人肠道癌变过程起降低其遗传毒性作用[3-4],降低消化道癌症的发病率[5-6]。研究表明,乳酸菌可通过吸附结合或降解肠道内的N-亚硝基化合物[6-8],或通过减弱炎症反应而抑制其对肠黏膜的损伤[9]。如双歧杆菌可抑制N-亚硝基化合物对肠道的毒性损伤[7],而植物乳杆菌显著降低泡菜中NDMA的含量,抑制NDMA生成[10]。在MRS培养基中,戊糖乳杆菌(Lactobacillus pentosus)R3显著降低N-亚硝基化合物的浓度,其菌体细胞壁表面蛋白降低了22.05%的NDMA,23.31%的N-二乙基亚硝胺(N-diethyl nitrosamine,NDEA)[11]。由于乳酸菌在人体肠道内必须保持足够的数量,并耐受住胃肠液消化,最终黏附于肠上皮才能发挥功能[12]。因此,乳酸菌的益生功能与其在肠道内存活数量及停留时间直接相关。但是乳酸菌在抑制NDMA毒性作用时,NDMA对其生长是否有影响还鲜见相关报道。
本研究以干酪乳杆菌SB27为研究对象,分析其对胃液、肠液耐受性及肠上皮细胞黏附性,检测NDMA在不同培养介质中对SB27生长影响,旨在为进一步明确干酪乳杆菌SB27降解NDMA及菌株发挥功能的关键成分提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞和菌株
人结肠癌细胞HT-29:中国医学科学院肿瘤研究所;干酪乳杆菌(Lactobacillus casei)SB27:分离自甘肃北部的牦牛乳,现保存于哈尔滨工业大学化学工程与技术学院。
1.1.2 化学试剂
N-二甲基亚硝胺(N7756):美国Sigma-Aldrich公司;细菌DNA提取试剂盒(D2501-01):美国Omega公司;青霉素/链霉素、胰酶消化液:美国Corning公司;胎牛血清:杭州四季青有限公司。
1.1.3 培养基
RPMI 1640培养基:美国Corning公司。
MRS液体培养基:蛋白胨10 g/L,牛肉膏8 g/L,酵母浸粉5 g/L,葡萄糖20 g/L,吐温-80 1.0 mL/L,磷酸氢二钾2 g/L,柠檬酸氢二胺2 g/L,七水硫酸镁0.58 g/L,三水乙酸钠5 g/L,硫酸锰0.25 g/L,蒸馏水1 000 mL,调整pH 6.2~6.6,于121 ℃高压灭菌15 min。
MRS固体培养基:MRS液体培养基中添加18 g/L琼脂,121 ℃高压灭菌15 min。
低氮源MRS(MRS N)培养基:将MRS液体培养基中的蛋白胨、牛肉膏、柠檬酸氢二胺等含氮成分去掉,并且将酵母浸粉从5 g降为1 g,121 ℃高压灭菌15 min。
1.2 仪器与设备
HEPA1100二氧化碳培养箱、Forma 102厌氧培养箱:美国Thermo Electron公司;CX31电子显微镜:日本Olympus公司;Sartorius AG PB-10 pH计:德国Sartorius公司;3-30K低温高速离心机:美国Sigma公司;LDZX-40AI高压灭菌锅:上海申安医疗器械厂;HWS24数显恒温水浴锅:上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 磷酸盐缓冲液及NDMA工作液的制备
磷酸盐缓冲液(phosphate buffer solution,PBS)的制备:磷酸二氢钾0.24 g/L、磷酸氢二钠1.42 g/L、氯化钠8.0 g/L、氯化钾0.2 g/L,将以上试剂溶解于500 mL蒸馏水中,用1 mol/L氢氧化钠溶液校正pH值为6.2~6.3,蒸馏水稀释至1 000 mL,121 ℃高压灭菌15 min。
将NDMA溶于双蒸水中,配成10 mg/mL储备液[13],4 ℃保存。实验中将10 mg/mL储备液稀释成1 000 μg/mL工作液,4 ℃保存备用。
1.3.2 菌株活化及活菌计数法
在无菌操作下从已溶解的管中吸取50 μL菌液,滴入装有MRS液体培养基的试管中,轻微振荡,37 ℃培养18 h,活化2代后备用。
活菌计数采用倾注平板法。取适当稀释度的菌液1 mL加入无菌空培养皿中。将温度为45~50 ℃的MRS琼脂培养基向已接种菌液的平皿内倾注15~20 mL,边倾注边摇匀,静置30 min,翻转使平皿底朝上,37 ℃培养48 h,计数菌落数。
1.3.3 菌株SB27益生功能测定
(1)菌株SB27对酸耐受能力测定
依据WANG S等[14]方法进行模拟胃液耐受性实验。将已活化的干酪乳杆菌SB27培养液离心(5000×g,15min,4℃),预冷的PBS(pH 7.2)清洗后悬于5 mL模拟胃液[15]中。模拟胃液是经盐酸酸化的PBS(含胃蛋白酶3 mg/mL),pH值分别调整为1.5、2.0和2.5。采用倾注平板法,在0 h和3 h计数菌落数。以单位体积内存活的菌落数(CFU/mL)对数值来评价其对胃液的耐受性。
(2)菌株SB27对胆盐耐受能力测定
将已活化的干酪乳杆菌SB27培养液离心(5 000×g,15 min,4 ℃),预冷的PBS(pH 7.2)清洗,悬于5 mL模拟小肠液[15]中。模拟小肠液是含牛胆盐的PBS(含胰酶1 mg/mL,pH 8),牛胆盐添加量分别为0.15%、0.30%和0.45%。利用倾注平板法,在0 h和4 h测定其存活率[14]。评定方法同上。
(3)菌株SB27黏附性能测定
将无菌酸洗玻璃盖玻片加入6孔组织培养板中,再向每孔加入2 mL的HT-29细胞悬液(2×105个/mL),于5%CO2、95%空气、37 ℃条件培养,至6孔板底部单层细胞形成,用预冷的PBS(pH 7.2)清洗细胞两次[14]。
取活化好的干酪乳杆菌SB27菌体培养液1mL,加入1mL的RPMI 1640培养液制成2 mL菌悬浮液,加入6孔板中,于上述培养条件继续培养2 h。培养结束后,预冷PBS(pH 7.2)清洗,加入2 mL甲醇室温固定1 h。弃甲醇加入革兰氏染液,于显微镜下计数。记录视野下100个HT-29细胞黏附的干酪乳杆菌SB27细菌数,随机选取20个视野,计算平均值。
1.3.4 NDMA在各培养基中对菌株SB27生长影响的测定
(1)MRS液体培养基
将NDMA工作液加入MRS培养液中,使NDMA终质量浓度为5μg/mL、10μg/mL、20μg/mL、40μg/mL、80μg/mL[16],对照组为MRS培养液(0 μg/mL)。将已活化的SB27以4%接种量加入上述培养液中,37 ℃培养168 h,每隔24 h采用倾注平板法计数菌落数。
(2)MRS N培养基
将NDMA工作液加入MRS N培养液中,使NDMA终质量浓度为5μg/mL、10μg/mL、20μg/mL、40μg/mL、80μg/mL,对照组为MRS N培养液。将已活化的干酪乳杆菌SB27离心,弃培养液,重新悬于MRS N培养液中,再以4%的接种量加入各实验组中,培养及计数方法同上。
(3)PBS缓冲液
将NDMA工作液加入PBS缓冲液(6.2~6.3)中,使NDMA终质量浓度为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL,对照组为PBS缓冲液。将已活化的干酪乳杆菌SB27离心,去培养液,再用PBS缓冲液清洗菌体2次,以4%接种量加入各实验组中,培养及计数方法同上。
1.3.5 数据处理及统计分析
实验重复3次,利用SAS 9.1软件进行方差分析,结果表示为平均值±标准偏差(±SD),显著性水平设定为P<0.05。
2 结果与分析
2.1 菌株SB27胃肠液耐受性
功能性乳酸菌若要在肠道中发挥作用首先需耐受胃肠道的消化,且能在肠道内定植,这是筛选益生菌的首要条件,人体胃、肠道环境是不断变化的。空腹时胃液pH值可低至1.5,进食后可升高至6.0[17]。一般情况下,人体胃液pH值为1.5~3.5[18-19]。进食1 h内,胆盐添加量变化为1.5%~2.0%,而后下降至0.30%[18-20]。由于食物在胃内排空的时间约为3 h[20],在小肠内排空时间约为4 h。为保证实验条件尽可能反应出SB27在人体肠道内的生存情况,本研究将胃液pH值设定为1.5、2.0和2.5,胆盐添加量设定为0.15%、0.30%和0.45%。菌株SB27在模拟胃液、肠液的生存能力结果见图1。
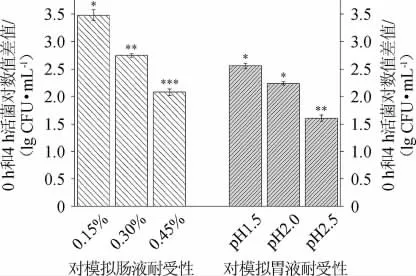
图1 菌株SB27对模拟胃、肠液的耐受性Fig.1 Tolerance of strain SB27 to simulate gastric and intestinal fluids
由图1可知,在pH 2.5酸性条件下培养3 h,菌株SB27显示出最强的生存力(存活率9.55%);在pH 2.0时,干酪乳杆菌SB27生存力较低(存活率2.45%);然而当pH 1.5时,菌株SB27生存力很低,存活率仅为0.26%。有研究显示,益生菌在pH 1.0和pH 2.0的酸性条件下生存力很低[21],如双歧杆菌在pH 2.0的酸性条件下生存能力很弱[22];但是当pH值为3.0时,菌株的生存能力则增强[21]。因此,一般认为乳酸菌可耐受胃液pH 2.5~3.5的酸性环境[19]。本研究结果也显示干酪乳杆菌SB27可耐受胃液pH 2.0~2.5的酸性环境,但不能耐受胃液pH 1.5的酸性环境。
胆盐添加量为0.45%时,0 h和4 h干酪乳杆菌SB27活菌对数值差值(ΔlgCFU/mL)为3.02,菌株SB27存活率<0.1%,生长显著被抑制(P<0.05)。当胆盐添加量为0.30%时,培养4 h后SB27的存活率有所提高,为1.66%。而当胆盐添加量减少到0.15%时,干酪乳杆菌SB27的存活率提高到7.94%,显著高于胆盐添加量为0.45%组(P<0.05)。相比于胃液耐受性,菌株SB27对胆盐的耐受性略差些。综合以上结果,菌株SB27可耐受胃、肠液的消化,可进行后续研究。
2.2 菌株SB27的黏附性能
本研究选用HT-29细胞模拟肠道上皮[19]。HT-29细胞具有人肠上皮细胞的相关特性,常被用于黏附能力的测定[12,23]。益生菌的黏附性能采用黏附值来评定,即视野下100个HT-29细胞黏附的细菌数,随机选20个视野计算平均值。若细菌数<40,表示没有黏附性;细菌数40~100之间,具有黏附性;细菌数>100表示具有强黏附性[24]。
乳酸菌的黏附性能是其发挥抑菌功能[24]和益生功能的前提条件[25]。人体摄入乳酸菌后,在胃酸、小肠液消化作用下,其生长繁殖受到一定影响。若乳酸菌具有良好的黏附性能,则能延长其在人体肠道内停留的时间,有利于菌株的生长与繁殖,产生更多子代细胞。BAO Y等[20]依据菌株耐受胃酸和小肠液能力、黏附能力、抑制致病菌能力等获得菌株L.fermentumF6。ZHANG Y C等[26]通过抑菌性能、黏附性能、耐酸和耐胆盐性能等获得具有益生功能的菌株L.johnsoniiF0421。本研究结果显示菌株SB27黏附值为52.53±1.81,说明SB27具有一定的黏附性能,有利于其益生功能的发挥。
2.3 NDMA在MRS培养基中对菌株SB27生长的影响
NDMA在MRS培养基中对干酪乳杆菌SB27生长的影响结果见表1。

表1 不同N-二甲基亚硝胺添加量在MRS培养基中对菌株SB27生长的影响Table 1 Effect of different N-dimethyl nitrosamine addition on the growth of strain SB27 in MRS medium
由表1可知,培养1~7 d,干酪乳杆菌SB27活菌数(lgCFU/mL)并未随着NDMA浓度增加而发生显著变化,各组差异均不显著(P>0.05)。同时,各实验组菌落数在1~3 d内呈现增长趋势;从第4天开始,菌落数开始下降,表明干酪乳杆菌SB27生存能力逐渐下降。第1天,对照组和实验组菌落数均达到108个CFU/mL;与第1天相比,各组菌落数在第2天均有显著增加(P<0.05),最高增加了7.24倍(20 μg/mL组),最低增加了2.57倍(40 μg/mL组),对照组菌落数增加3.09倍;第2~3天,仅对照组、5 μg/mL、10 μg/mL和40 μg/mL组菌落数缓慢增加,分别增加了1.48、1.32、1.15、1.23倍;第3~7天,菌株生存能力逐渐下降,培养至第7天,各组菌落数均下降到第3天的0.2%以下。
NOWAK A[16]报道,含有NDMA的MRS中培养24 h,Lb.rhamnosus0908活菌数达109个CFU/mL,NDMA(2~100 μg/mL)对其生长无显著影响(P>0.05)。本研究结果表明,在MRS液体培养基中培养0~7 d,对照组与NDMA各剂量组菌落数具有相似的变化趋势,剂量组间差异不显著(P>0.05),表明在MRS培养基中NDMA(0~80 μg/mL)对干酪乳杆菌SB27生长无显著影响(P>0.05)。
2.4 NDMA在MRS N培养基中对菌株SB27生长的影响
由表2可知,在MRS N培养基中,干酪乳杆菌SB27生长受到一定程度抑制,随培养时间延长(0~7 d)活菌数呈指数下降趋势。培养1~2 d,各组SB27菌落数差异不显著(P>0.05),菌落数不随NDMA剂量增加而发生显著变化。培养至第3天,所有组活菌数均降至第1天的0.2%以下,对照组活菌数显著低于NDMA实验组(P<0.05)。这说明干酪乳杆菌SB27在无N源培养基中被迫利用NDMA的N源维持生长。培养至第4天,所有组活菌数极低,对照组与NDMA实验组的菌落数差异显著(P<0.05);随着NDMA剂量增加(5~40 μg/mL),干酪乳杆菌SB27活菌数增加,但80 μg/mL组活菌数又下降。培养至第5天,对照组已检测不出活菌落,其他实验组的活菌检出数均低于100个CFU/mL,5 μg/mL和80 μg/mL组活菌数低于10 μg/mL、20 μg/mL、40 μg/mL。
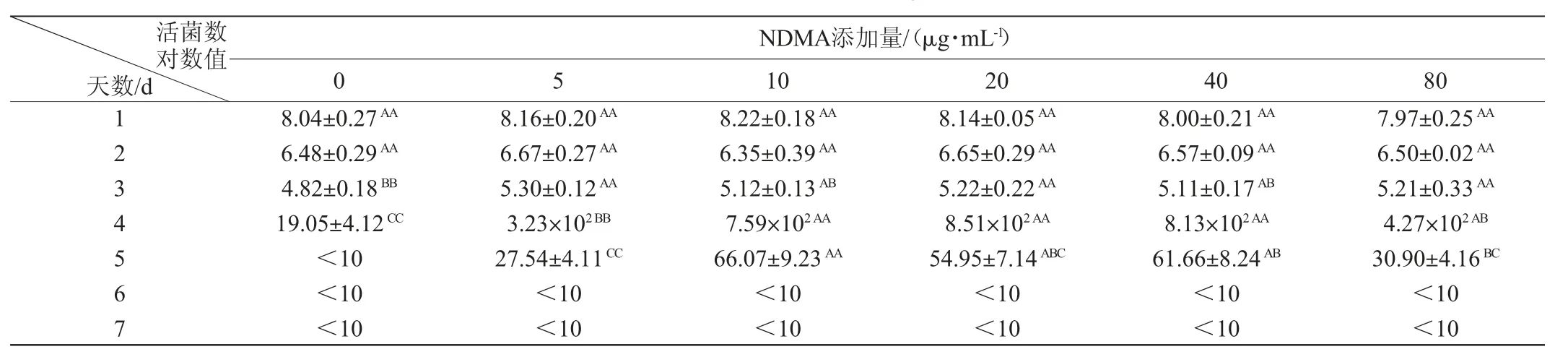
表2 不同N-二甲基亚硝胺添加量在MRS N培养基中对菌株SB27生长的影响Table 2 Effect of different N-dimethyl nitrosamine addition on the growth of strain SB27 in MRS N medium
GRILL J P等[27]研究显示,在TPY培养液(胰蛋白胨、蛋白胨、酵母浸提物)中,NDMA(2~200 μg/mL)对长双歧杆菌BB536生长(0~24 h)没有显著影响。TPY为含N源但无刺激因子的培养基,说明无刺激因子条件下长双歧杆菌仍能存活,但是该研究并未能解释乳酸菌在营养缺乏情况下能否有效利用NDMA来维持生长。由于NDMA并不能提供乳酸菌生长所需的刺激因子,因此,本研究将MRS改成低N源但有刺激因子的培养基,考察干酪乳杆菌SB27是否利用NDMA中的N源维持生长。由表2实验结果推测,低N源MRS培养基迫使干酪乳杆菌SB27利用NDMA的N维持基本生长,当低剂量组NDMA的N源被耗尽,干酪乳杆菌SB27的存活力也逐渐下降,而高剂量的NDMA又显示出对干酪乳杆菌SB27的毒性作用。
2.5 NDMA在PBS缓冲液中对菌株SB27生长的影响

表3 不同N-二甲基亚硝胺添加量在PBS缓冲液中对菌株SB27生长的影响Table 3 Effects of different N-dimethyl nitrosamine addition on the growth of strain SB27 in phosphate buffer
由表3可知,在PBS中,随着培养时间延长各组活菌落数呈现指数下降趋势;但随着NDMA剂量的增加,菌株SB27活菌落数并未发生显著变化,无剂量依赖性。培养至第4天,各组的活菌落数均低于100个CFU/mL。而培养至第5天,空白对照组和NDMA实验组均无活菌落检出。结果表明,NDMA在PBS缓冲液(pH 6.2~6.3)中对干酪乳杆菌SB27生长无显著影响(P>0.05)。
3 结论
本研究对分离自甘肃牦牛乳并具有潜在益生功能的干酪乳酸菌(Lactobacillus casei)SB27进行胃液、肠液耐受性及肠上皮细胞黏附性能研究;同时又分析在不同培养介质中NDMA对干酪乳酸菌SB27生长存活的影响。研究结果显示,干酪乳酸菌SB27可耐受模拟胃、肠液的分解;具有良好的黏附性能;在MRS、MRS N、PBS培养液中,NDMA对干酪乳酸菌SB27生长及存活没有显著影响。说明干酪乳杆菌SB27具有一定益生功能,且不受NDMA的毒性损伤,为后续研究提供了理论基础。接下来可对干酪乳杆菌SB27进行降低NDMA浓度或毒性影响的研究,并进一步探究干酪乳杆菌SB27发挥此功能的关键因子。

