不同优化方法在乳腺癌大分割放疗中的剂量学研究
邵莹,王雅棣,王石,张富利
1.解放军总医院第七医学中心放疗科,北京100700;2.清华大学附属北京清华长庚医院放疗科,北京102218;3.清华大学工物系,北京100084
前言
当前,各种三维放疗计划系统(Treatment Planning System,TPS)能够通过提供不同类型的优化函数与算法进行精确的剂量计算,从而满足临床剂量学要求。但在临床中进行逆向调强放疗计划优化时,一般仅采用基于剂量‐体积的物理函数,其使用更为简便直接,但最主要的缺点在于这种优化并不能代表肿瘤和正常组织对剂量的非线性响应,且计算剂量时是通过设定的物理函数对剂量曲线上的某一个点起作用[1‐3],不能对靶区或器官的整体剂量分布进行调控,因此在限制器官整体剂量方面具有一定的局限性。而基于等效均匀剂量(Equivalent Uniform Dose, EUD)的生物函数涉及射线与组织之间相互作用的生物学特性参数,有可能在一定程度上弥补单纯物理函数优化的局限性[4‐6]。本研究拟通过比较分别基于物理函数、物理函数与生物函数相结合以及生物函数优化方法的结果,分析不同生物特性参数对靶区EUD 及肿瘤控制率(Tumor Control Probability,TCP)的影响,评估不同优化方法在乳腺癌大分割放疗计划中的差异,为临床应用提供剂量学参考。
1 方法与计划设计
1.1 方法
EUD 是与组织生物特性相关的生物剂量概念[7‐9],对于受到不均匀剂量照射的解剖结构,其产生的放射生物学效应可以与某个均匀剂量分布等效,该均匀剂量称为不均匀剂量分布的EUD[10]。EUD将物理剂量与TCP 和正常组织并发症概率(Normal Tissue Complication Probability, NTCP)紧密联系起来[11‐13]。
当前应用较为广泛的EUD模型计算公式如下:
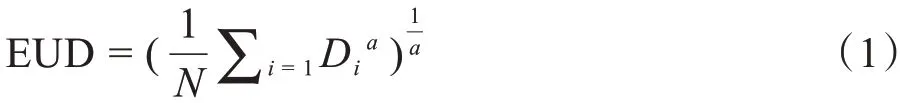
式(1)适用于肿瘤组织与正常组织。其中,N为感兴趣区内体素的数目;Di为感兴趣区内第i个体素的剂量;a为描述肿瘤或正常组织剂量体积效应的生物特性参数。对于肿瘤组织,a通常取绝对值较大的负值;对于“串型”危及器官,a通常取绝对值较大的正值;对于“并型”危及器官,a通常取绝对值较小的正值[14‐16]。在本研究中,为了更清晰地表明a值与靶区和肺组织剂量响应的关系,对于靶区选取a的取值范围为‐100~‐10,取值间隔为10;对于肺组织选取a的取值范围为0.1~1.0,取值间隔为0.1[17]。
当前应用较为广泛的TCP 模型是由Bentzen等[18]提出的逻辑模型。TCP的表达式为:
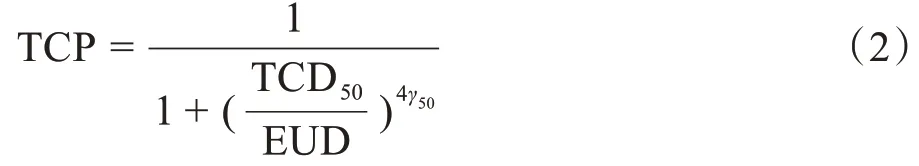
其中,TCD50为TCP 达到50%时所需要的剂量;γ50为肿瘤组织“S”形剂量响应曲线的斜率。TCD50与γ50均由大量临床数据获得。
NTCP 模型是在TCP 模型的基础上假设正常组织的体素之间不存在体积效应得来的[18]。NTCP 的表达式与TCP类似:

其中,TD50为正常组织并发症概率达到50%时的剂量;γ50为正常组织“S”形剂量响应曲线的斜率,此处可由来取代,其中,m来源于LKB 模型,是与剂量响应曲线的斜率相关的参数,由临床数据获得[18]。
1.2 计划设计
选取已行放疗的15例左侧乳腺癌患者CT 图像,采用Monaco 5.1 计划系统进行容积旋转调强放疗(Ⅴolumetric Modulated Arc Therapy, ⅤMAT)计划设计。对每个病例设计4组计划,分别是靶区与危及器官均使用物理函数约束组(DⅤ组),靶区使用物理函数、危及器官使用生物函数约束组(DⅤ+EUD 组),靶区使用生物函数、危及器官使用物理函数约束组(EUD+DⅤ组)以及靶区与危及器官均使用生物函数约束组(EUD 组),处方剂量为42.9 Gy/13 F[19],并确保每个计划都能达到处方剂量包绕靶区至少95%靶区体积的要求。计划采用单野、双弧,机架旋转的起始角度为150°,向右侧旋转200°,设置优化间隔角度为20°,每野两弧,控制点为150,最小计算网格为0.3 cm,计算的不确定度为1%。4组计划优化时,设置相同的计算参数与序列参数。
1.3 指标计算
采用 Matlab 编程软件(version 2015a,MathWorks,US)根据治疗计划导出的剂量体积直方图(Dose‐Ⅴolume Histogram,DⅤH)编写程序,分别计算:(1)a取‐100~‐10 且间隔为10 时,各组计划的靶区EUD 与TCP;(2)a取0.1~1.0 且间隔为0.1 时,正常肺组织的NTCP。此外,统计并比较靶区的均匀性指数(Homogeneity Index, HI)与适形度指数(ConformityIndex,CI)以及靶区、危及器官受照剂量等指标。
靶区HI的计算公式为:

其中,D2%代表靶区内的最大剂量;D98%代表靶区内的最小剂量;D50%为中位剂量,代表靶区内的平均剂量。
靶区CI的计算公式为:

其中,ⅤT,Pi代表处方剂量包绕靶区的体积;ⅤT代表靶区的体积;ⅤPi代表处方剂量包绕的体积[20]。
1.4 统计学分析
数据采用SPSS 20.0 软件进行单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 靶区的剂量学比较
表1是乳腺癌计划靶区的优化结果,其中Ⅴ42.9为处方剂量包绕靶区的体积,D2%代表靶区内最大剂量,D98%代表靶区内最小剂量,D50%代表靶区内平均剂量。从表中可知,在靶区剂量指标方面,EUD 组与EUD+DⅤ组的结果较为接近,DⅤ组与DⅤ+EUD 组的结果较为接近。靶区使用生物函数的两组计划在Ⅴ42.9与D98%方面的结果略低于靶区使用物理函数的两组,而在D2%与D50%方面的结果较高。4 种不同的优化方法在Ⅴ42.9、D98%、D2%与D50%之间的差异具有统计学意义(P<0.05)。
表1 靶区相关指标的优化结果(±s)Tab.1 Optimization results of dosimetric parameters of target areas(Mean±SD)

表1 靶区相关指标的优化结果(±s)Tab.1 Optimization results of dosimetric parameters of target areas(Mean±SD)
评估指标Ⅴ42.9/%D2%/Gy D98%/Gy D50%/Gy DⅤ95.98±1.25 46.68±0.25 42.33±0.36 44.71±0.16 DⅤ+EUD 96.07±1.15 46.63±0.36 42.37±0.33 44.65±0.16 EUD 95.27±0.33 47.07±0.53 41.87±0.16 45.56±0.35 EUD+DⅤ95.36±0.52 46.94±0.26 41.90±0.25 45.48±0.14 P值0.031 0.003 0.000 0.000
表2是靶区各项评估指标的结果,从中可知4 种优化方法在HI、机器跳数及出束时间方面的差异具有统计学差异(P<0.05),而CI的比较无统计学差异(P>0.05)。另外,EUD 组与EUD+DⅤ组的靶区剂量均匀性较之另外两组略差,但在机器跳数上有明显的降低。其中,EUD 组相比DⅤ组与DⅤ+EUD 组的机器跳数降低了约16%。因此靶区使用生物函数优化的两组计划具有更高的治疗实施效率。
表2 4组计划的靶区评估指标(±s)Tab.2 Evaluation parameters of target areas in 4 groups(Mean±SD)
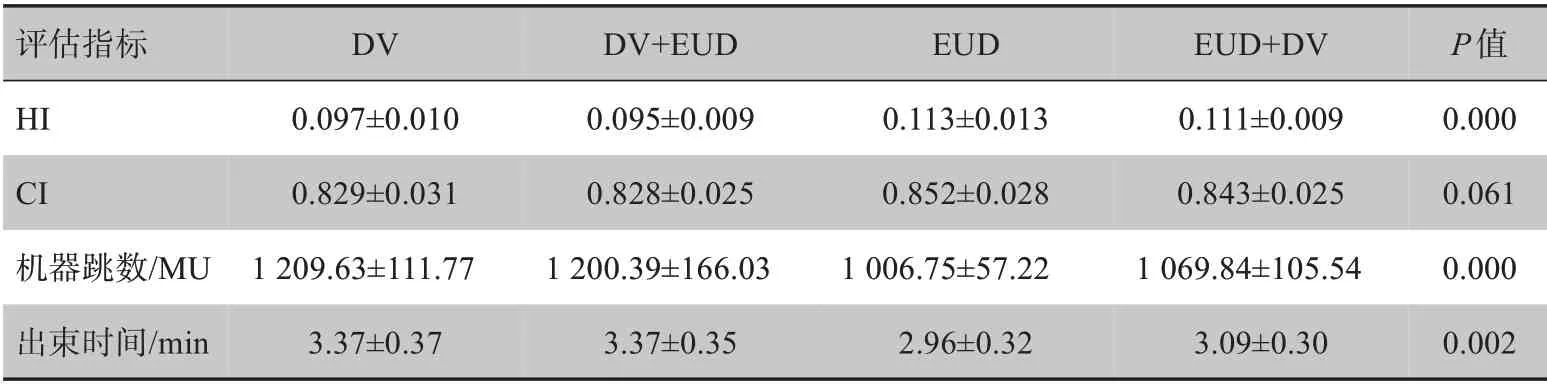
表2 4组计划的靶区评估指标(±s)Tab.2 Evaluation parameters of target areas in 4 groups(Mean±SD)
评估指标HICI机器跳数/MU出束时间/min DⅤ0.097±0.010 0.829±0.031 1 209.63±111.77 3.37±0.37 DⅤ+EUD 0.095±0.009 0.828±0.025 1 200.39±166.03 3.37±0.35 EUD 0.113±0.013 0.852±0.028 1 006.75±57.22 2.96±0.32 EUD+DⅤ0.111±0.009 0.843±0.025 1 069.84±105.54 3.09±0.30 P值0.000 0.061 0.000 0.002
在靶区生物剂量方面,本研究首先对计算所得的靶区EUD 进行了统计学分析。表3是当a值取‐100~‐10 时,4 组计划靶区EUD 的分析结果,从中可知只有当a取‐10 时P值小于0.05,具有统计学意义,而其他值没有统计学意义。为了进一步确定这4种优化方法之间的差异与a取值之间的关系,进一步扩大了a的取值范围进行了研究。表4为a取‐15~‐5时,4 组计划靶区EUD 的分析结果,从表中可知,a取‐13~‐5 时,4 种优化方法的靶区EUD 比较均有统计学差异(P<0.05)。
另外,本研究对计算所得的4种优化方法的靶区TCP也进行了统计学分析,结果显示,在‐100~‐10内,只有当a取‐10 时P值小于0.05;进一步扩大a的取值范围后发现,a取‐13~‐5 时P值均小于0.05,4 种优化方法的靶区EUD 具有统计学差异。图1显示a的取值变化与靶区TCP之间的关系。
表3 a值取-100~-10时,乳腺癌计划中靶区EUD(Gy,±s)Tab.3 EUD of target areas in the treatment plans for breast cancer with a value ranging from-100 to-10(Gy,Mean±SD)
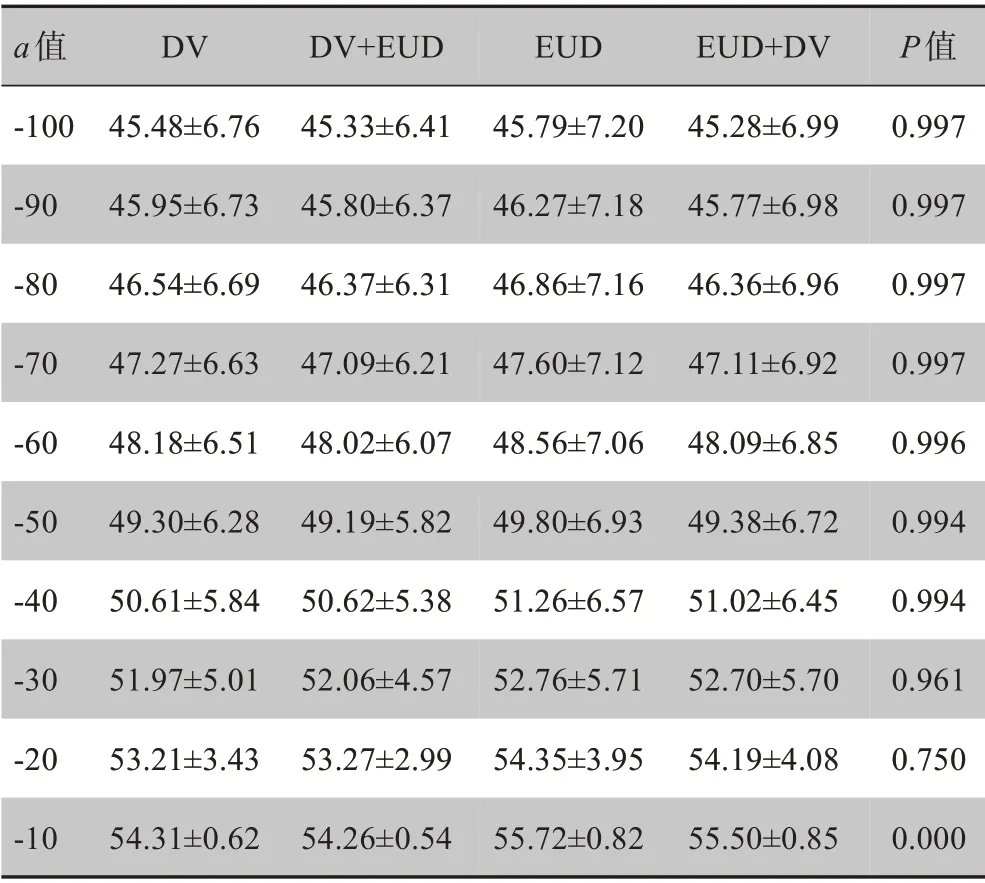
表3 a值取-100~-10时,乳腺癌计划中靶区EUD(Gy,±s)Tab.3 EUD of target areas in the treatment plans for breast cancer with a value ranging from-100 to-10(Gy,Mean±SD)
a值‐100‐90‐80‐70‐60‐50‐40‐30‐20‐10 DⅤ45.48±6.76 45.95±6.73 46.54±6.69 47.27±6.63 48.18±6.51 49.30±6.28 50.61±5.84 51.97±5.01 53.21±3.43 54.31±0.62 DⅤ+EUD 45.33±6.41 45.80±6.37 46.37±6.31 47.09±6.21 48.02±6.07 49.19±5.82 50.62±5.38 52.06±4.57 53.27±2.99 54.26±0.54 EUD 45.79±7.20 46.27±7.18 46.86±7.16 47.60±7.12 48.56±7.06 49.80±6.93 51.26±6.57 52.76±5.71 54.35±3.95 55.72±0.82 EUD+DⅤ45.28±6.99 45.77±6.98 46.36±6.96 47.11±6.92 48.09±6.85 49.38±6.72 51.02±6.45 52.70±5.70 54.19±4.08 55.50±0.85 P值0.997 0.997 0.997 0.997 0.996 0.994 0.994 0.961 0.750 0.000
表4 a值取-15~-5时,乳腺癌计划中靶区EUD(Gy,±s)Tab.4 EUD of target areas in the treatment plans for breast cancer with a value ranging from-15 to-5(Gy,Mean±SD)
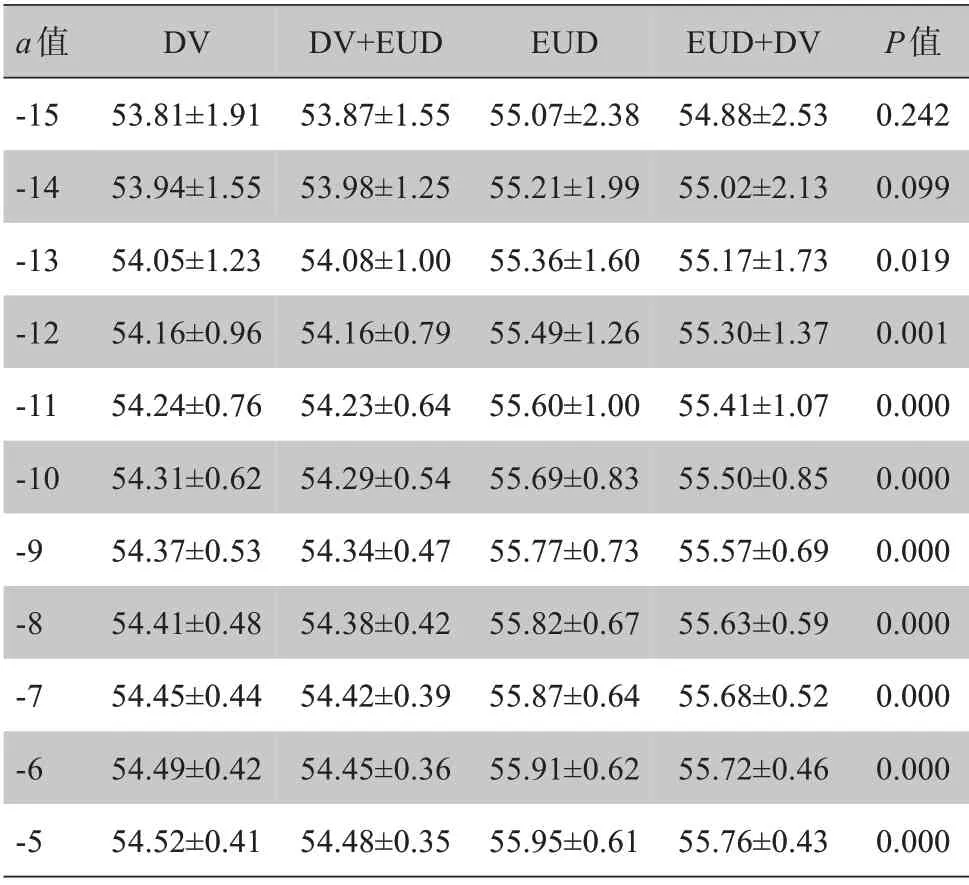
表4 a值取-15~-5时,乳腺癌计划中靶区EUD(Gy,±s)Tab.4 EUD of target areas in the treatment plans for breast cancer with a value ranging from-15 to-5(Gy,Mean±SD)
a值‐15‐14‐13‐12‐11‐10‐9‐8‐7‐6‐5 DⅤ53.81±1.91 53.94±1.55 54.05±1.23 54.16±0.96 54.24±0.76 54.31±0.62 54.37±0.53 54.41±0.48 54.45±0.44 54.49±0.42 54.52±0.41 DⅤ+EUD 53.87±1.55 53.98±1.25 54.08±1.00 54.16±0.79 54.23±0.64 54.29±0.54 54.34±0.47 54.38±0.42 54.42±0.39 54.45±0.36 54.48±0.35 EUD 55.07±2.38 55.21±1.99 55.36±1.60 55.49±1.26 55.60±1.00 55.69±0.83 55.77±0.73 55.82±0.67 55.87±0.64 55.91±0.62 55.95±0.61 EUD+DⅤ54.88±2.53 55.02±2.13 55.17±1.73 55.30±1.37 55.41±1.07 55.50±0.85 55.57±0.69 55.63±0.59 55.68±0.52 55.72±0.46 55.76±0.43 P值0.242 0.099 0.019 0.001 0.000 0.000 0.000 0.000 0.000 0.000 0.000
图2为其中一例乳腺癌病例通过4 种优方法所得的横断面剂量分布截图。4 种优化方法的靶区适形度都较好,且相互间差异不明显;而EUD 组的剂量梯度相比其他3 组较大,剂量线较为紧密,患侧肺组织的受照剂量更低。
2.2 危及器官的剂量学比较
图3为上述病例经4种方法优化后的DⅤH,图中显示EUD组PTⅤ的DⅤH曲线明显向右侧偏移,而双侧肺组织与心脏组织的DⅤH 曲线明显向左侧偏移。表5为乳腺癌病例4 种优化方法所得肺与心脏各项剂量指标的结果,从中可以发现,EUD 组中患侧肺的受照剂量相比于另外3组较低,且在患侧肺的各项剂量指标中,4 种优化方法在Ⅴ5、Ⅴ10、Ⅴ30、Dmean的差异具有统计学意义(P<0.05);而患侧肺Ⅴ20、健侧肺剂量体积指标及心脏Ⅴ10、Ⅴ30、Dmean的差异无统计学意义(P>0.05)。
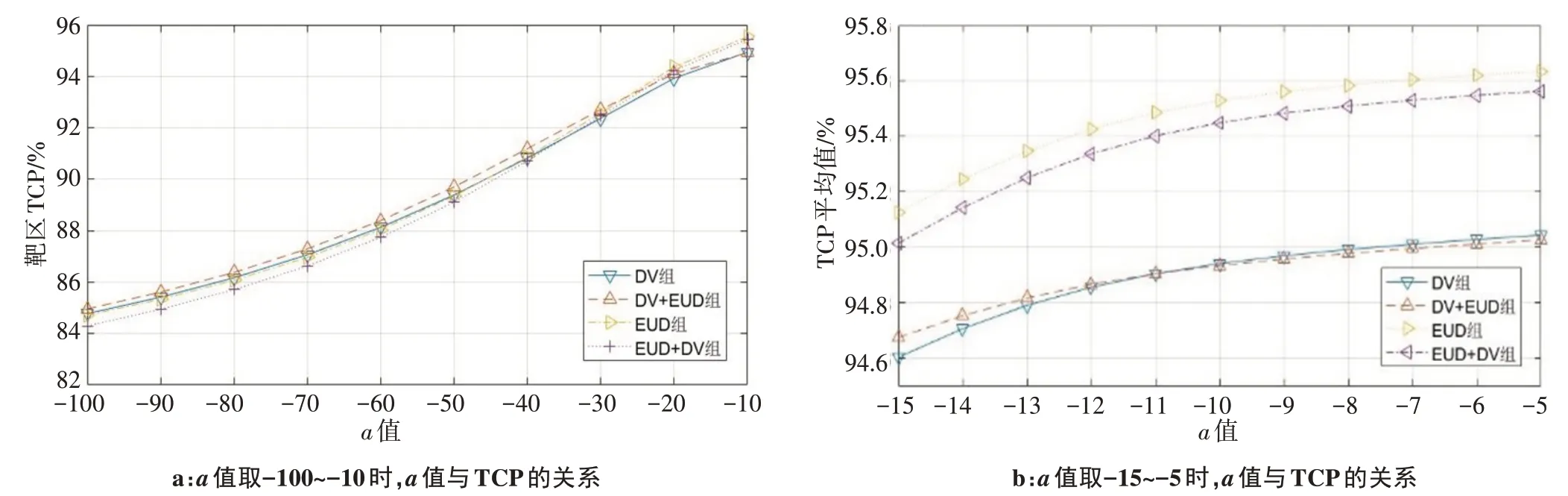
图1 TCP与a值关系图Fig.1 Relationship between a value and tumor control probability(TCP)
除此之外,本研究还对a取0.1~1.0 时患侧肺组织的EUD 进行了计算和统计,结果如表6所示。4 种优化方法所得的患侧肺EUD 比较具有统计学意义(P<0.05),其中EUD组在患侧肺组织的EUD平均值明显低于其余3 组。另外DⅤ组与DⅤ+EUD 组的患侧肺EUD 值结果较为接近,且高于靶区使用生物函数优化的两组;EUD 组的患侧肺EUD 值明显是最低的;患侧肺组织的EUD 值随a取值增加而呈逐渐增大的变化趋势。
表7为乳腺癌计划中对冠状动脉左前降支(Left Anterior Descending Artery,LAD)、脊髓以及右侧乳腺组织各项剂量指标进行统计学分析的结果,结果显示4种优化方法所得的右侧乳腺组织Dmax的比较具有统计学意义(P<0.05),而LAD、脊髓及右侧乳腺组织的其它剂量指标之间的差异均无统计学意义(P>0.05)。
3 讨论
经研究发现,在靶区方面,生物函数优化能够明显提高靶区的平均剂量,在DⅤH 上体现为曲线明显向右侧偏移。与此同时,靶区内的最大剂量也随之提高,进而使得靶区剂量均匀性在一定程度上有所降低,而4种优化方法之间的靶区适形度并没有明显差异。本研究认为,生物函数在对靶区剂量进行计算时会对靶区内的剂量冷点更为敏感,而对剂量热点不够敏感,因此在提高靶区内冷点剂量的同时不能更加有效控制热点的剂量,从而使得靶区平均剂量与最大剂量有明显提高,也在一定程度上降低了靶区剂量的均匀性。另外,在计划优化结果中还可以发现,靶区使用生物函数优化的机器跳数明显低于使用物理函数优化的两组,其中EUD 组比DⅤ组和DⅤ+EUD 组的机器跳数均降低了约16%,出束时间也明显减少,所以,生物函数优化明显提高了治疗实施效率,更适用于我国当前放疗的现状[21]。本研究还发现,当a取‐13~‐5 时,4 种优化方法之间的差异具有统计学意义;而当a取‐100~‐14 时,4 种优化方法之间的差异无统计学意义。针对乳腺癌靶区更合适的a值还需通过进一步的研究确定。
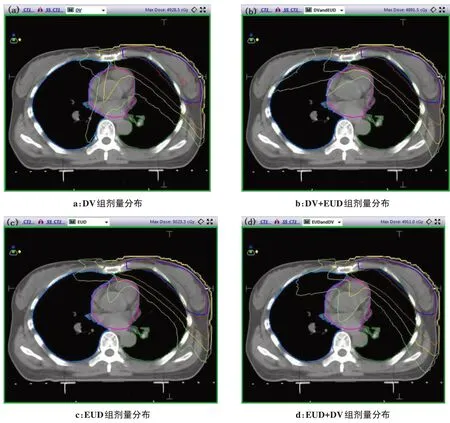
图2 横断面剂量分布图Fig.2 Cross section dose distributions

图3 4组计划的DVHFig.3 Dose-volume histogram of 4 groups of plans optimized by different methods
在危及器官方面,使用生物函数优化明显降低了患侧肺组织的受照剂量,体现出了其在保护正常肺组织方面的绝对优势。而在降低右侧乳腺组织最大剂量方面,物理函数更有优势。除此之外,心脏、LAD 与脊髓的各项剂量指标与生物函数、物理函数优化之间的关系并不明显,经分析认为原因首先是剂量分布在一定程度上存在“剂量动态平衡”,当患侧肺组织的剂量被限制到一定程度时,部分剂量曲线会不同程度地向旁边的心脏或健侧肺组织偏移;其次,脊髓距离靶区较远,受到的照射剂量大多数由
散射造成,所以4种优化方法之间的差异不足以体现生物函数与物理函数的优势;另外,不同病人LAD 的生长位置各不相同,从而导致了其与靶区之间的距离不同,4种优化方法中LAD剂量的差异受其与靶区之间相对位置的影响较大。
表5 肺与剂量指标(±s)Tab.5 Dosimetric index of the heart and lungs(Mean±SD)
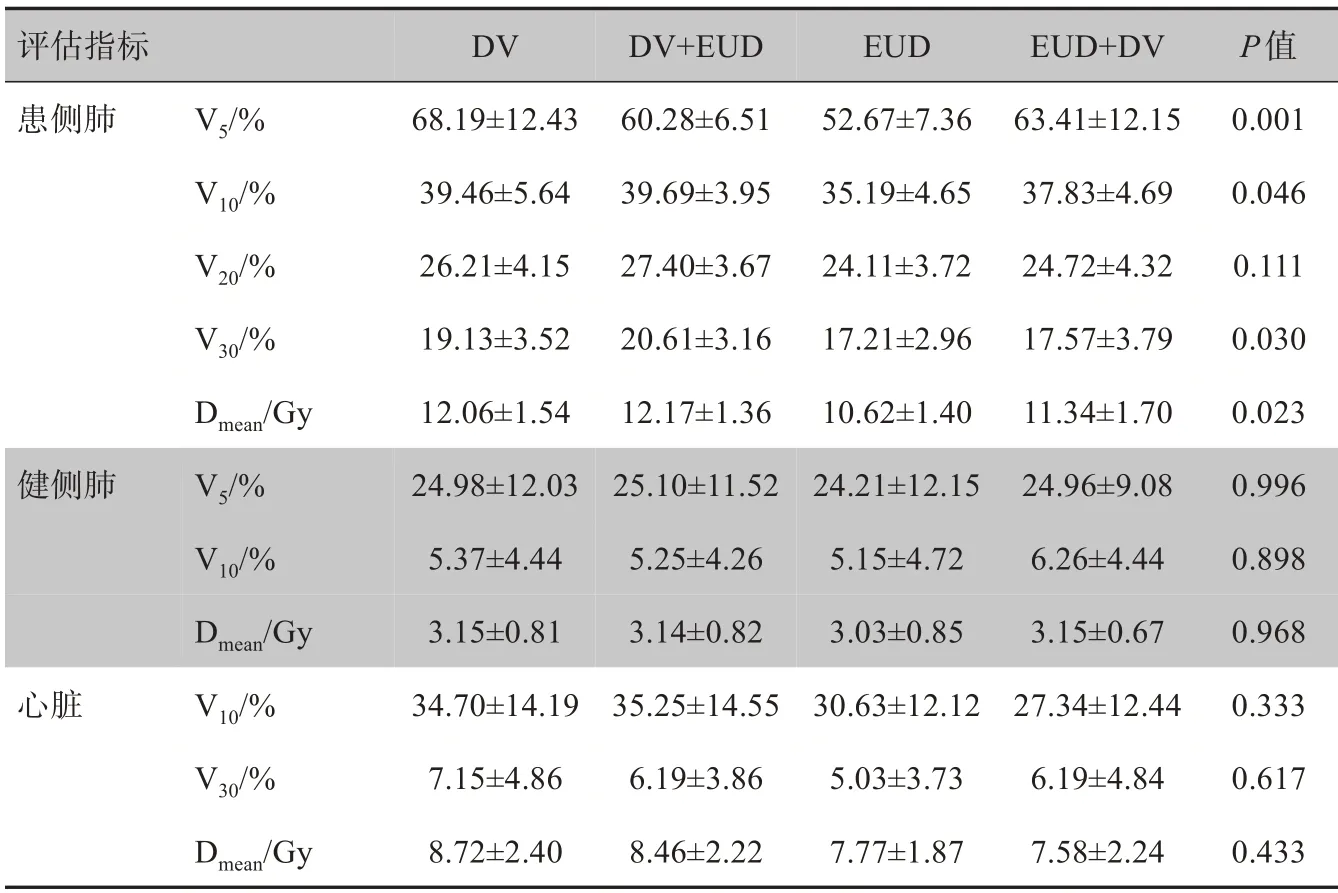
表5 肺与剂量指标(±s)Tab.5 Dosimetric index of the heart and lungs(Mean±SD)
评估指标患侧肺健侧肺Ⅴ5/%Ⅴ10/%Ⅴ20/%Ⅴ30/%Dmean/GyⅤ5/%Ⅴ10/%Dmean/GyⅤ10/%Ⅴ30/%Dmean/Gy心脏DⅤ68.19±12.43 39.46±5.64 26.21±4.15 19.13±3.52 12.06±1.54 24.98±12.03 5.37±4.44 3.15±0.81 34.70±14.19 7.15±4.86 8.72±2.40 DⅤ+EUD 60.28±6.51 39.69±3.95 27.40±3.67 20.61±3.16 12.17±1.36 25.10±11.52 5.25±4.26 3.14±0.82 35.25±14.55 6.19±3.86 8.46±2.22 EUD 52.67±7.36 35.19±4.65 24.11±3.72 17.21±2.96 10.62±1.40 24.21±12.15 5.15±4.72 3.03±0.85 30.63±12.12 5.03±3.73 7.77±1.87 EUD+DⅤ63.41±12.15 37.83±4.69 24.72±4.32 17.57±3.79 11.34±1.70 24.96±9.08 6.26±4.44 3.15±0.67 27.34±12.44 6.19±4.84 7.58±2.24 P值0.001 0.046 0.111 0.030 0.023 0.996 0.898 0.968 0.333 0.617 0.433
表6 患侧肺的EUD(Gy,±s)Tab.6 EUD of the ipsilateral lung(Gy,Mean±SD)
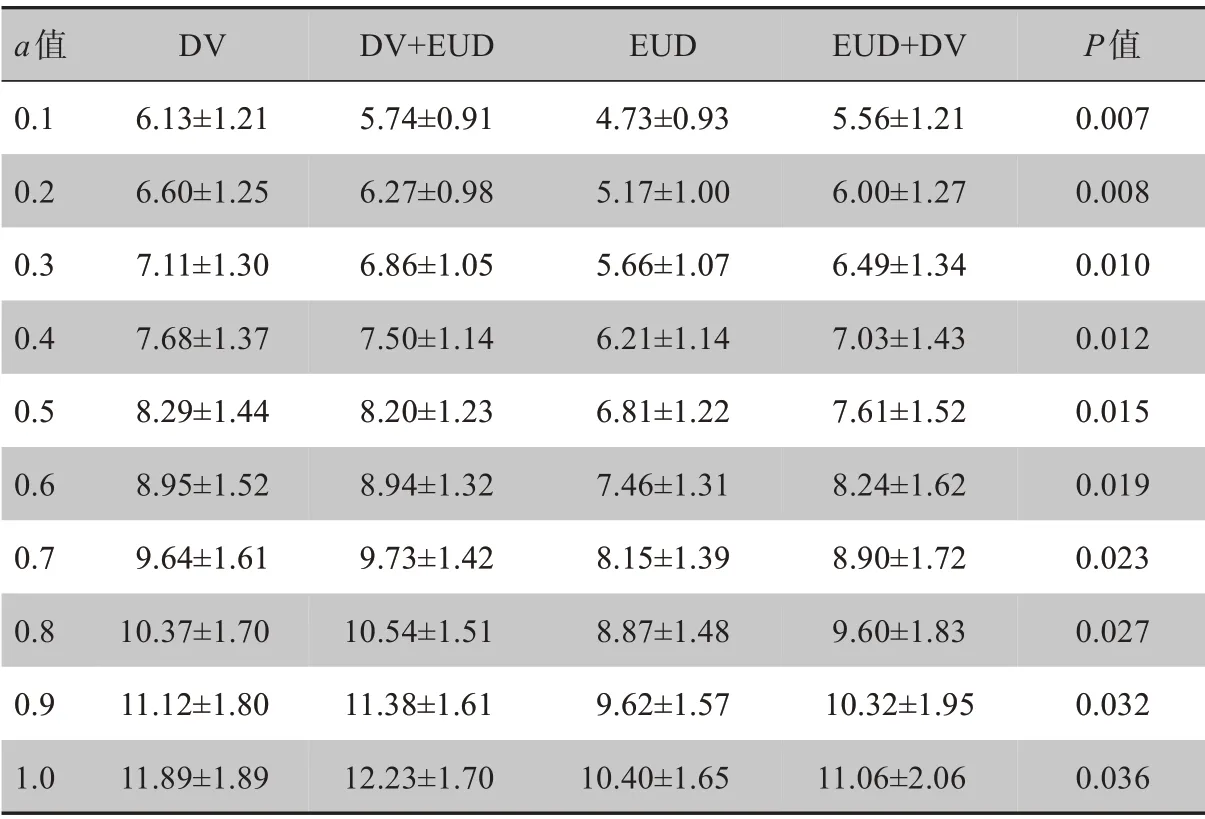
表6 患侧肺的EUD(Gy,±s)Tab.6 EUD of the ipsilateral lung(Gy,Mean±SD)
a值0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 DⅤ6.13±1.21 6.60±1.25 7.11±1.30 7.68±1.37 8.29±1.44 8.95±1.52 9.64±1.61 10.37±1.70 11.12±1.80 11.89±1.89 DⅤ+EUD 5.74±0.91 6.27±0.98 6.86±1.05 7.50±1.14 8.20±1.23 8.94±1.32 9.73±1.42 10.54±1.51 11.38±1.61 12.23±1.70 EUD 4.73±0.93 5.17±1.00 5.66±1.07 6.21±1.14 6.81±1.22 7.46±1.31 8.15±1.39 8.87±1.48 9.62±1.57 10.40±1.65 EUD+DⅤ5.56±1.21 6.00±1.27 6.49±1.34 7.03±1.43 7.61±1.52 8.24±1.62 8.90±1.72 9.60±1.83 10.32±1.95 11.06±2.06 P值0.007 0.008 0.010 0.012 0.015 0.019 0.023 0.027 0.032 0.036
表7 LAD、脊髓及右侧乳腺组织剂量指标分析结果(±s)Tab.7 Dosimetric parameters of LAD,spinal cord and right-sided breast(Mean±SD)
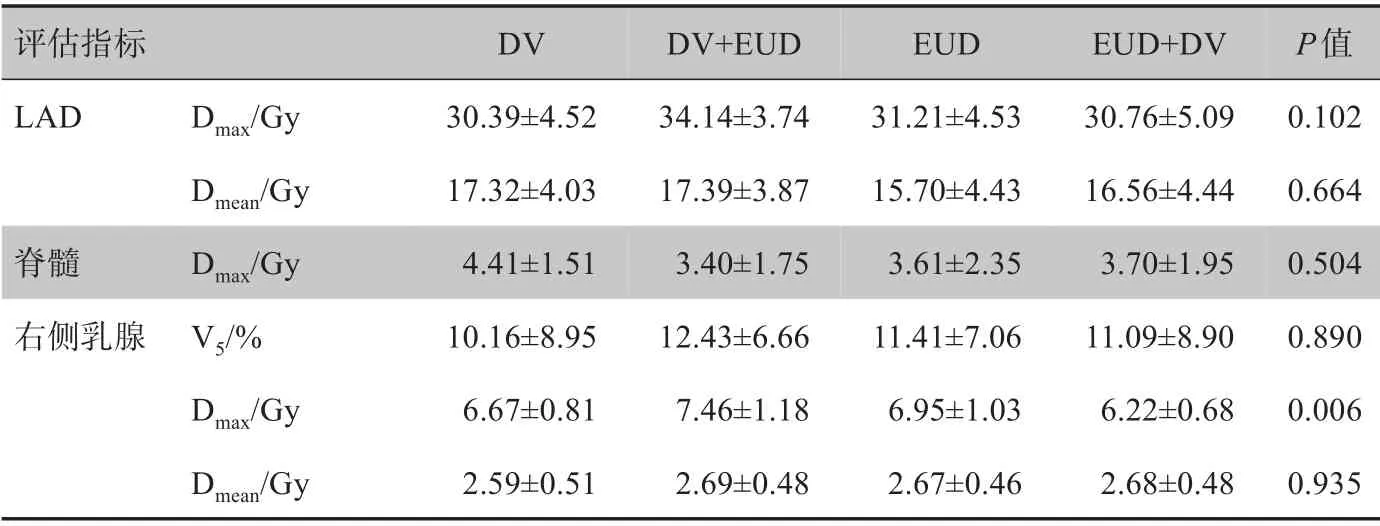
表7 LAD、脊髓及右侧乳腺组织剂量指标分析结果(±s)Tab.7 Dosimetric parameters of LAD,spinal cord and right-sided breast(Mean±SD)
评估指标LAD脊髓右侧乳腺Dmax/Gy Dmean/Gy Dmax/GyⅤ5/%Dmax/Gy Dmean/Gy DⅤ30.39±4.52 17.32±4.03 4.41±1.51 10.16±8.95 6.67±0.81 2.59±0.51 DⅤ+EUD 34.14±3.74 17.39±3.87 3.40±1.75 12.43±6.66 7.46±1.18 2.69±0.48 EUD 31.21±4.53 15.70±4.43 3.61±2.35 11.41±7.06 6.95±1.03 2.67±0.46 EUD+DⅤ30.76±5.09 16.56±4.44 3.70±1.95 11.09±8.90 6.22±0.68 2.68±0.48 P值0.102 0.664 0.504 0.890 0.006 0.935
总之,生物函数优化在提高乳腺癌计划的靶区剂量以及降低患侧肺组织剂量方面体现出了非常明显的优势,能够在确保靶区适形度的前提下提高靶区的剂量,同时还可以尽可能地减少患侧肺组织的受照剂量,对乳腺癌放疗提高TCP、降低NTCP 起到积极的作用。本研究认为在乳腺癌中可使用EUD 组的方法进行放疗计划的优化,尤其是当前大分割放疗模式逐渐盛行的时代,生物优化在未来放疗中能够发挥的作用不可忽视[22]。然而本研究仍存在一些不足之处,当前放疗即将进入“精确放疗”的时代,研究中所使用的相关生物学参数均由早期大量临床经验获得,因而较为陈旧,下一步还要通过大量临床工作来获取更新的组织生物学参数,以便挖掘生物函数在放疗计划中的潜能。

