液泡膜Na+/H+逆向转运蛋白研究进展
马红萍 包爱科
摘要 土壤盐渍化是造成全世界农作物减产的主要非生物胁迫因素之一,盐渍化土壤中过多的Na+是使植物生长受到抑制的主要阳离子。植物细胞中的液泡膜Na+/H+逆向转运蛋白(NHX)是应对盐胁迫的一种重要离子转运蛋白,盐胁迫下NHX可以调控植物体内的离子稳态平衡及细胞内的pH,对提高植物耐盐性具有非常重要的作用。简要概述了近年来液泡膜Na+/H+逆向转运蛋白的亚细胞定位与结构特点、主要生理功能及其与植物耐盐性关系等方面的研究进展,以期为相关研究提供参考。
关键词 液泡膜Na+/H+逆向转运蛋白;离子稳态;亚细胞定位;结构特点;生理功能;耐盐性
中图分类号 Q943 文献标识码 A
文章编号 0517-6611(2020)14-0004-05
doi:10.3969/j.issn.0517-6611.2020.14.002
Abstract Soil salinization is one of the main abiotic stress factors that cause crop yield reduction in the world.Excessive Na+ in salinized soil is the main cation that inhibits plant growth.The vacuolar membrane Na+/H+ antiporter (NHX) in plant cells is an important ion transporter in response to salt stress.Under salt stress,NHX can regulate the homeostasis balance of ions in plants and the pH in cells,which plays a very important role in improving plant salt tolerance.This paper briefly summarized the research about the subcellular localization and structural characteristics,main physiological functions and relationship with plant salt tolerance of the vacuolar membrane Na+/H+ antiporter in recent years,which may provide a reference for related research.
Key words Vacuolar membrane Na+/H+ antiporter;Ionic homeostasis;Subcellular localization;Structural characteristics;Physiological functions;Salt resistance
目前,全球盐碱化土地面积约3.97亿hm2,约占土地总面积的3.1%[1],土壤盐碱化逐步增加可能会导致未来25年内约30%的耕地流失[2]。大多数作物不能在盐渍化土壤中正常生长,其主要原因是高浓度的Na+进入植物细胞会对植物产生毒害作用,使植物的生长发育受到严重抑制[3]。此外,土壤盐碱化导致全球各种农作物大面积减产,给农业生产造成巨大损失[4]。植物细胞适应高盐环境的重要手段是维持胞质内较低的 Na+水平,在漫长的适应过程中,很多植物进化出了一系列策略来实现上述目标,主要有Na+的分泌、Na+的外排以及Na+的区域化[5]。研究发现,某些盐生植物可以通过自身特有的结构(如盐腺、盐囊泡等)将过多的Na+分泌出体外,避免过量Na+对植物重要代谢器官造成毒害,从而保证植物正常的生长发育[6]。Na+的外排和Na+的区域化主要依赖于植物细胞中与离子转运相关的蛋白(如质膜Na+/H+逆向转运蛋白、液泡膜Na+/H+逆向转运蛋白等)发挥功能,进而通过降低胞质中过多的Na+,使植物能够更好地适应盐渍生境[7-8]。目前,液泡膜Na+/H+逆向转运蛋白家族成员的离子区域化功能尚存有争议,因此还需进一步深入研究。笔者将从该类蛋白的亚细胞定位、蛋白结构特点、主要生理功能及其与植物耐盐性的关系等方面对液泡膜
Na+/H+逆向转运蛋白(NHX)近年来的主要研究结果进行简要概述和展望。
1 液泡膜Na+/H+逆向转运蛋白的亚细胞定位
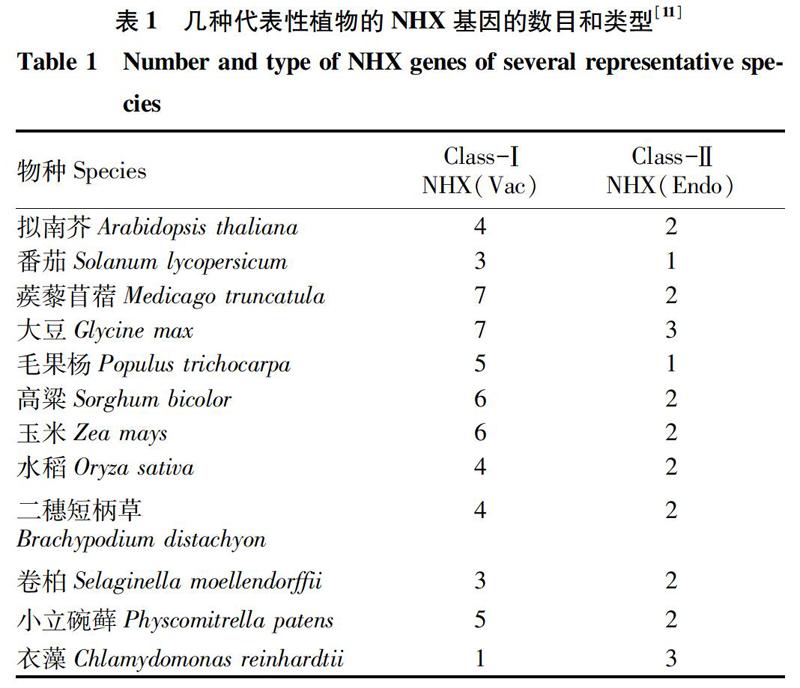
液泡膜NHX属于阳离子逆向转运蛋白CAP1家族中的NHE/NHX 亚家族成员[9]。通过亚细胞定位发现植物 NHX 蛋白都定位于细胞内部(intra-cellular,IC),进一步通过系统进化树分析,可以将植物NHX划分为Class-Ⅰ NHX和Class-Ⅱ NHX。Class-I NHX定位于液泡膜上, Class-Ⅱ NHX则定位于内囊体膜上,在动物、真菌内膜上也存在相应的同源蛋白[10]。在大多数植物中,Class-Ⅰ NHX的成员数目要多于Class-Ⅱ NHX,如大豆 (Glycine max)、蒺藜苜蓿(Medicago truncatula)、玉米(Zea mays) 等(表1)。另有研究發现,NHX蛋白家族成员的同源性不仅在不同植物种类间具有差异,而且在同一植物中也有一定差异。例如在拟南芥NHX家族中,定位于液泡膜上(Class-Ⅰ NHX)的4个成员AtNHX1~AtNHX4间的同源性为56%~87%;定位于内囊体膜上(Class-Ⅱ NHX)的2个成员AtNHX5和AtNHX6间的同源性为79%,而两组成员间的同源性仅为20%~25%[12]。
2 液泡膜Na+/H+逆向转运蛋白的拓扑结构
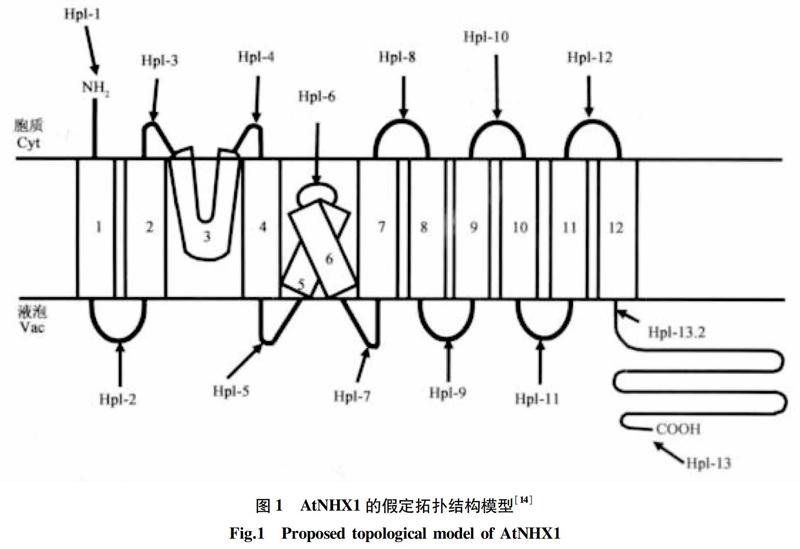
1999年,Apse等[13]首次从拟南芥中克隆得到液泡膜Na+/H+逆向转运蛋白基因 AtNHX1 ,随后,Yamaguchi等[14]利用酵母中的异源表达,对 AtNHX1 的拓扑结构进行分析,结果发现(图1),AtNHX1的总体结构不同于其他NHX,它包括 12 个疏水跨膜结构域 (transmembrane domains,TM)和1个较长的亲水性C-末端“尾巴”,其中第3个疏水区含有一个高度保守的氨氯吡嗪脒结合位点(amiloride binding-site),第5、6个疏水区虽与膜相连,但并没有跨过液泡膜。目前,已从多种植物中分离得到了编码该蛋白的同源基因,如水稻 (Oryza sativa L.) OsNHX1[15]、小麦(Triticum aestivum)TNHX1[16]、玉米ZmNHX1[17]、霸王(Zygophyllum xanthoxylum) ZxNHX [18]等,氨基酸结构分析显示,这些同源基因编码的蛋白均具有与AtNHX1类似的分子结构。另外,相比于其他植物NHX,AtNHX1的N-末端朝向胞质且高度保守,但其整个C-末端几乎都位于液泡腔中[14],且与钙调素蛋白AtCaM15结合会降低Na+/H+转运活性[19],表明亲水性C-末端的差异会对蛋白质活性起到一定的调节作用,进而推测C-末端的不同可能是NHX蛋白成员间功能分异的主要原因。
3 液泡膜Na+/H+逆向转运蛋白的生理功能
3.1 介导Na+的区域化
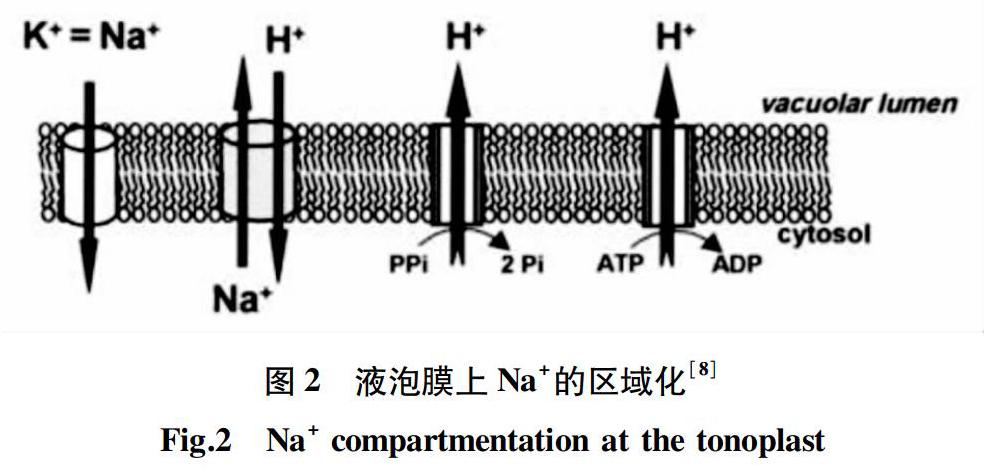
当植物处于盐碱环境时,由于土壤溶液和植物细胞内部之间的Na+浓度存在梯度差,因此植物不可避免地会积累Na+[20]。成熟细胞的液泡体积一般占细胞整体积的80%~90%,因此液泡中可以富集很多的阳离子,将Na+区域化进液泡是减少胞质中过多Na+ 的有效方法之一[21]。研究发现,Na+的区域化主要依靠液泡膜Na+/H+转运蛋白(NHX)发挥功能[8],它以液泡膜H+~ATPase和H+-PPase产生的跨膜H+电化学势梯度为主要驱动力将细胞质中过多的Na+区域化进液泡中(图2)。Apse等[22]研究发现拟南芥nhx1突变体植株中Na+/H+转运活性较野生型降低。Ma等[23]研究发现,对多浆旱生植物霸王进行干旱胁迫处理,处理组霸王叶中Na+浓度比对照组高出64%,同时Na+对叶渗透势贡献由正常培养条件下的8%提高至干旱胁迫下的13%,K+对叶渗透势的贡献则无变化,表明干旱胁迫下,多浆旱生植物霸王可以吸收大量的Na+,并能将Na+有效转运至霸王的叶中。同时,霸王 ZxNHX 的表达与盐或干旱处理下其叶中的Na+积累量呈显著正相关关系[18],说明该蛋白可能将霸王叶肉细胞质中过多的Na+区域化至叶的液泡中,从而有助于降低细胞水势、提高细胞的吸水能力,使植株能够抵御严酷生境。随后,Yuan等[24]进一步研究发现,50 mmol/L NaCl处理下, ZxNHX- RNAi干扰株系叶中Na+浓度显著低于野生型,可见ZxNHX是霸王在盐胁迫下维持其积盐特征的关键因子。另有研究发现,盐胁迫下,过表达 AtNHX1的 拟南芥[14]和番茄[25]转基因株系中Na+/H+转运活性及Na+含量较野生型明显提高。之后在小麦[26]、棉花 (Gossypium hirsutum)[27]以及高羊茅(Festuca arundinacea )[28]的 AtNHX 过表达株系中也发现了类似现象,表明NHX可以介导胞质中过多的Na+区域化至液泡中以减轻Na+毒害,并提高细胞的吸水能力,从而使植物能够在盐胁迫下维持正常的生长发育。
3.2 参与K+的稳态平衡
钾不仅是植物必需的营养元素,还在平衡细胞内电荷的过程中发挥了重要作用[29]。大部分细胞内的K+存在于液泡中,间接驱动细胞的膨胀[30]。此外,胞质K+还是植物细胞内许多生化和酶促反应必不可少的催化剂。最新研究发现NHX可能参与介导液泡中K+的积累,并且是细胞主动吸收K+所必需的离子转运蛋白[31]。Bassil等[32]研究发现,相比于野生型拟南芥 nhx1nhx2双 突株系的生物量显著降低;通过测定离子转运活性,发现 nhx1nhx2双 突株系液泡膜K+/H+转运活性降低,其液泡中K+含量仅为野生型植株的1/3,并且与野生型相比,双突株系气孔关闭延迟。进一步对拟南芥 nhx1nhx2双突 株系的气孔特征进行研究,发现气孔的闭合依赖于保卫细胞通过液泡膜上NHX1和NHX2积累K+来实现[33]。随后同时对拟南芥 NHX1、NHX2、NHX3、NHX4进行敲除[34],发现相比于野生型,nhx1nhx2nhx3nhx4幼 苗液泡中K+含量显著降低;并且在高浓度K+处理下, nhx1nhx2nhx3nhx4 幼苗的根发生了明显的偏斜和卷曲反应,而在同等浓度的Na+处理下并未观察到此类表型,表明 NHX 对K+高度敏感。另外在苜蓿中过表达小麦 TaNHX2 ,发现盐胁迫下转基因株系K+/H+转运活性显著提高,其叶中K+含量也显著高于野生型[35]。将葡萄 VvNHX1在马 铃薯中进行超表达,转基因株系叶中K+含量也显著增加,Na+含量减少[36]。另外,在烟草中超表达花生 (Arachis hypogaea)AhNHX1 基因,發现盐处理后转基因烟草具有更高的K+/H+转运活性,其根、茎、叶中也积累了较多的K+;从生长表型上来看,盐处理下转基因植株的根长、干鲜重、生长速率都优于野生型,表明超表达 AhNHX1可 以促使转基因烟草增强K+/H+转运活性,积累更多的K+,增强烟草对盐胁迫的耐受性[37]。以上结果均表明NHX可以通过调控植物细胞中K+的稳态平衡,提高植物抵御盐胁迫的能力。
3.3 调节细胞内pH 适宜的 pH环境是植物细胞中参与各种代谢途径的酶功能正常行使的必要条件。细胞内酸碱平衡主要通过质子泵和产生H+或OH-的代谢过程来调节[38]。NHX参与调控细胞内 pH的典型例子就是三色牵牛花 (Ipomoea tricolor) 的花色变化[39]。当三色牵牛花发育处于花蕾期时,花瓣细胞液泡内pH为6.6,此时花色为紫色,而当三色牵牛花发育至盛花期时,相应的液泡中pH升高至7.7,此时花色呈现为蓝色,而该时期液泡膜H+-ATPase、H+-PPase以及NHX的活性显著提高。另有研究发现,拟南芥 nhx1nhx2 双突株系根的成熟细胞和子叶下胚轴细胞中液泡pH相比野生型分别降低了0.50和0.35[31],同样拟南芥 nhx5nhx6双 突株系液泡pH相比于野生型也显著降低[40-41],这可能是因为NHX的缺失导致双突株系中跨液泡膜Na+/H+交换比率减少,从而使其液泡中的H+含量较野生型高,使液泡酸化。可见NHX活性的改变对植物细胞内pH的变化有着非常重要的影响。
3.4 调节细胞中的囊泡运输
植物细胞内的囊泡运输是维持生命活动的关键枢纽[11]。研究发现AtNHX1参与细胞中的囊泡运输[42],位于液泡膜上的AtNHX1介导Na+进入囊泡,后者会移动并融合到液泡中。驻留在液泡腔中的AtNHX1的亲水性C-末端尾巴与钙调素蛋白AtCaM15相互作用,调节阳离子的选择性,而盐胁迫通常会引起液泡碱化,此时AtCaM15与AtNHX1的结合能力降低, Na+/H+转运活性增强,AtNHX1可以将更多的Na+区域化进液泡中,提高植物的耐盐性[19]。对拟南芥 nhx1 转录组数据进行分析,发现编码与囊泡运输有关蛋白(如动力蛋白、网格蛋白包被蛋白、网格蛋白结合蛋白等)的编码基因出现差异表达[43]。另外,对拟南芥 nhx5nhx6双突 株系分析发现,突变体中高尔基体到液泡前体或液泡膜的囊泡运输无法顺利完成[44]。上述结果均表明NHX在囊泡运输过程中发挥了重要作用。
4 液泡膜Na+/H+逆向转运蛋白编码基因在提高植物耐盐性中的应用
植物的耐盐性是一个复杂的性状,涉及对细胞渗透压和离子胁迫及其随之产生的次级胁迫(如氧化胁迫)在整株水平上协调的响应[45]。目前已经从60多种植物中鉴定并克隆出 NHX基 因[46],其中大多数已被证明与植物的耐盐性相关[47]。大量研究表明, 超表达 AtNHX可以提高植物的耐盐性。例如, AtNHX5的 过表达能够提高盐处理下转基因拟南芥的干鲜重及地上部Na+、K+含量,转基因植株的耐盐能力明显提高[48]。同样将 AtNHX5在 水稻中进行超表达,转基因水稻的干鲜重、叶绿素含量、叶片相对含水量及脯氨酸含量均高于野生型植株,进一步研究发现转基因水稻种子可以在含有250 mmol/L甘露醇的1/2MS培养基上发芽,并且转基因水稻幼苗的生长明显优于野生型[49],这与在大豆中超表达 AtNHX5的 研究结果相类似[50]。表明 AtNHX5的过 表达增强了转基因植株的耐受性。另外Leidi等[51]在番茄中超表达 AtNHX1 ,发现转基因番茄的根长、地上部干重及含水量都显著高于野生型。Sahoo等[52]在绿豆中超表达 AtNHX1, 转基因绿豆在高盐胁迫下(200 mmol/L NaCl处理)生长良好,其株高、干鲜重、光合速率等指标都高于野生型植株,表明转基因株系耐盐性提高。另有研究发现,超表达其他植物 的NHX 基因同样会改善多数植物的耐盐性[53],刘琳等[54]在拟南芥中超表达水稻 OsNHX1, 结果发现转基因拟南芥的根长、叶片相对含水量均高于野生型植株,表明转基因植株的胁迫耐受性得到改善。之后将小麦 TaNHX2在 茄子中进行超表达,发现T2代转基因植株在200 mmol/L NaCl处理下可以维持正常生长,而野生型植株表现出叶片萎黄,生长受到抑制甚至死亡;并且相较于野生型,转基因植株的光合速率、总叶绿素含量及叶片相对含水量都有所提高,表明超表达 TaNHX2可 以明显改善茄子的耐盐能力[55]。同样在马铃薯中超表达葡萄 VvNHX1 [35],转基因马铃薯在盐处理后其体内可溶性糖含量及抗氧化酶活性都显著提高,表明转基因植株可以克服盐胁迫导致的氧化应激反应,从而使其耐盐性增强。综上所述, NHX的 超表达可以显著提高转基因植株的耐盐性。另外对 nhx突变 体研究发现,渗透胁迫下拟南芥 nhx1nhx2 双突株系长势明显弱于野生型植株[31],拟南 芥nhx5nhx6 双突株系对盐分也极度敏感[56],表明 NHX 的缺失降低了植物的耐受性。
众所周知,NHX区域化Na+的动力主要是由液泡膜H+-ATPase和H+-PPase产生的跨膜质子驱动力提供的,据此推测可以通过超表达为区域化Na+提供动力的液泡膜质子泵基因,这样可以供给NHX更强的驱动力来将细胞质中更多的 Na+区域化到液泡内腔中,进一步增强植物的耐盐性[57]。随后这一理论推测已经得到充分验证,例如在拟南芥[58-59]、紫花苜蓿[60]中超表达H+-PPase基因 (VP) ,均能够提高转基因植株的耐盐能力,表明H+-PPase 基因的超表达能够增强植物的耐盐性。据此进一步推测, NHX和VP的 共表达可以使Na+区域化进液泡的能力成倍增加,从更大程度上减轻Na+对细胞质的毒害,进而赋予植物更强的耐鹽碱能力[61]。目前,这一假说已在水稻[62]、番茄[63]、烟草[64]等植物中通过共表达 NHX和VP得 到了验证。Bhaskaran等[63]研究发现在200 mmol/L NaCl处理下,共表达狼尾草 (Pennisetum glaucum)PgNHX1和拟南芥AVP1的转基 因番茄生长良好,而野生型植株的生长受到严重抑制,叶片萎蔫甚至在21 d内死亡。同样Liu等[65]在苜蓿中超表达盐地碱蓬 ScNHX1和ScVP ,发现转基因植株在盐处理下仍然可以维持自身的正常生长,而野生型植株则表现出叶片发黄褪绿,植株整体萎蔫甚至死亡。随后Bao等[61]将旱生植物霸王 ZxNHX和ZxVP1-1在紫花苜蓿(Medicago sativa L.)中进行共表达,200 mmol/L NaCl处理下T0代转基因苜蓿生长良好,野生型植株萎蔫甚至死亡;并且相较于野生型植株,T0代转基因紫花苜蓿植株的生物量、光合效率、叶片相对含水量更高,叶和根中也积累了更多的阳离子 (如Na+、K+和Ca2+)。2017年,珠拉太[66]分别用50 mmol/L NaCl和不同浓度的山梨醇进行渗透胁迫处理,发现共表达 ZxNHX和ZxVP1-1的 T1代转基因紫花苜蓿可以有效积累Na+和K+以增加自身的渗透调节能力,从而维持植株的正常生长。张婧[67]用200 mmol/L NaCl对T2代转基因紫花苜蓿进行胁迫处理,发现T2代转基因苜蓿的株高、生物量及根系活力均高于野生型。表明 ZxNHX和ZxVP1-1的聚合转化可以获得稳定遗传,同时也充分表明ZxNHX和ZxVP1-1 的共表达可以通过增加质子驱动力促使更多的Na+区域化进液泡中,改善转基因株系的渗透调节能力,进而提高转基因紫花苜蓿的耐盐性。综上所述,共表达 NHX和VP基因 可以显著增强植物对高盐环境的耐受能力。
5 结论与展望
土壤盐渍化严重制约着全球农业发展。液泡膜Na+/H+逆向转运蛋白(NHX)在植物抵御盐胁迫过程中发挥着重要作用,因此该蛋白在植物抗逆性改良中将具有重要的应用前景。然而目前仅对NHX1和NHX2功能的研究较为广泛,而其他NHX成员在植物中的抗逆调控机理仍不清楚,深入揭示它们的功能,不仅可以挖掘更多优异的抗逆基因资源,而且可以为培育抗逆性较强的作物品种奠定更加充分的理论依据。此外,基于目前的研究现状,NHX的离子区域化功能在不同植物和不同家族成员间存在差异:早期的研究发现该类蛋白主要介导Na+的区域化,但最近的大量研究又表明NHX可能通過介导液泡K+的区域化来维持胞内K+的稳态平衡。因此,深入解析造成这些差异的分子机制将是未来的重要研究方向,这将有助于全面理解NHX蛋白家族在不同类型植物生长发育和环境适应中的作用。
参考文献
[1] TAVAKKOLI E,RENGASAMY P,MCDONALD G K.High concentrations of Na+ and Cl- ions in soil solution have simultaneous detrimental effects on growth of faba bean under salinity stress[J].Journal of experimental botany,2010,61(15):4449-4459.
[2] WANG W X,VINOCUR B,ALTMAN A.Plant responses to drought,salinity and extreme temperatures:Towards genetic engineering for stress tolerance[J].planta,2003,218:1-14.
[3] SHABALA S,CUIN T A.Potassium transport and plant salt tolerance[J]. Physiologia plantarum,2008,133(4):651-669.
[4] TESTER M,DAVENPORT R.Na+ tolerance and Na+ transport inhigher plants[J]. Annals of botany,2003,91(5):503-527.
[5] ZHANG J L,SHI H Z.Physiological and molecular mechanisms of plant salt tolerance[J]. Photosynthesis research,2013,115:1-22.
[6] 张乐,郭欢,包爱科.盐生植物的独特泌盐结构——盐囊泡[J]. 植物生理学报,2019,55(3): 232-240.
[7] SHI H Z,ISHITANI M,KIM C,et al.The Arabidopsis thaliana salt tolerance gene SOS1 encodes a putative Na+/H+ antiporter[J].Proceedings of the national academy of sciences of the United States of America,2000,97:6896-6901.
[8] BLUMWALD E.Sodium transport and salt tolerance in plants[J].Current opinion in cell biology,2000,12(4):431-434.
[9] BRETT C L,DONOWITZ M,RAO R.Evolutionary origins of eukaryotic sodium/proton exchangers[J].American journal of physiology,2005,288(2):223-239.
[10] PARDO J M,CUBERO B,LEIDI E O,et al.Alkali cation exchangers:Roles in cellular homeostasis and stress tolerance[J].Journal of experimental botany,2006,57(5):1181-1199.
[11] BASSIL E,COKU A,BLUMWALD E.Cellular ion homeostasis:Emerging roles of intracellular NHX Na+/H+ antiporters in plant growth and development[J].Journal of experimental botany,2012,63(16):5727-5740.
[12] YOKOI S,QUINTERO F J,CUBERO B,et al.Differential expression and function of Arabidopsis thaliana NHX Na+/H+ antiporters in the salt stress response[J].The plant journal,2002,30(5):529-539.
[13] APSE M P,AHARON G S,SNEDDEN W A,et al.Salt tolerance conferred by overexpression of a vacuolar Na+/H+ antiport in Arabidopsis [J].Science,1999,285(5431):1256-1258.
[14] YAMAGUCHI T,APSE M P,SHI H Z,et al.Topological analysis of a plant vacuolar Na+/H+ antiporter reveals a luminal C terminus that regulates antiporter cation selectivity[J].Proceedings of the national academy of science USA,2003,100:12510-12515.
[15] FUKUDA A,NAKAMURA A,TANAKA Y.Molecular cloning and expression of the Na+/H+ exchanger gene in Oryza sativa [J].Biochimica et biophysica acta,1999,1446:149-155.
[16] BRINI F,GAXIOLA R A,BERKOWITZ G A,et al.Cloning and characterization of a wheat vacuolar cation/proton antiporter and pyrophosphatase proton pump[J].Plant physiology and biochemistry,2005,43:347-354.
[17] CHRISTIAN Z,NOLL A,KARL S,et al.Molecular characterization of Na+/H+ antiporters( ZmNHX) of maize (Zea mays L.) and their expression under salt stress[J].Journal of plant physiology,2005,162:55-66.
[18] WU G Q,XI J J,WANG Q L,et al.The ZxNHX gene encoding tonoplast Na+/H+ antiporter from the xerophyte Zygophyllum xanthoxylum plays important roles in response to salt and drought[J].Journal of plant physiology,2011,168:758-767.
[19] YAMAGUCHI T,GILAD S,AHARON J B,et al.Vacuolar Na+/H+ antiporter cation selectivity isregulated by calmodulin from within the vacuolein a Ca2+-and pH-dependent manner[J].Proceedings of the national academy of science USA,2005,102:16107-16112.
[20] DONG W,LI D L,QIU N W,et al.The functions of plant cation/proton antiporters[J].Biologia plantarum,2018,62(3):421-427.
[21] FRANS J M,MAATHUIS I A,PATISHTAN J.Regulation of Na+ fluxes in plants[J].Plant science,2014,5:467.
[22] APSE M P,SOTTOSANTO J B,BLUMWALD E.Vacuolar cation/H+ exchange,ion homeostasis,and leaf development are altered in a T-DNA insertional mutant of AtNHX1,the Arabidopsis vacuolar Na+/H+ antiporter[J].The plant journal,2003,36:229-239.
[23] MA Q,YUE L J,ZHANG J L,et al.Sodium chloride improves photosynthesis and water status in the succulent xerophyte Zygophyllum xanthoxylum [J].Tree physiology,2012,32:4-13.
[24] YUAN H J,MA Q,WU G Q,et al.ZxNHX controls Na+ and K+ homeostasis at the whole-plant levelin Zygophyllum xanthoxylum through feedback regulation of the expressionof genes involved in their transport[J]. Annals of botany,2015,115:495-507.
[25] ZHANG H X,BLUMWALD E.Transgenic salt-tolerant tomato plantsaccumulate salt in foliage but not in fruit[J].Nature biotechnology,2001,19:765-768.
[26] XUE Z Y,ZHI D Y,XUE G P,et al.Enhanced salt tolerance of transgenic wheat ( Tritivum aestivum L.) expressing a vacuolar Na+/H+ antiporter gene with improved grain yields in saline soils in the field and a reduced level of leaf Na+[J].Plant science.2004,167(4):849-859.
[27] HE C X,YAN J Q,SHEN G X,et al.Expression of an Arabidopsis vacuolar sodium/proton antiporter gene in cotton improves photosynthetic performance under salt conditions and increases fiber yield in the field[J].Plant and cell physiology,2005,46(11):1848-1854.
[28] ZHAO J S,ZHI D Y,XUE Z Y,et al.Enhanced salt tolerance of transgenic progeny of tall fescue ( Festuca arundinacea) expressing a vacuolar Na+/H+ antiporter gene from Arabidopsis [J].Journal of plant physiology,2007,164(10):1377-1383.
[29] KHAN I U,ALI A,YUN D J. Arabidopsis NHX transporters: Sodium and potassium antiport mythology and sequestration during ionic stress[J].Journal of plant biology,2018,61:292-300.
[30] ADEM G D,ROY S J,ZHOU M,et al.Evaluating contribution of ionic,osmotic and oxidative stress components towards salinity tolerance in barley[J].BMC Plant Biology,2014,14:113-125.
[31] BARRAGN V,LEIDI E O,ANDRS Z,et al.Ion exchangers NHX1 and NHX2 mediate active potassium uptake into vacuoles to regulate cell turgor and stomatal function in Arabidopsis [J].Plant cell,2012,24:1127-1142.
[32] BASSIL E,TAJIMA H,LIANG Y C,et al.The Arabidopsis Na+/H+ antiporters NHX1 and NHX2 control vacuolar pH and K+ homeostasis to regulate growth,flower development,and reproduction[J].Plant cell,2011,23:3482-3497.
[33] ANDRS Z,PREZ-HORMAECHE J,LEIDI E O,et al.Control of vacuolar dynamics and regulation of stomatal aperture by tonoplast potassium uptake[J].Proceedings of the national academy of sciences of the United States of America,2014,111:1806-1814.
[34] MCCUBBIN T,BASSIL E,ZHANG S Q,et al.Vacuolar Na+/H+ NHX-type antiporters are required for cellular K+ homeostasis,microtubule organization and directional root growth[J].Plants,2014,3:409-426.
[35] ZHANG Y M,ZHANG H M,LIU Z H,et al.The wheat NHX antiporter gene TaNHX2 confers salt tolerance in transgenic alfalfa by increasing the retention capacity of intracellular potassium[J].Plant molecular biology,2015,87:317-327.
[36] CHARFEDDINE S,CHARFEDDINE M,HANANA M,et al.Ectopic expression of a grape vine vacuolar NHX antiporter enhances transgenic potato plant tolerance to salinity[J].Journal of plant biochemistry and biotechnology,2019,28(1):50-62.
[37] ZHANG W W,MWNG J J,XING J Y,et al.The K+/H+ antiporter AhNHX1 improved tobacco tolerance to NaCl stress by enhancing K+ retention[J].Journal of plant biology,2017,60:259-267.
[38] PAROUTIS P,TOURET N,GRINSTEIN S.The pH of the secretory pathway:Measurement,determinants,and regulation[J].Physiology,2004,19:207-215.
[39] YOSHIDA K,KAWACHI M,MORI M,et al.The involvement of tonoplast proton pumps and Na+(K+)/H+ exchangers in the change of petal color during flower opening of morning glory, Ipomoea tricolor cv.Heavenly Blue[J].Plant cell physiology,2005,46(3):407-415.
[40] REGUERA M,BASSIL E,TAJIMA H,et al.pH regulation by NHX-type antiporters is required for receptor-mediated protein trafficking to the vacuole in Arabidopsis [J].Plant cell,2015,27:1200-1217.
[41] WANG L G,WU X X,LIU Y F,et al. AtNHX5 and AtNHX6 control cellular K+ and pH homeostasis in Arabidopsis: Three conserved acidic residues are essential for K+ transport[J].PLoS One,2015,10(12):1-19.
[42] HAMAJI K,NAGIRA M,YOSHIDA K,et al.Dynamic aspects of ion accumulation by vesicle traffic under salt stress in Arabidopsis [J].Plant and cell physiology,2009,50(12):2023-2033.
[43] SOTTOSANTO J B,GELLI A,BLUMWALD E.DNA array analyses of Arabidopsis thaliana lacking a vacuolar Na+/H+ antiporter:Impact of AtNHX1 on gene expression[J].Plant journal,2010,40(5):752-771.
[44] WU X X,EBINE K,UEDA T,et al.AtNHX5 and AtNHX6 are required for the subcellular localization of the SNARE complex that mediates the trafficking of seed storage proteins in Arabidopsis [J].PLoS One,2016,11(3):1-25.
[45] ZHU J K.Plant salt tolerance[J].Trends in plant science,2001,6:66-71.
[46] BASSIL E,BLUMWALD E.The ins and outs of intracellular ion homeostasis: NHX-type cation/H+ transporters[J].Current opinion in plant biology,2014,22:1-6.
[47] JIA Q,ZHENG C,SUN S,et al.The role of plant cation/proton antiporter gene family in salt tolerance[J].Biologia plantarum,2018,62(4):617-629.
[48] 安靜,侯蕾,孔祥强,等. AtNHX5 基因过量表达对拟南芥耐盐性的影响[J].西北植物学报,2012,32(6):1106-1111.
[49] LI M R,LIN X J,LI H Q,et al.Overexpression of AtNHX5 improves tolerance to both salt and water stress in rice ( Oryza sativa L.)[J].Plant cell tissue and organ culture,2011,107:283-293.
[50] WU X X,LI J,WU X D,et al.Ectopic expression of Arabidopsis thaliana Na+(K+)/H+ antiporter gene, AtNHX5, enhances soybean salt tolerance[J].Genetics and molecular research,2016,15(2):1-12.
[51] LEIDI E O,BARRAGN V,RUBIO L,et al.The AtNHX1 exchanger mediates potassium compartmentation in vacuoles of transgenic tomato[J].The plant journal,2010,61:495-506.
[52] SAHOO D P,KUMAR S,MISHRA S,et al.Enhanced salinity tolerance in transgenic mungbean overexpressing Arabidopsis antiporter (NHX1) gene[J].Molecular breeding,2016,36:144.
[53] ROY S J,NEGRO S,TESTER M.Salt resistant crop plants[J].Current opinion in plant biology,2014,26:115-124.
[54] 刘琳,曾幼玲,张富春.水稻NHX1基因启动子和C末端的调控功能研究[J].西北植物学报,2012,32(7):1295-1303.
[55] YARRA R,KIRTI P B.Expressing class Ⅰ wheat NHX ( TaNHX2) gene in eggplant( Solanum melongena L.) improves plant performance under salinecondition[J].Functional and integrative genomics,2019,19:541-554.
[56] BASSIL E,BLUMWALD E.The ins and outs of intracellular ion homeostasis: NHX-type cation/H+ transporters[J].Current opinion in plant biology,2014,22:1-6.
[57]包爱科,张金林,郭正刚,等.液泡膜H+-PPase与植物耐盐性[J].植物生理学通讯,2006,42(4):777-783.
[58] GAXIOLA R A,LI J,UNDURRAGA S,et al.Drought and salt-tolerant plants result from overexpression of the AVP1 H+-pump[J].Proceedings of the national academy of sciences of the United States of America,2001,98:11444-11449.
[59] GUO S L,YIN H B,ZHANG X,et al.Molecular cloning and characterization of a vacuolar H+-pyrophosphatase gene, SsVP, from the halo-phyte Suaeda salsa and its overexpression increases salt and drought tolerance of Arabidopsis [J].Plant molecular biology,2006,60:41-50.
[60] BAO A K,WANG S M,WU G Q,et al.Overexpression of the Arabidopsis H+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa ( Medicago sativa L.)[J].Plant science,2009,176:232-240.
[61] BAO A K,WANG Y W,XI J J,et al.Co-expression of xerophyte Zygophyllum xanthoxylum ZxNHX and ZxVP1-1 enhances salt and drought tolerancein transgenic Lotus corniculatus by increasing cations accumulation[J].Functional plant biology,2015,41:203-214.
[62] LIU S P,ZHENG L Q,XUE Y H,et al.Overexpression of OsVP1 and OsNHX1 increases tolerance to drought and salinity in rice[J].Journal of plant biology,2010,53:444-452.
[63] BHASKARAN S,SAVITHRAMMA D L.Co-expression of Pennisetumglaucum vacuolar Na+/H+ antiporter and Arabidopsis H+-pyrophosphataseenhances salt tolerance in transgenic tomato[J].Journal of experimental botany,2011,62:5561-5570.
[64] GOUIAA S,KHOUDI H,LEIDI E O,et al.Expression of wheat Na+/H+ antiporter TNHXS1 and H+-pyrophosphatase TVP1 genes in tobacco from a bicistronic transcriptional unit improves salt tolerance[J].Plant molecular biology,2012,79:137-155.
[65] LIU L,FANX D,WANG F W,et al.Co-expression of ScNHX1 and ScVP in transgenic hybridsImproves salt and saline-alkali tolerance in alfalfa( Medicago sativa L.)[J].Journal of plant growth regulation,2013,32:1-8.
[66] 珠拉太.NaCl在共表達 ZxNHX和ZxVP1-1转 基因紫花苜蓿 (Medicago sativa L.)响应渗透胁迫中的生理功能分析[D].兰州:兰州大学,2017.
[67] 张婧.共表 达ZxNHX-ZxVP1-1转 基因紫花苜蓿抗旱耐盐性评价及ZxNHX和PcCLCg对紫花苜蓿的聚合转化[D].兰州:兰州大学,2019.

