壳寡糖对杂交黄颡鱼“黄优1号”(黄颡鱼♀×瓦氏黄颡鱼♂)生长性能与免疫机能的影响
李明波 沈 凡 崔庆奎 齐飘飘 王银海 张海龙 丁运敏 沈志刚
(1.潜江市水产技术推广中心,潜江 433100;2.潜江市玉欣水产养殖专业合作社,潜江 433100;3.北京昕大洋科技发展有限公司,北京 100081;4.华中农业大学水产学院,农业部淡水生物繁育重点实验室,池塘健康养殖湖北省工程实验室,武汉 430070;5.武汉市武湖农业发展有限公司,武汉 430331)
几丁质存在于节肢动物外骨骼及一些真菌细胞壁中,高温下经强碱溶液处理,实现脱乙酰化,形成壳聚糖(chitosan)[1]。壳聚糖经酸解、物理降解或酶解,形成壳寡糖(chitosan oligosaccharide,COS),聚合度≤20,平均分子量<3900 Da[2]。壳寡糖又称几丁寡糖、低聚壳聚糖、寡聚β-(1→4)-2-氨基-2-脱氧-D-葡萄糖,是目前所知唯一的正电荷碱性氨基葡萄糖低聚糖[3],因分子量低,水溶性高,其生物功能活性高于壳聚糖[4]。壳寡糖能被动物小肠吸收,不仅具益生元功能,还能经血液循环到达肝、肾、脾、心、胸腺等靶器官,起组织保护作用,亦能结合巨噬细胞表面受体,起调节免疫、抗炎、抗氧化作用[4,5]。同时,壳寡糖安全性极高,小鼠口服半致死浓度高于蔗糖(>16 g/kg),因此适用于养殖动物保健,甚至可能成为抗生素替代品之一[6]。食品安全问题现已成为养殖产业发展的重要制约因素,2010年起农业部陆续发布1435、1759、2292号公告,禁止水产用兽药34种(计规格共57个),其中抗菌、消毒类24种(计规格共41个)。近几年来,政府、学者、消费者对水产“无抗时代”的呼声越来越高,期待越来越强烈,抗菌兽药减用方案及替代品亟待探索。
黄颡鱼(Yellow catfish,Tachysurus fulvidraco)属鲇形目(Siluriformes)、鲿科(Bagridae)、拟鲿属(Tachysurus),是近年来增长速度最快、受关注度最高的淡水名特养殖鱼类之一,产量从2014年的33.4×107kg增至2018年的51.0×107kg,在我国淡水养殖鱼类产量中排第9位[7]。黄颡鱼生长存在明显雌、雄二态特征,在相同饲养条件下,雄性规格可高达雌性的3倍[8]。针对黄颡鱼养殖过程中出现的规格差异,我国科研人员已培育出两个黄颡鱼新品种: 以“超雄黄颡鱼”(YY)为父本生产“全雄黄颡鱼”;以普通黄颡鱼为母本、瓦氏黄颡鱼(Tachysurus vachelli)为父本生产的杂交黄颡鱼“黄优1号”(黄颡鱼♀×瓦氏黄颡鱼♂,下同)。目前,杂交黄颡鱼“黄优1号”(2019年全国水产原种和良种审定委员会审定新品种)因规格相对整齐、生长快、存活率高、耐低氧、耐运输等优势[9—11],养殖需求逐年增长。
近年来,黄颡鱼上市规格要求提高,养殖成本上涨,价格存在较大波动,因此,养殖者对该品种生长速度、饲料利用、存活与抗病力的要求日趋严苛。
已有研究显示,壳聚糖对黄颡鱼生长、免疫具一定积极作用[12,13]。但壳寡糖对黄颡鱼或杂交黄颡鱼的影响及剂量效应,尚未见研究报道。此外,现有壳寡糖对鱼类免疫机能影响的研究,主要关注非特异性免疫,其对鱼类特异性免疫,尤其特异性细胞免疫的影响鲜有报道。本研究旨在评价饲料添加不同剂量壳寡糖对“黄优1号”生长性能、饲料利用、特异及非特异性免疫的影响,以期为黄颡鱼功能性添加剂的选择提供理论基础,并为鱼类免疫学研究提供数据资料。
1 材料与方法
1.1 试验动物
试验鱼初始群体为1200尾9月龄秋繁杂交黄颡鱼,获自湖北黄优源渔业发展有限公司(湖北省武汉市江夏区)。从中随机筛选体重33—40 g的健康个体420尾作为试验鱼。不人为干预雌、雄初始规格差异,但保证各组性比差异不显著,且与试验鱼来源群体(捕自池塘的1200尾)性比接近。将试验鱼饲养于12个容积为1 m3的网箱,每网箱35尾,将12个网箱随机分配至4个试验组,每组3个重复。试验鱼从池塘转入网箱暂养7d(暂养期间投基础饲料)。试验开始前测定所有个体体长和体重,并根据雄性具生殖突的特性记录性比,初始体重(36.46±0.59) g,体长(12.99±0.10) cm,性比1.04(♂: ♀),体重变异系数(21.21±3.02)%,各组间差异不显著。
1.2 试验饲料
试验饲料由北京科澳协力饲料有限公司订制加工。基础饲料配方见表1。壳寡糖(COS,含量为10%)通过喷涂工艺添加,水溶组分的喷涂设置于烘干后,油脂喷涂前。
1.3 试验分组
试验设4组,壳寡糖(10%)添加量分别为0 (C组,对照组)、400 mg/kg(T1组,有效剂量40 mg/kg)、800 mg/kg(T2组,有效剂量80 mg/kg)、1200 mg/kg(T3组,有效剂量120 mg/kg)。每组3个网箱,规格、密度同1.1所述。试验为期56d。
壳寡糖(纯度为10%)获自中国科学院大连化学物理研究所,脱乙酰度≥95%,聚合度2—8,分子量≤2000 Da,载体为麦芽糊精。
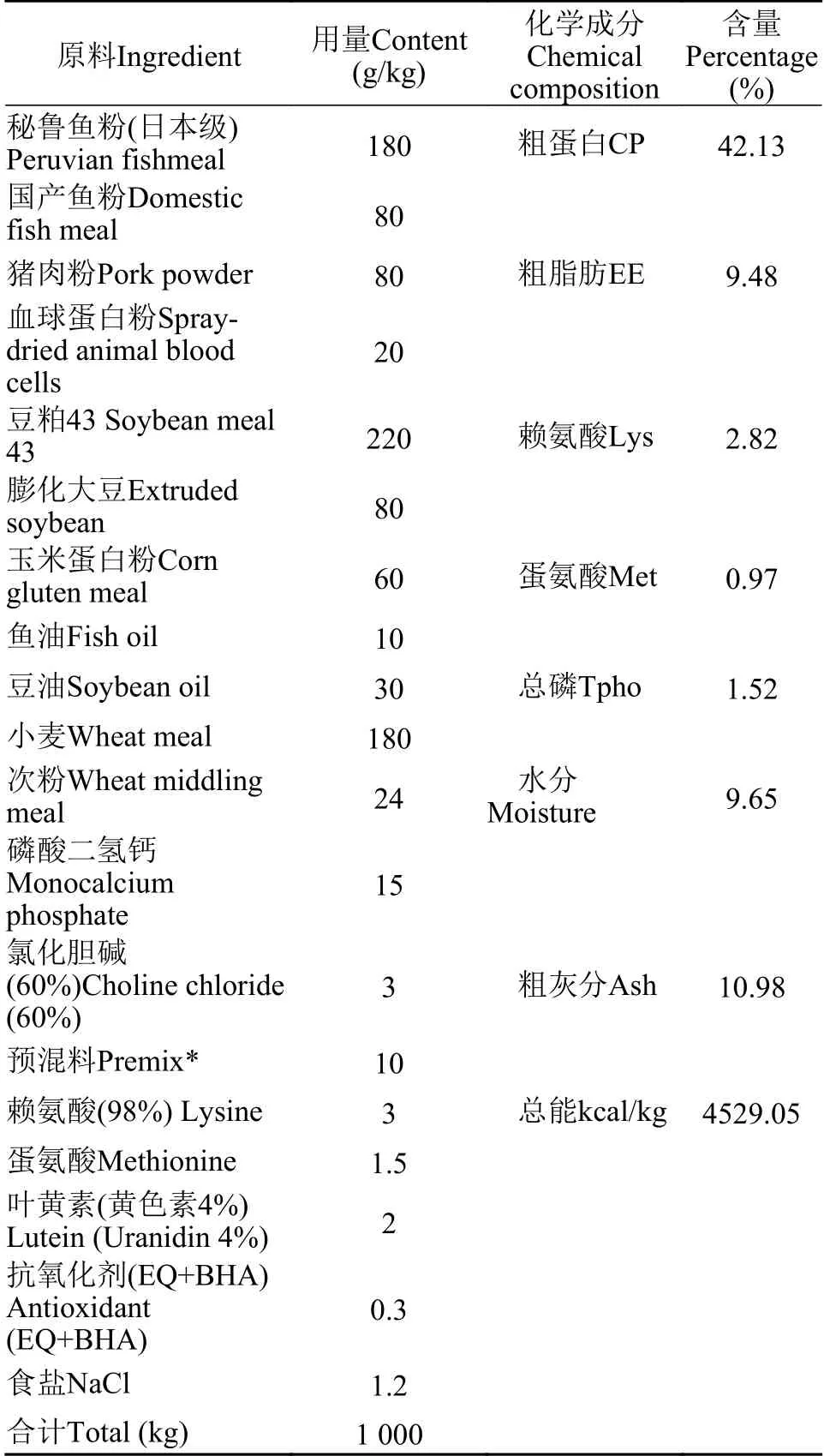
表 1 试验基础配方及营养成分(风干物质基础)Tab.1 Ingredients and chemical analysis of the basal diets (airdried basis)
1.4 饲养管理
试验于湖北黄优源渔业发展有限公司开展。网箱架设于黄颡鱼育成土池塘中,位于池塘自动投饵机的另一侧,网孔1 cm。池深2.2 m,池总面积13340 m2(20亩),叶轮式增氧机配置0.9 W/ m2(0.6 kW/亩)。NH3-N、H2S每7 天测1次,DO及水温每日监测,自然光照。期间水温26—32℃,NH3-N≤0.3 mg/L,NO≤0.05 mg/L,H2S<0.02 mg/L,pH 7.6—8.8,DO>3.8 mg/L。每日2次投喂,06:30及18:30,投饵机开启,吸引池中鱼群聚集于靠近投饵机侧后,开始对网箱投喂,以防试验料吸引池塘中黄颡鱼。每次投喂至表观饱食。称差重计每日采食量。
试验结束前5d,每平行取5尾(用于淋巴细胞转化率检测),用150 mg/L MS-222溶液麻醉,胸鳍下注射植物血凝素(PHA-P)(合肥博美生物科技有限公司第一分公司)。PHA-P用Jeager’s液溶解至2.4 μg/mL,剂量为8 μg/g鱼体重,注射后用红线捆背鳍硬棘标记,放回原网箱。3d后按原剂量第2次注射。
1.5 样品采集
在56d饲养结束后,禁食24h,MS-222溶液(100 mg/L)麻醉,测所有未标记试验鱼体长(BL)、体重(BW),判断性别,记终末尾数,并计算如下参数:
特定生长率(Specific growth rate,SGR,%/d)=100×(lnWt-lnW0)/t;
体重变异系数(Coefficient of variation,CV,%)=100×(SDW/Wt)
蛋白质效率(Protein efficiency rate,PER)=(∑Wt-∑W0)/WP
饵料系数(Feed conversion ratio,FCR)=Wf/(∑Wt-∑W0)
肥满度(Condition factor,CF,g/m3)=100×Wt/L3
存活率(Survival rate,SR,%)=100×Nt/N0
式中,W0为初始鱼体重(g),Wt为终末鱼体重(g),Wf为摄入饲料总量(g),∑Wt为终末鱼体总重(g),∑W0为初始鱼体总重(g),WP为摄入的饲料蛋白质总量(g),L为终末鱼体长(cm),t为试验天数(d);N0为初始尾数,Nt为终末尾数;SDw为平行内体重标准差。
注射PHA-P并标记5尾,于尾柄脊柱下动(静)脉取抗凝血(1 mL注射器,以肝素钠浸润),用于淋巴细胞转化率测定。
每平行随机取10尾(未标记鱼),于尾柄脊柱下动(静)脉取抗凝血(1 mL注射器,以肝素钠浸润)。0.2 mL全血用于白细胞吞噬活性测定,其他用于制血浆,测定生化指标。抗凝血于冰盒中沉降1h,4℃下1500 r/min离心40min,取上清得血浆,于-20℃冰箱暂存。
1.6 检测项目
淋巴细胞转化率参照文献[14]的方法,血涂片观察。推血制片,甲醇固定,瑞氏-吉姆萨混合染色,油镜下计数200个淋巴细胞。转化为母细胞的淋巴细胞呈阿米巴或圆形,胞相对疏松,胞浆较休止期丰富,直径增大,胞质蓝色。休止形淋巴细胞直径相对小,核致密,深蓝紫色,胞浆极少,核与细胞膜常相切。过度形特征间于母细胞形和休止形之间。
转化率(%)=100×(过度形+母细胞形)/淋巴细胞总量
白细胞吞噬活性白细胞吞噬活性用血涂片观察,取0.2 mL抗凝全血与金黄色葡萄球菌(南京进优生物技术有限公司)液0.1 mL混合,28℃水浴1h,推血制片,甲醇固定10min,晾干,瑞氏染色30s,吉姆萨染色10min,蒸馏水洗,晾干。
吞噬百分率(%)=100×(N个白细胞中参与吞噬的细胞数/N)
吞噬指数=N个白细胞中被吞噬的细菌数/N
溶菌酶活性溶菌酶活性,购买溶壁微球菌(南京建成生物工程有限公司),与待测血浆混合,570 nm处测吸光度A0,37℃水浴30min,测吸光度A。

补体含量补体C3(g/L)、C4(g/L)含量用酶联免疫试剂盒测定(上海晶抗生物工程有限公司)。
免疫球蛋白含量IgM(μg/L)含量用酶联免疫试剂盒测定(上海晶抗生物工程有限公司)。
1.7 数据统计
以平均值(Mean) ±标准差(SD)表示,不同组间终末数据进行Shapiro-wilk法正态性检验及Levene法方差同质性检验,方差齐(Sig>0.05),进行单因素方差分析(One-way ANOVA)及最小显著差异法(LSD)法多重比较。以不同性别初始体重变异系数为协变量,做协方差分析(Covariance analysis),若对终末数据存在显著影响,则求校正结果。将试验鱼分雌、雄统计生长性能,做双因素方差分析(Twoway ANOVA),以性别为一自变量,剂量为另一自变量,LSD法多重比较。统计软件SPSS 19.0,显著性水平设为α=0.05。
2 结果
2.1 生长性能
在试验结束时,壳寡糖有效剂量120 mg/kg组体重显著高于0和40 mg/kg组(P=0.003;P=0.042),0、40和80 mg/kg三组间差异不显著(P>0.05)。有效剂量120 mg/kg组特定生长率显著高于0组(P=0.003)、40 mg/kg组(P=0.048),0、40和80 mg/kg三组间差异不显著(P>0.05)。120 mg/kg组饲料系数显著低于0组(P=0.003),与40和80 mg/kg组差异不显著(P>0.05),0、40和80 mg/kg三组间差异不显著(P>0.05)。有效剂量120 mg/kg组蛋白质效率显著高于0组(P=0.006),0、40和80 mg/kg三组间差异不显著(P>0.05,表2)。存活率于各组间无显著差异(P=0.944,表2)。
双因素方差分析显示,壳寡糖剂量与性别两因素,对试验鱼特定生长率、终末体重均有显著影响(P<0.05),两因素间无交互作用(P>0.05,表3)。
壳寡糖有效剂量120和80 mg/kg两组雄性特定生长率显著高于0组雄性(P<0.001,P=0.015)。四组雌性生长性能无显著差异(P>0.05,表3)。

表 2 壳寡糖(10%)对杂交黄颡鱼生长性能的影响Tab.2 Effects of dietary chitosan oligosaccharide (10% purity) levels on growth performance of hybrid yellow catfish “Huangyou No.1”Tachysurus fulvidraco ♀× Tachysurus vachelli ♂
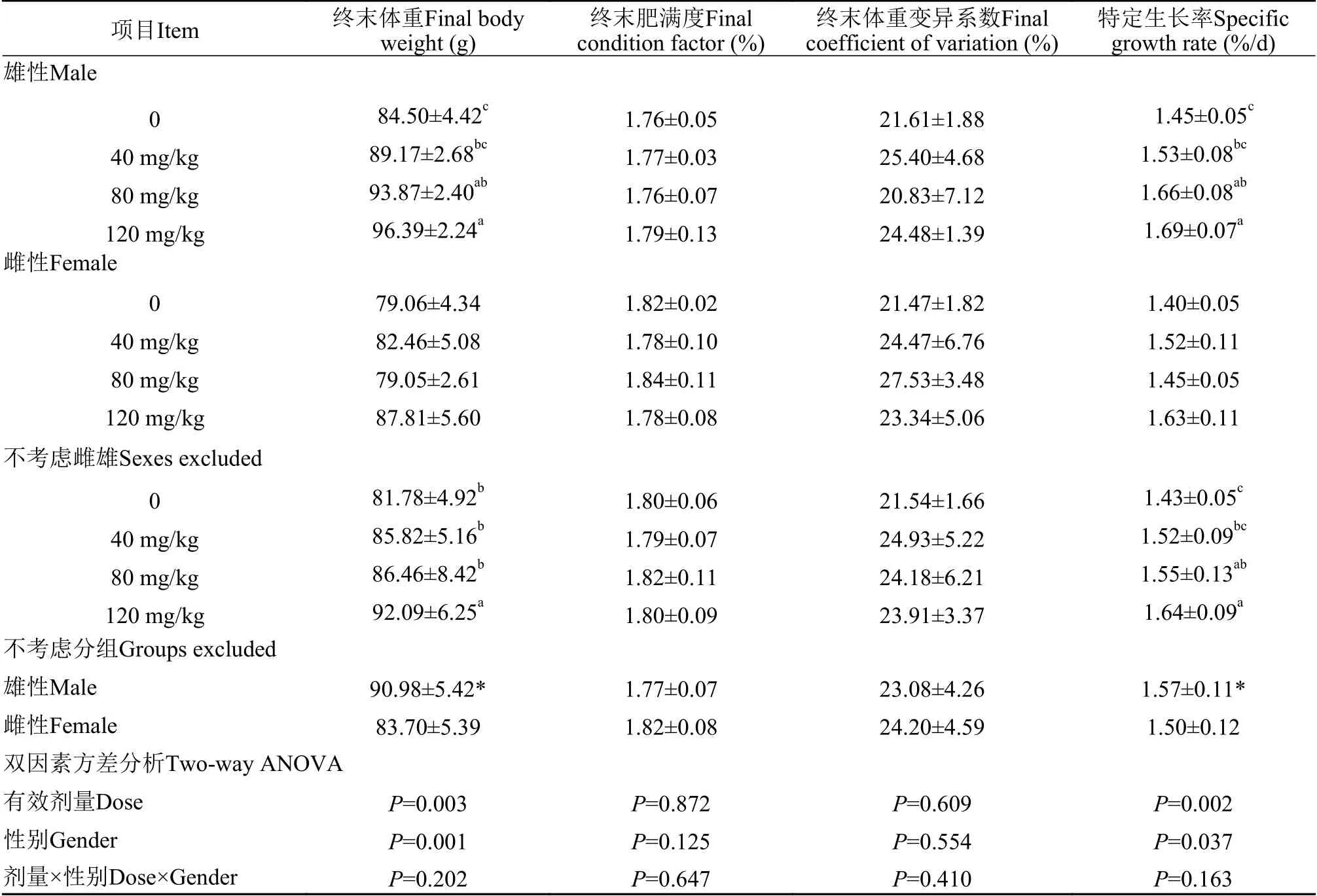
表 3 壳寡糖(10%)用量对不同性别杂交黄颡鱼生长性能的影响Tab.3 Effects of dietary chitosan oligosaccharide (10%) supplemental levels and gander on the final body weight,final condition factor,final coefficient of variation and specific growth rate of hybrid yellow catfish
协方差分析显示,雌性初始体重变异系数显著影响雌性(P=0.006)及完整群体特定生长率(P=0.030,表4)。
校正去除协变量(雌性初始体重变异系数)的影响后,雌性特定生长率受壳寡糖显著影响(P=0.011)。同时,完整群体特定生长率于不同剂量壳寡糖下的差异显著程度,比不校正时提升,0 组完整群体特定生长率显著低于有效剂量80 mg/kg组(P=0.003)和120 mg/kg组(P=0.002,表5)。
2.2 免疫机能
饲料添加壳寡糖(10%)对试验鱼白细胞计数无显著影响(P>0.05,图1)。
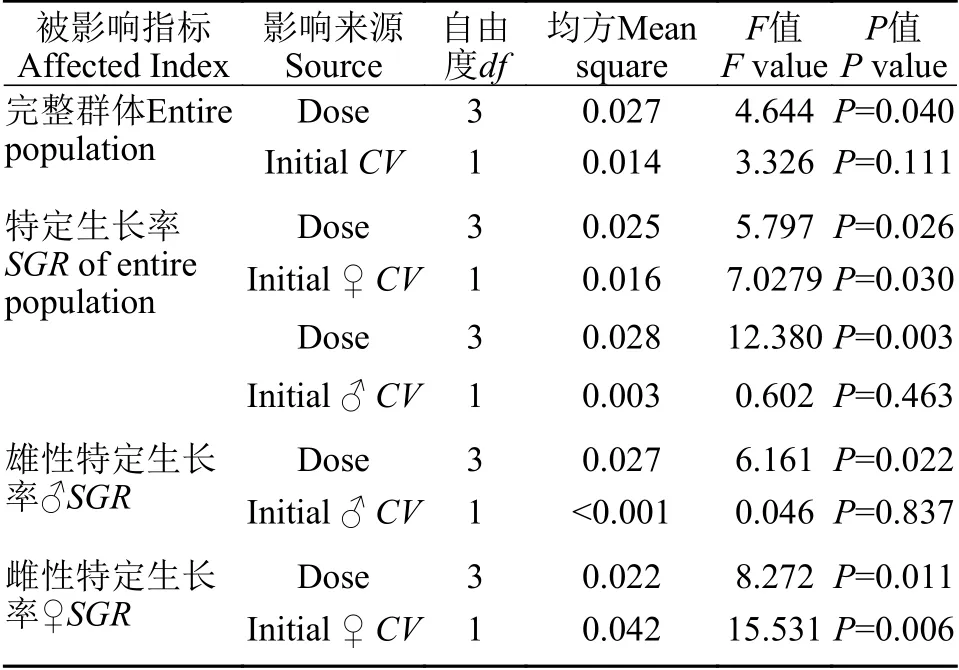
表 4 初始体重变异系数对杂交黄颡鱼特定生长率影响的协方差分析Tab.4 Covariance analysis of effects of initial intact CV,initial ♂CV,initial ♀CV on SGR of hybrid yellow catfish

表 5 校正协变量(雌性初始体重变异系数)后壳寡糖(10%)剂量对特定生长率的影响Tab.5 Effects of dietary chitosan oligosaccharide (10%)supplemental levels on SGR of hybrid yellow catfish with covariate(Initial ♀ CV) adjusted
细胞免疫壳寡糖(10%)显著影响白细胞吞噬指数(P=0.004),有效剂量40 mg/kg组显著高于0组(P=0.002),3个添加壳寡糖的组间差异不显著(P>0.05)。白细胞吞噬百分比于各组间无显著差异(P>0.05,图1)。
壳寡糖(10%)对试验鱼淋巴细胞转化率影响显著(P=0.001),有效剂量40 mg/kg组显著高于0组(P=0.009),有效剂量升至80 mg/kg,淋巴细胞转化率进一步显著提升(P=0.047),有效剂量120 mg/kg组与80 mg/kg组无显著差异(P>0.05,图1)。

图1 壳寡糖(10%)对杂交黄颡鱼细胞免疫的影响Fig.1 Effects of dietary chitosan oligosaccharide (10%)supplemental levels on white blood cell phagocytic percent,Phagocytic index,lymphocyte transformation rate and white blood cell count of hybrid yellow catfish
试验鱼白细胞鉴别见图2,形态描述如下:
红细胞: 成熟红细胞卵圆形,表面光滑,细胞核居中,瑞氏-吉姆萨染色紫红;幼稚红细胞核较大,紫色,胞质瑞士-吉姆萨染色下灰蓝色。
血栓细胞: 胞体小,纺锤形、卵圆形、圆形,细胞核W-G染色紫红,胞质灰白或不着色,部分裸核。
淋巴细胞: 核质比最大的细胞,W-G染色核紫红,胞质蓝色。休止淋巴细胞核与膜常向切,母型淋巴细胞胞浆丰富,常呈圆形,直径增大,过度型间于二者之间。
中性粒细胞: 细胞核W-G染色紫红,与胞膜相切,细浆丰富,内含小颗粒,核质比小于单核细胞。
单核细胞: 白细胞中个体最大,细胞核圆形或不规则,核质比大于中性粒细胞,小于淋巴细胞,常见巨大伪足。
体液免疫壳寡糖(10%)添加可显著提高试验鱼外周血溶菌酶活力(P=0.022)。有效剂量80 mg/kg时,显著高于0 (P=0.032)及40 mg/kg(P=0.035),与120 mg/kg时差异不显著(P>0.05,图3)。
壳寡糖对外周血补体C3、C4含量无显著影响(P>0.05,图3)。
随壳寡糖有效剂量增加,外周血IgM含量的变化趋势与溶菌酶类似,80及120 mg/kg组显著高于0和40 mg/kg(P<0.05,图3)。
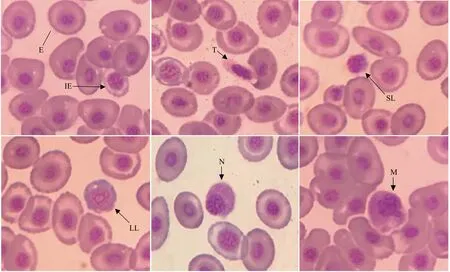
图2 杂交黄颡鱼血细胞形态示例Fig.2 Microstructure of peripheral blood cells of hybrid yellow catfish
3 讨论
3.1 壳寡糖对杂交黄颡鱼生长性能的影响
壳寡糖(COS)对鱼类生长性能具积极作用已多见报道,其促生长机理通常被归结为以下3点: (1)保护肠黏膜,改善上皮组织结构[15—17];(2)促进矿物质吸收,这与消化道pH调节及壳寡糖自身的(-NH2)、(-OH)两个官能团有关[16,18,19] ;(3)提高消化酶活力,但未确认内源性(试验对象消化腺分泌)或外源性(消化道内微生物分泌)[20,21]。在壳寡糖促进陆生动物生长性能的报道中,则有更丰富的机理阐述。对于畜、禽,炎症反应会通过以下4个途径抑制生长:(1)影响神经体液调节;(2)造成线粒体功能紊乱;(3)干扰三大营养代谢;(4)增大能量支出[22—24]。壳寡糖能结合巨噬细胞表面位点,抑制多种蛋白激酶磷酸化,阻断信号通路,实现炎症抑制,故有利于生长[25,26]。对鱼类,壳寡糖亦能抑制肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)等炎症因子,提升抗炎因子白介素10(IL-10)的表达水平,以减弱炎症反应[27,28]。可以推测,炎症抑制作用,也是壳寡糖促进鱼类生长的原因之一。鱼类炎症反应对生长性能的影响方式,有待进一步研究。
由表6可知,壳寡糖对水产动物生长速度、饲料利用的有效改善剂量在0.1—10 g/kg。如此巨大的差异显然不能用试验动物品种不同解释(同品种相似规格的不同报道间仍有巨大差异),更可能是由试验所用壳寡糖自身特性导致。有学者定义聚合度≤20,平均分子量<3900 Da的壳聚糖水解产物为壳寡糖[2],但未形成标准,目前不同来源的壳寡糖聚合度、分子量有较大差异。而聚合度、分子量对壳寡糖在小肠中的可吸收性存在巨大影响[29]。在能明确聚合度或分子量的已有报道中(分子量≤5600 Da),促水产动物生长有效剂量在0.1—1 g/kg,而仅于市场采购壳寡糖商品,未明确聚合度或分子量的试验中,促生长有效剂量高达2—10 g/kg(表6)。可见,脱离聚合度或分子量开展壳寡糖应用研究,将在一定程度上失去可比较性。本试验所用壳寡糖聚合度2—8,分子量2000 Da,应用120 mg/kg时(以壳寡糖纯品计)对杂交黄颡鱼生长速度及饲料利用产生了显著影响,与能明确所用壳寡糖分子量≤5600 Da的报道中所述剂量接近[17,18,20,21,30]。
双因素方差分析显示,在本试验条件下,杂交黄颡鱼仍表现出一定程度雌、雄生长差异。但直至试验结束,雄性平均规格>90 g,雌性平均仅比雄性小约7 g,差异微弱,推测生产中对成品鱼捕捞及售出不会形成明显影响。

图3 饲料壳寡糖(10%)水平对杂交黄颡鱼体液免疫的影响Fig.3 Effects of different dietary chitosan oligosaccharide (10%)levels on the humoral immunity of hybrid yellow catfish
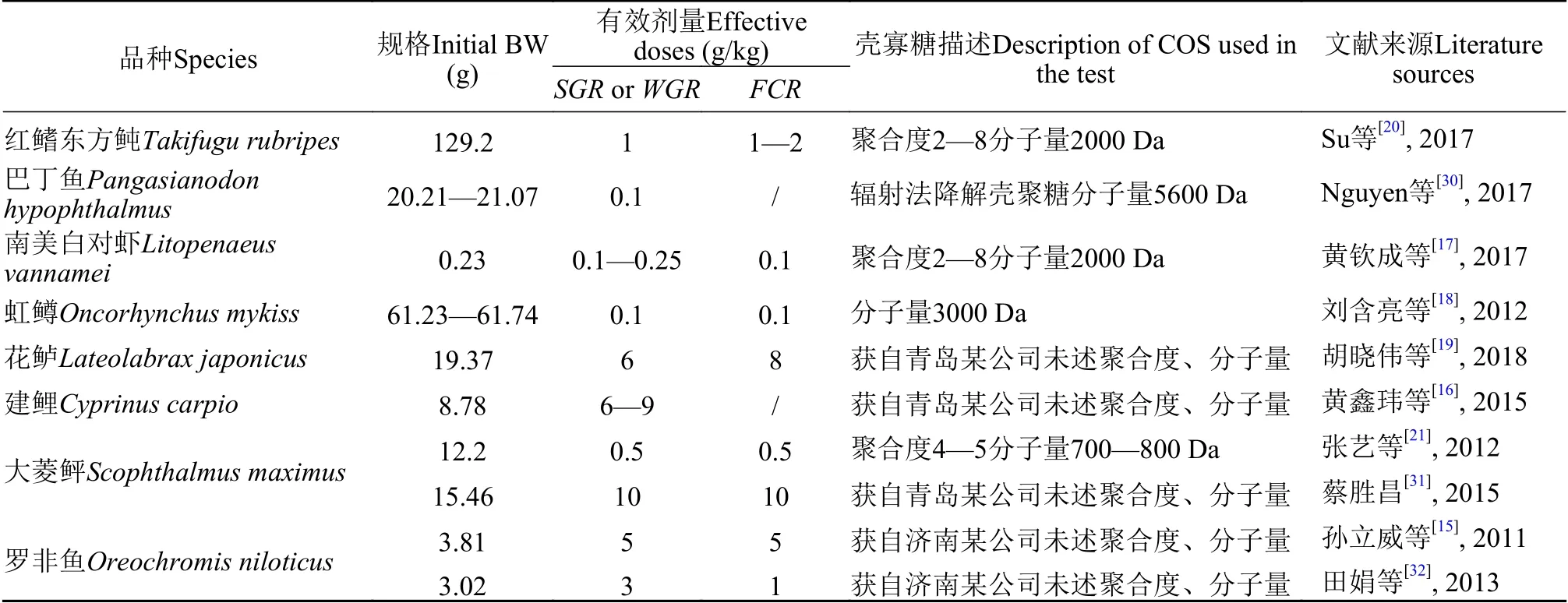
表 6 已有报道中壳寡糖的有效剂量(以壳寡糖纯品计)Tab.6 Effective doses of chitosan oligosaccharide reported in literatures
在本试验中,壳寡糖对杂交黄颡鱼完整群体生长速度的有效促进剂量为120 mg/kg,但双因素方差分析显示,对雄性仅80 mg/kg。与雄性相比,完整群体对壳寡糖添加量的不敏感归因于: 本试验中雌性生长性能,似乎与壳寡糖剂量不相关。雌性的这一表现令人费解。推测成因,可能是雌性中的小规格个体,作为群体的最弱小者,受“社会性干扰”效应的影响,生长缓慢[33]。当雌性规格差异较大,“社会性干扰”效应更加突显,致使壳寡糖有限的促生长作用不能体现。在本试验中,以各平行初始雌性体重变异系数为协变量做协方差分析,发现该变量确对生长有显著影响,校正(通过回归模型的协方差分析将协变量在19.4661%处统一估计)后发现,雌性生长速度亦受壳寡糖剂量的显著影响,印证了上述推测。
3.2 壳寡糖对杂交黄颡鱼免疫机能的影响
在本试验中,不同剂量壳寡糖未能显著改变杂交黄颡鱼外周血白细胞数。事实上,外周血白细胞数未必能准确反映动物免疫力,当动物处于炎症反应或某些胁迫中,白细胞数很可能显著提升,但不表示免疫力强。如在低溶氧条件下饲养黄颡鱼,外周血白细胞数显著高于饱和溶氧条件下,但其他指标及攻毒结果均证明低氧导致黄颡鱼免疫力显著低下[34]。白细胞吞噬活性则更具参考价值。本研究结果显示,壳寡糖显著促进杂交黄颡鱼白细胞吞噬活性,该促进作用主要体现在白细胞平均吞入细菌个数增多,而非使参与吞噬的白细胞数量升高。对巴丁鱼(Pangasianodon hypophthalmus)的研究呈类似结果[30]。但有文献报道不同结果,即壳寡糖能增加参与吞噬的白细胞数量[16]。同一品种(虹鳟Oncorhynchus mykiss),相近初始规格(50 g/尾和60 g/尾),周期基本一致(50d和49d)的不同报道,在壳寡糖能否增加参与吞噬的白细胞数方面,仍存在不同结果[18,35]。这可能与剂量有关,即低剂量时仅影响吞噬指数,高剂量时吞噬百分比也受显著影响。
植物血凝素(PHA)为有丝分裂原,在离体时均可与淋巴T细胞膜受体结合,激活腺苷酸环化酶,升高cAMP水平,促进DNA合成,故能刺激淋巴细胞由休止型向母型转化。该转化率体现动物特异性细胞免疫能力,但血涂片光镜观察时,T、B细胞难以区分,故计算总淋巴细胞转化率[14,34]。本试验结果表明,壳寡糖对杂交黄颡鱼特异性细胞免疫增进作用显著,用量0—80 mg/kg(以壳寡糖计)内作用强度递增,后趋于稳定。壳寡糖对鱼类淋巴细胞转化率的影响以往未见报道。但有报道显示,壳寡糖显著提高了青鱼(Mylopharyngodon piceus) IL-2 mRNA表达量,IL-2是T细胞生长因子,能促进T细胞活化[28],该报道从另一角度说明了壳寡糖对特异性细胞免疫有促进作用。
溶菌酶活力是壳寡糖对鱼类免疫系统影响的报道中最常被观测的指标之一,普遍发现壳寡糖对其有显著促进作用。壳寡糖对巴丁鱼外周血溶菌酶活力的显著促进剂量为50 mg/kg[30],对虹鳟[18]、红鳍东方鲀(Takifugu rubripes)[36]的报道中剂量较高。在本试验中添加80 mg/kg显著改变溶菌酶比活力,与巴丁鱼结果接近。
在试验结束时,各组血清补体C3、C4含量未见显著差异。这一静态结果未必能充分反应壳寡糖对试验鱼补体系统的作用。原因在于: (1)外周血补体含量相同的情况下,免疫细胞补体受体的亲和力可能不同;(2)已有报道显示,饲料添加不同剂量壳聚糖投喂黄颡鱼,30d时不同组间C3含量差异显著,但投喂至60d,组间差异不再显著[12]。本试验饲养56d,一次性取样,可能错过了试验因素对补体含量影响显著的时间点。
随壳寡糖添加量增加,免疫球蛋白IgM含量的变化趋势与溶菌酶类似,表明试验鱼特异性体液免疫能力被提升。本试验场地为养殖企业生产基地,不便安排攻毒。壳寡糖对黄颡鱼在不同病原攻毒下的保护率有待研究报道。
4 结论
在本试验条件下,饲料中添加壳寡糖120 mg/kg(以纯品计),能显著提高杂交黄颡鱼“黄优1号”生长速度;添加40—80 mg/kg(以纯品计),能显著提高“黄优1号”特异及非特异性免疫能力,表现为白细胞吞噬指数、淋巴细胞转化率、溶菌酶活力、免疫球蛋白含量的显著提升;壳寡糖的应用研究,应明确聚合度或分子量,否则无法比较分析。

