紫心甘薯转录因子bHLH的基因克隆及功能研究
惠亚可,胡敏伦,郭晋雅,高 峰
(华南师范大学生命科学学院∥广东省植物发育生物技术重点实验室,广州 510631)
甘薯[Ipomoeabatatas(L.) Lam.]是旋花科甘薯属根茎类一年生草本植物,为世界第七大农作物,也是我国广泛栽培的重要经济作物之一. 我国甘薯栽培面积达660万hm2,产量为1亿t,占世界甘薯总产量的70%[1]. 紫心甘薯是甘薯中一个具有独特遗传性状的品种类型,其块根中因含有十分丰富的花色素苷而呈深紫色[2]. 花色素苷是植物类黄酮合成途径的有色末端产物,而由紫心甘薯提取的花色素苷色彩鲜艳,并且具有较好的热稳定性和光稳定性. 同时,紫心甘薯花色素苷还具有抗氧化、清除自由基、降血糖、降血脂、抑制肿瘤、护肝、抗菌等多种药理功能[3-4]. 因此,紫心甘薯可作为提取安全无毒天然色素的优质原料.
bHLH 类转录因子,是真核生物中广泛存在的一个较大的转录因子家族,因其具有保守的碱性-螺旋-环-螺旋(Basic-Helix-Loop-Helix)结构域而得名. bHLH结构域由约60个氨基酸构成,其中包括2个功能区域:一是碱性区域,负责与DNA的结合,其在多肽链的N 端,并含有大量碱性氨基酸,由大约15个氨基酸组成,其中有6个共有的氨基酸残基;二是HLH 区域,分布在C 端,主要由疏水氨基酸残基构成,其中含有既亲水又亲脂的α-螺旋,2个α-螺旋之间被不同长度的连接区(环)分开,形成螺旋-环-螺旋结构,利于HLH 之间相互作用形成二聚体. bHLH 转录因子通常通过形成同二聚体或异二聚体与靶基因启动子的不同部位相结合,从而对基因的转录发挥调控作用[5-6].
紫心甘薯的特殊性在于其富含花色素苷的部位为深埋地下的块根,参与块根中花色素苷合成调控的相关转录因子及其调控靶标尚不很清楚. 在甘薯属植物中,已克隆获得了R2R3类MYB类转录因子基因IbMYB1,并证实了IbMYB1基因的表达与甘薯块根中花色素苷的合成密切相关,且对CHS、CHI、F3H、DFR、ANS、3GT等花色素苷合成途径中的结构基因具有调控作用[7]. 然而,bHLH类转录因子是否也参与了紫心甘薯的花色素苷合成调控,其调控方式如何尚不明确. 因此,本论文拟对bHLH类转录因子序列进行分析,研究其对紫心甘薯花色素苷合成中的调控作用,将有助于深入了解紫心甘薯花色素苷合成的分子调控机制,为在分子水平上明确紫心甘薯块根特异性合成和积累花色素苷的研究奠定基础.
1 材料与方法
1.1 实验材料
所用试材为紫心甘薯品种“山川紫”、品系“A5”和白心甘薯品种“禺北白”. 此3个甘薯品种(系)各组织的着色特征具有明显差异,其中“山川紫”块根呈紫色;“A5”块根为深紫色;而“禺北白”的块根为白色. 所有材料均采自于华南师范大学生物园.
1.2 实验方法
1.2.1 RNA和DNA的提取 RNA的提取参照北京百泰克生物技术有限公司的多糖多酚植物总RNA快速提取试剂盒的操作步骤. 从最后所得的RNA溶液中吸取2 μL总RNA,使用Nano Drop ND1000 微量测定分光光度计进行RNA浓度测定和纯度鉴定;同时吸取5 μL总RNA进行琼脂糖凝胶电泳检测其纯度(电泳相关试剂均使用RNase Free-H2O 配置). DNA是按照植物基因组DNA提取试剂盒(天根生物公司)进行提取.
1.2.2 RACE克隆技术 以紫心甘薯“山川紫”块根的总RNA为模板,以表1中F/R引物扩增,使用PrimeScript©One Step RT-PCR Kit Ver.2试剂盒进行RT-PCR扩增,分离目的基因的保守片段. 按照SMART RACE cDNA amplification user mannul手册进行甘薯5’-cDNA与3’-cDNA的合成. 根据目的基因的保守序列设计2个特异的反向引物R1和R2(巢式PCR 用),采用5’-RACE技术扩增目的基因5’端的序列. 同时设计2个特异性正向引物F1和F2,扩增目的基因3’端的序列. 再分别以特异引物F1/R1,F2/R2和通用引物UPM组合,进行第1轮和第2轮PCR反应. RACE所用引物见表1.

表1 RACE 引物使用表Table 1 The RACE primer use table
1.2.3IbbHLH1和IbbHLH2的生物信息学分析 使用Vector NTI Advance 11软件和BLAST工具 (http://www.ncbi.nlm.nih.gov)对本文克隆得到的序列进行比对分析. ORF(Open Reading Frame)的查找和核苷酸序列的翻译应用http://www.ncbi.nlm.nih.gov/gorf/gorf.html 网站的ORF Finder工具完成. 使用Expasy(http://www.expasy.ch/tools/)上ProtParam工具进行蛋白生化性质(包括相对分子量、等电点)的预测. 蛋白质的二级结构分析应用http://www.expasy.ch/tools/上SPOMA软件完成.IbbHLH2蛋白质三维模型则采用Swiss-Model同源建模软件进行预测(http://swissmodel.expasy.org/),并用Weblab ViewLite 4.0 软件进行分析. 使用CLUSTAL W(1.82)软件对目的序列进行多重比对以后,再使用MEGA 3软件中的邻位相连法(Neighbor-Joining,NJ)进行系统发生树的构建[8-10].
1.2.4 真核表达载体的构建及亚细胞定位 使用pBEGFP载体进行真核表达构建. 以“山川紫”3’-cDNA作为模板,分别扩增2条带有不同酶切位点末端的IbbHLH1和IbbHLH2的ORF序列. 分别将pBEGFP+IbbHLH1和pBEGFP+IbbHLH2质粒转化农杆菌LBA4404,并进行PCR鉴定. 将pBEGFP+IbbHLH1和pBEGFP+IbbHLH2质粒分别导入洋葱表皮细胞中,瞬时表达后,观察IbbHLH1和IbbHLH2蛋白的亚细胞定位. 亚细胞定位的方法步骤参照XU等[11].
1.2.5 RT-PCR 对于RT-PCR,从“禺北白”、“山川紫”和“A5”的根、茎和块根中提取总RNA. 以2 μL DNA为模板,使用PrimeScript,取数据的平均值. org/orf/gorf试剂盒进行RT-PCR扩增,扩增产物在0.8%琼脂糖凝胶电泳检测结果. PCR反应条件为:(1)50 ℃ 30 min;(2)94 ℃ 2 min;(3)94 ℃ 30 s;(4)55 ℃ 30 s;(5)72 ℃ 2 min;(6)72 ℃ 10 min;(7)16 ℃ Forever. 其中(3)到(5)进行36个循环数. 所用RT-PCR引物如表2,其中G14为内参[12].

表2 甘薯半定量RT- PCR引物使用表
2 结果与分析
2.1 紫心甘薯IbbHLH1 和IbbHLH2 全长cDNA 的克隆及序列特征分析
2.1.1IbbHLH1和IbbHLH2全长cDNA 的克隆 采用RT-PCR的方法克隆得到了bHLH家族的成员IbbHLH1和IbbHLH2的核心序列. 其中IbbHLH1核心序列长1 066 bp;IbbHLH2核心序列长1 200 bp. BLAST同源比对分析显示:上述2段序列与旋花科该类基因的同源性均高达93%,说明此2段序列是甘薯IbbHLH的保守片段. 根据巢式PCR获得IbbHLH1和IbbHLH2的全长cDNA序列,其碱基序列及其编码的氨基酸序列分别见图1和图2,其长度分别为2 516 bp和2 304 bp,将其在Genbank中进行登录,登录号分别为:KC708871和JF508437.
采用NCBI数据库中的ORF Finder工具对IbbHLH1和IbbHLH2的全长cDNA序列进行分析,结果表明:IbbHLH1的全长cDNA序列中包含一个长为1 878 bp的开放阅读框(ORF),编码625个氨基酸;其5’-UTR的长度为453 bp,3’-UTR的长度为185 bp,具体位置见图1.IbbHLH2ORF长度为2 004 bp,编码667个氨基酸;其5’-UTR的长度为117 bp,3’-UTR的长度为183 bp,具体位置见图2.

图1 “山川紫”IbbHLH1的全长cDNA 序列及其编码的氨基酸序列

图2 “山川紫”IbbHLH2 的全长cDNA 序列及其编码的氨基酸序列
2.1.2IbbHLH1和IbbHLH2推导的氨基酸序列的多重比对分析 采用Vector NTI Advance 11软件对IbbHLH1和IbbHLH2蛋白与其他植物来源的bHLH1及bHLH2家族成员的氨基酸序列进行多重比对分析,结果表明:不同物种来源的bHLH家族蛋白的氨基酸序列基本上是保守的,但在紫心甘薯中某些氨基酸序列存在较大变异(表3、表4).
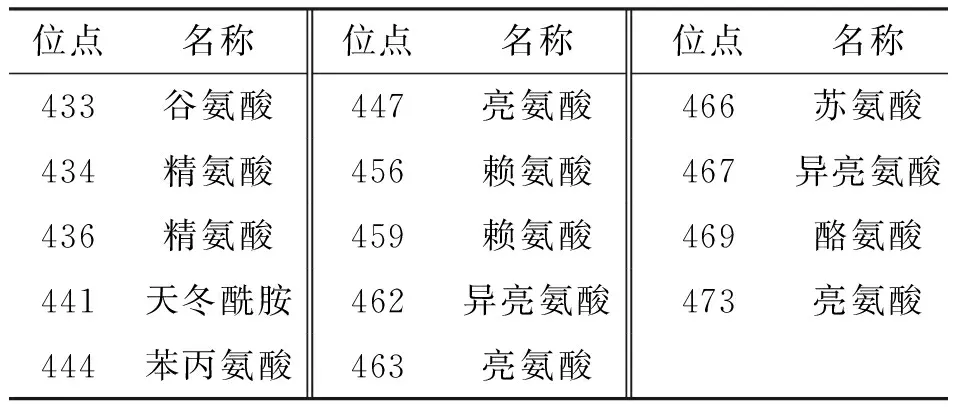
表3 IbbHLH1进化保守的氨基酸序列
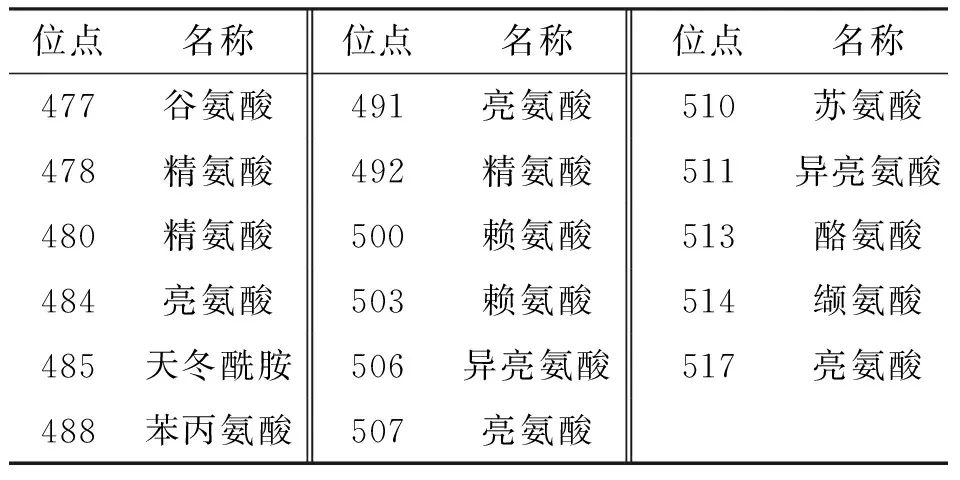
表4 IbbHLH2进化保守的氨基酸序列
IbbHLH1与同为旋花科的野薯ItabHLH2(Ipomoeatrifida,登录号EU192093)的同源性高达95.1%;与旋花科的三色牵牛ItrbHLH2(Ipomoeatricolor,登录号EU192088)同源性为93.8%;与茄科的矮牵牛PhJAF13(Petuniahybrida,登录号AF020545)的同源性为49.1%;与十字花科的拟南芥AtGL3和AtEGL3(Arabidopsisthaliana,登录号NM_148067和NM_001198373)的同源性分别为41.4%和40.6%;与禾本科的玉米ZmB和ZmP(Zeamays,登录号NM_001112236和M26227)的同源性分别为31.2%和30.3%(表3).
IbbHLH2与同为旋花科的月光花IabHLH2(Ipomoeaalba,登录号EU192097)的同源性最高,为82.7%;与旋花科的圆叶牵牛IpbHLH2(lpomoeapurpurea,录号EU032619)同源性为82%;与茄科的矮牵牛PhAN1(Petuniahybrida登录号AF260919)的同源性为51.1%;与十字花科的拟南芥AtTT8(Arabidopsisthaliana,登录号NM_117050)的同源性为38.4%(表4).
IbbHLH1和IbbHLH2氨基酸序列中均含有典型的bHLH保守结构域. 在IbbHLH1中,bHLH结构域由第421位氨基酸到第477位氨基酸组成,其中包括14个进化保守的氨基酸位点(表3);在IbbHLH2中,bHLH结构域由第465位氨基酸到第523位氨基酸组成,其中包括17个保守的氨基酸位点(表4). 上述结果表明了本文克隆获得的IbbHLH1和IbbHLH2为植物bHLH基因家族的成员.
另外,将IbbHLH1和IbbHLH2编码的氨基酸序列进行比对后,发现二者的同源性仅为28.9%. 其中较为保守的区域位于bHLH结构域以及N-端前200 个氨基酸的区域;而差异最大的区域位于N-端200个氨基酸之后至bHLH结构域之间的位置. 上述结构的差异表明IbbHLH1和IbbHLH2蛋白可能具有不同的功能.
2.1.3IbbHLH1和IbbHLH2的系统进化树分析 选取其他物种中具有bHLH结构且与花色素苷合成代谢途径相关的基因,通过ClustalX软件和MEGA 3.1软件[9],采用邻位相连(Neighbor-Joining,NJ)的方法[13]构建了IbbHLH1和IbbHLH2的系统进化树(图3). 由图3可见,该进化树能较好地反应各基因的进化关系.IbbHLH1与IbbHLH2分别可以归属到bHLH1、bHLH2的大分支中;另外,IbbHLH1和IbbHLH2分别与同为旋花科的三色牵牛(Ipomoeatricolor)和圆叶牵牛(Ipomoeapurpurea)的亲缘关系最近. 表明IbbHLH1和IbbHLH2分别为植物IbbHLH1和IbbHLH2基因家族的成员.
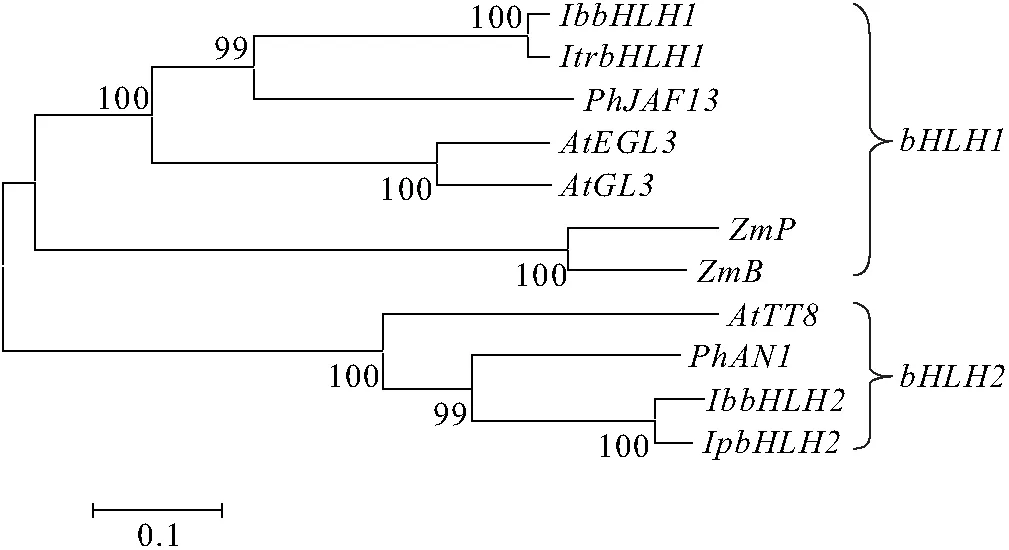
图3 IbbHLH1和IbbHLH2基因NJ系统进化树的构建
2.1.4 IbbHLH1和IbbHLH2蛋白结构预测与亚细胞定位 SOMPA分析IbbHLH1和IbbHLH2蛋白的二级结构,显示α-螺旋是其主要结构基元,其保守的碱性-螺旋-环-螺旋结构域的三维模型的分析结果表明:IbbHLH1和IbbHLH2具有bHLH蛋白家族典型的碱性-螺旋-环-螺旋结构域,并且保守的氨基酸位点主要分布于其中的螺旋区域.
将IbbHLH1-EGFP和IbbHLH2-EGFP导入洋葱表皮细胞中瞬时表达,在OLYMPUS OptiGrid荧光显微镜下观察融合蛋白IbbHLH1-EGFP和IbbHLH2-EGFP瞬时表达产生的绿色荧光信号(图4). 由图4可见:未侵染的洋葱表皮细胞由于没有目的蛋白存在,因此在488 nm的蓝光激发下只有细胞壁有微弱的自发荧光,而侵染35S∶∶IbbHLH1-EGFP+LBA4404和35S∶∶IbbHLH2-EGFP+LBA4404农杆菌后的洋葱表皮细胞的细胞核中均可看到明显的绿色荧光信号,说明IbbHLH1和IbbHLH2蛋白均定位于细胞核中.
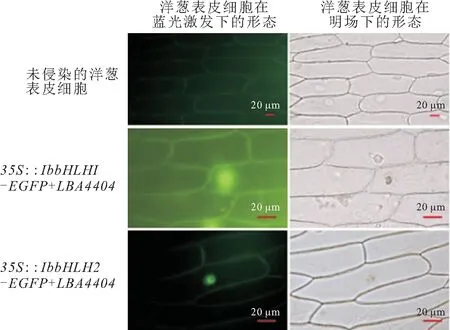
图4 洋葱表皮细胞中IbbHLH1-EGFP和IbbHLH2-EGFP融合蛋白的亚细胞定位
2.2 不同品种中IbbHLH1、IbbHLH2及花色素苷合成相关基因的表达特征
分析紫心甘薯品种“山川紫”、品系“A5”和白心甘薯品种“禺北白”各块根IbbHLH1和IbbHLH2的表达模式,同时分析其他花色素苷合成相关结构基因(CHS、CHI、F3H、DFR、ANS和3GT)的表达模式. 结果(图5A、B)显示:在块根中,除IbbHLH1外,其他基因的表达模式均与各品种(系)块根的着色特征一致,IbbHLH2与结构基因的表达量从高到低依次为A5、山川紫、禺北白(图5B). 上述结果推测:IbbHLH2可能参与甘薯块根中花色素苷合成途径一系列酶基因的表达与调控,而IbbHLH1可能与紫心甘薯花色素苷的合成无关.
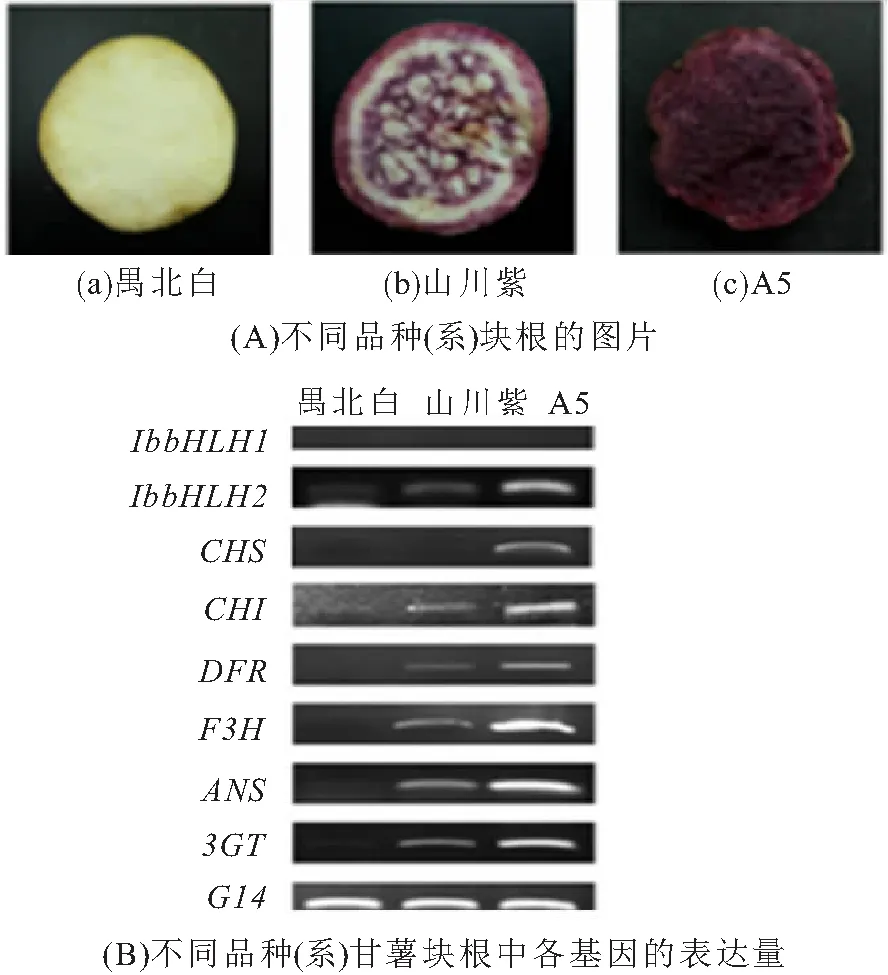
图5 不同品种(系)甘薯块根中各基因的表达量
3 讨论
根据同源克隆的原理,本研究从紫心甘薯中克隆获得了2个bHLH转录因子家族成员基因,分别命名为IbbHLH1(GenBank 登录号:KC708871)和IbbHLH2(GenBank 登录号:JF508437). 对于上述2个基因是否属于bHLH蛋白家族的成员,本文根据ATCHLEY等[5]提出的标准来鉴定. ATCHLEY应用运用统计学的手段,分析了242种生物中的bHLH蛋白,提出了bHLH家族成员的判断标准. 本文在IbbHLH1的bHLH结构域中发现14个进化保守的氨基酸位点(表 3);在IbbHLH2中也找到共17个保守位点(表4). 上述结果符合ATCHLEY提出的标准,因此可以判定IbbHLH1和IbbHLH2均属于bHLH 家族成员. 典型的转录因子含有核定位信号功能区域,使其能进入细胞核,与结构基因上游的调控序列结合,从而发挥转录调控的功能. 进一步证实IbbHLH1和IbbHLH2蛋白均定位于细胞核中,与转录因子的核定位特征一致,确定本文获得的IbbHLH1和IbbHLH2是转录因子基因.
目前,研究者已对花色素苷的合成代谢途径及其相关调控因子在模式植物中进行了大量的研究. 研究表明:花色素苷的合成是由一系列结构基因编码的酶催化完成的,而这些结构基因的转录水平受到转录因子在不同时空上的组合调控[14-16]. 参与花色素苷生物合成途径调控的转录因子主要包括3大类:MYB、bHLH和WD40. 这3类转录因子可单独作用调控花色素苷合成途径中结构基因的表达,也可形成蛋白复合体共同调控相关结构基因的表达,进而控制花色素苷在植物中的积累模式[17].
bHLH类转录因子是真核生物中广泛存在的一个较大的转录因子家族[5-6]. 目前,研究得最清楚的影响花色素苷生成的调节基因是玉米Lc(leafcolour)基因和CL(colorless)基因[18]. 研究[19]发现:Lc基因对DFR、F3’5’H、ANS、UF3GT的激活作用较强,对花色素苷合成途径起到重要影响. 继玉米Lc基因被克隆以后,在其它植物中先后发现了编码bHLH 蛋白的基因,例如调控金鱼草花冠颜色的Delila基因[20],调控矮牵牛花色的AN1基因和B-Peru基因[21-22],以及在茄子果皮和果肉中均有表达的SmGL3和SmTT8基因[23]等,这些调节基因均调控花色素苷合成途径下游的关键酶[24].
前人的研究发现:bHLH类转录因子在植物生长发育以及花色素苷的合成代谢中起着十分重要的调节作用. 目前已从玉米、拟南芥、牵牛、甜橙、大丽菊等多种植物中分离获得了调控花色素苷生物合成的bHLH转录因子基因. 参与花色素苷合成调控的bHLH类转录因子家族成员,依据其进化特征可分为2类:bHLH1和bHLH2.然而,不同种属的植物中,参与花色素苷调控的bHLH类转录因子家族成员有所不同,并且其对花色素苷合成的调控模式也存在差异.
在矮牵牛中存在2种编码bHLH类转录因子的基因(AN1和B-Peru),前人将二者分别命名为bHLH2和bHLH1[15,21]. 在同属旋花科的日本牵牛(Ipomoeanil)、圆叶牵牛(Ipomoeapurpurea)和三色牵牛(Ipomoeathicolor)中也分别克隆获得了bHLH2和bHLH1基因[22-23].bHLH1和bHLH2基因的表达均与牵牛花中花色素苷的积累相关,在深紫色的牵牛花中二者均大量表达,在浅粉色花中二者的表达量均明显下降,而在白色花中bHLH1的表达量继续下降但仍有表达,而bHLH2的表达量接近于零,说明bHLH2基因对牵牛花色素苷的合成具有更加关键的调控作用.在旋花科植物圆叶牵牛中,转录调控基因IpIVS(IpbHLH2)能够调控花色素苷合成途径中相关基因的表达的作用,对DFR-B和ANS的调控作用最为明显,在bHLH2表达缺陷型的植株种皮中,DFR-B和ANS的表达量几乎为零[25]. 本文分析了IbbHLH1、IbbHLH2及花色素苷合成酶基因(CHS、CHI、F3H、DFR、ANS和3GT)在3个甘薯品种(系)的块根中的表达量,结果表明:在块根中,除IbbHLH1外,IbbHLH2与结构基因的表达模式一致,且与各品种(系)块根的着色特征一致,即IbbHLH2与结构基因的表达量从高到低依次为A5、山川紫、禺北白(图5B). 上述结果推测:IbbHLH2可能参与甘薯块根中花色素苷合成途径一系列酶基因的表达与调控,而IbbHLH1可能与紫心甘薯花色素苷的合成无关.
后续试验可根据前人的经验,进一步采用实时荧光定量PCR 的方法测定IbbHLH2与另外2个花色素苷合成相关转录因子IbMYB1和IbWD40,以及花色素苷合成相关结构基因(CHS、CHI、F3H、DFR、ANS和3GT)在不同品种(系)甘薯的块根及根的不同发育时期的基因表达量. 进一步验证是否IbbHLH2基因的表达与花色素苷的合成积累是同步的,是否IbbHLH2基因是紫心甘薯花色素苷合成代谢中的关键转录调控基因. 这将有助于对认识bHLH的功能奠定基础. 深入了解紫心甘薯花色素苷合成的分子调控机制,为在分子水平上明确紫心甘薯块根特异性合成和积累花色素苷的研究奠定基础.

