Fe2O3/改性沸石催化剂的制备及其催化臭氧氧化对氯苯酚
张兰河,郭琳,李佳宁,陈子成,贾艳萍,李正,关晓辉
(1 东北电力大学化学工程学院,吉林吉林132012;2 吉林建筑大学松辽流域水环境教育部重点实验室,吉林长春130118)
臭氧作为一种绿色氧化剂,能够与有机物发生反应,降低有机物的浓度。但是,单独臭氧氧化有机物存在矿化程度差和臭氧利用率低等问题[1]。许多学者利用非均相催化臭氧氧化技术处理难降解有机废水[2-3],通过金属元素的电子转移使吸附在催化剂表面上的臭氧生成强氧化性的羟基自由基(·OH),催化氧化有机物[4]。开发活性高、稳定性好、催化效率高的催化剂是提高污水处理效率的关键[5-6],选择合适的催化剂载体和活性组分对于提高催化效率尤为重要。
天然沸石属于硅酸盐类矿物,它的比表面积大、孔隙率高、吸附性能好,内部有许多均匀孔道,天然沸石中的硅(Si)、铝(Al)、氧(O)以及非晶态硅酸铝有助于催化活性位点的形成[7],其表面含有羟基基团、Si—O 和Al—O 结构,加速有机污染物矿化[8]。将阳离子表面活性剂负载于天然沸石上,通过离子选择性置换作用可平衡其表面电负性,提高吸附和催化效率[9-10]。铁在地球分布广泛,约占地壳的4.75%,常见化合价态有+2 价和+3 价,Fe2O3是一种重要的无机材料,常用作催化剂的活性组分[11]。张耀辉等[12]采用制备的Fe2O3-TiO2-MnO2/Al2O3催化剂处理化工园区废水,在臭氧投加量为50mg/L、催化剂填充率为50%、反应60min 的条件下,化学需氧量(COD)去除率达到52.2%;Fernando 等[13]进行了单独臭氧、Fe(Ⅲ)均相以及Fe2O3/Al2O3非均相催化臭氧氧化对草酸废水去除的对比实验,污染物去除率大小顺序为Fe2O3/Al2O3非均相>Fe(Ⅲ)均相>单独臭氧。这些研究分析了改性天然沸石或活性组分Fe2O3的单独作用,但是尚不清楚Fe2O3和改性天然沸石相结合制备的新型催化剂催化臭氧氧化难降解有机废水的效果和机理。
金属负载型催化剂的制备方法有涂覆法[14]、共沉淀[15]和溶胶-凝胶法[16]等,利用这些方法制备的催化剂普遍存在比表面积小、与有机物接触概率低的问题。本研究采用浸渍焙烧法能够有效地提高载体与金属盐溶液的接触面积,提高负载组分的利用率,浸渍后金属离子可分布在沸石表面和孔道内部。十六烷基三甲基溴化铵(CTMAB)是一种阳离子表面活性剂,同时还是一种高效的去污剂,它能够清洗去除天然沸石的表面杂质,通过离子选择性交换作用,提高天然沸石表面活性。因此,本文以十六烷基三甲基溴化铵(CTMAB)改性的天然沸石作为载体,Fe(NO3)3·9H2O 溶液为活性组分前体,制备新型Fe2O3/改性天然沸石(Fe2O3/MNZ)催化剂。利用能谱仪(EDS)、扫描电镜(SEM)、X 射线衍射仪(XRD)、N2-吸附/脱附、傅里叶变换红外光谱仪(FTIR)及X 射线光电子能谱仪(XPS)等分析方法考察催化剂性质和结构的变化,研究该催化剂催化臭氧氧化对氯苯酚废水的效果和催化机制。
1 实验材料与方法
1.1 实验装置
催化臭氧氧化反应装置采用有机玻璃制成,如图1 所示。反应器有效容积为1.5L,间歇式运行,臭氧由臭氧发生器(COM-AD-01,德国)产生,气源为空气。通过电磁流量计控制臭氧流速(2L/min),臭氧由反应器底部的曝气板进入反应室,尾气经2%碘化钾溶液进行吸收。在臭氧浓度为2.6mg/L,对氯苯酚初始浓度为100mg/L,温度为25℃,pH 为7.0±0.2,催化剂投加量为10g/L 条件下,每隔5min 取1 次水样,分析对氯苯酚浓度和COD浓度的变化情况。
1.2 催化剂的制备
Fe2O3/改性天然沸石(Fe2O3/MNZ)催化剂的制备流程如图2所示。天然沸石取自河南巩义,外观呈粉色,杂质较多,需对其进行预处理,预处理的流程如图2(a)所示。经过筛分(25~30 目)后,利用蒸馏水反复清洗沸石表面的可溶性无机物,置于105℃烘箱烘干冷却后,再置于350℃马弗炉中焙烧2h去除不溶性有机物。
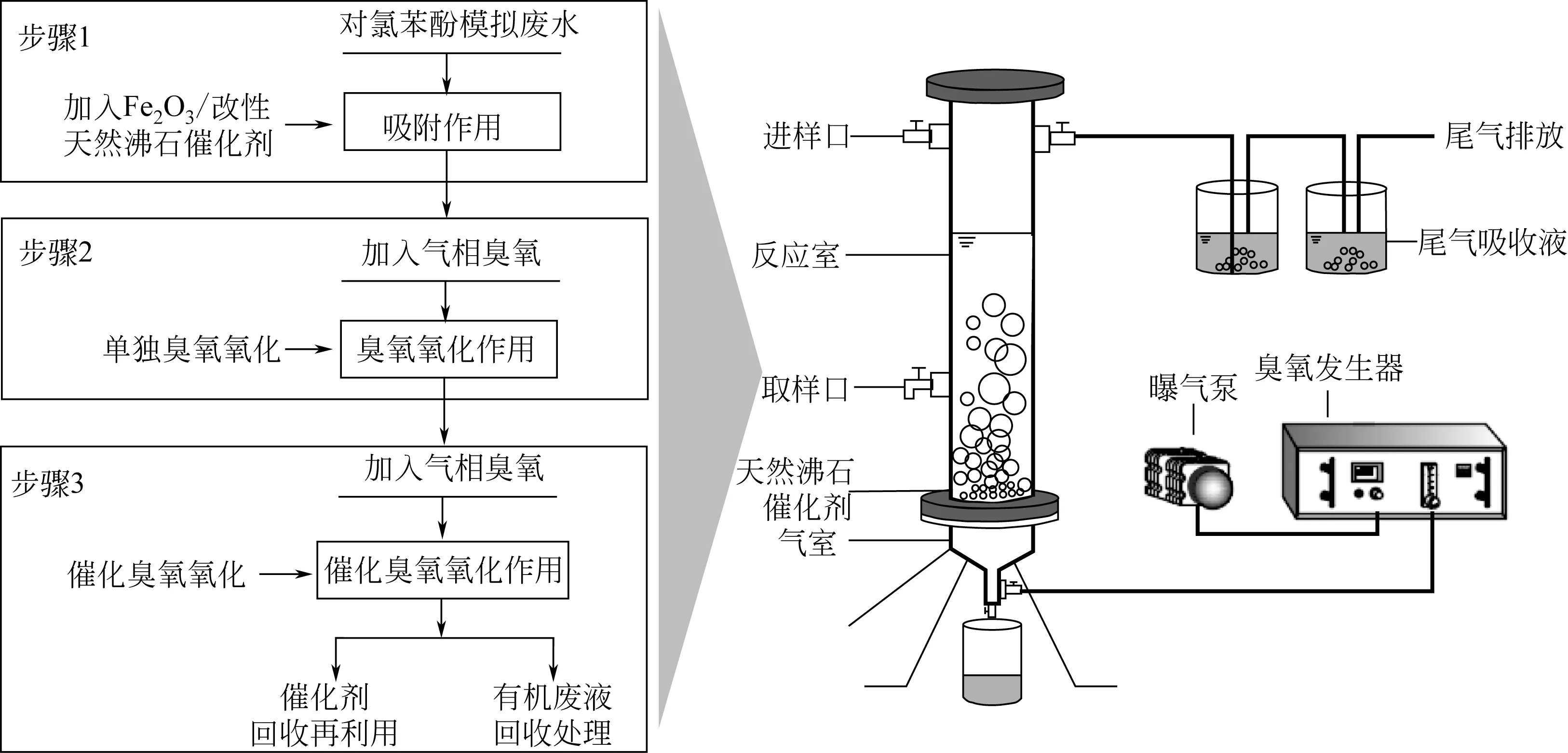
图1 催化臭氧氧化对氯苯酚废水工艺流程
天然沸石改性流程如图2(b)所示。量取100mL 0.055mol/L 十六烷基三甲基溴化铵(CTMAB)溶液,称取10g 天然沸石置于烧杯中,在30℃、20r/min 的条件下,恒温加热磁力搅拌6h,然后离心(4000r/min)5min,滤除上清液,采用去离子水洗涤,重复离心操作多次直至检测不到Br-为止,再置于105℃烘箱烘干,得到有机改性天然沸石。
催化剂的制备流程如图2(c)所示。量取100mL 1mol/LFe(NO3)3溶液,称取5g 改性沸石恒温加热磁力搅拌(30℃、20r/min)24h 后,抽滤、烘干,再放入马弗炉(升温速率为100℃/h,升温至500℃)煅烧2h,制备Fe2O3/MNZ。使用后的催化剂在烘箱中105℃烘干2h后,再置于马弗炉中500℃煅烧2h,进行再生处理。
1.3 分析项目和检测方法
采用X 射线衍射仪(XRD,700 S/L 型)分析样 品 物 相,X 射 线 源 为Cu 靶 的Kα射 线(λ=0.15405nm),管电压为40kV,管电流为30mA,扫描范围为10°~40°,扫描速度为4°/min;采用场发射扫描电镜(TEM,XL-30 型)及能谱仪(EDS,OXFORD INSTRUMENTS 生产)研究催化剂粒径、表面形貌及元素组成;采用ASAP-2020M型全自动比表面积和微孔分析仪分析催化剂比表面积及孔径分布,样品在120℃下脱附6h,然后吸附12h,比表面积采用BET(Brunauer-Emmett-Telle)方程计算,孔径大小及分布采用BJH (Barrett-Joyner-Hallender)吸附模型计算;采用X射线电子能谱仪(XPS,Thermo ESCALAB250 型)分析金属元素化合价状态;采用傅里叶红外光谱仪(FTIR)考察催化剂官能团变化。
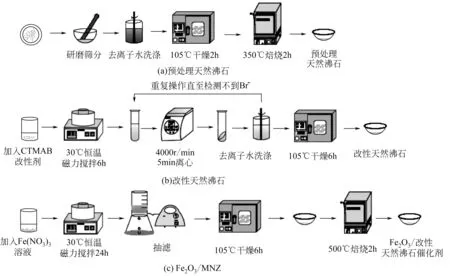
图2 Fe2O3/MNZ催化剂制备流程
采用紫外分光光度法(UV-7504 型)检测对氯苯酚的浓度,波长为225nm[17];采用5B-3BV8型多参数水质分析仪检测COD,采用pH 计(梅特勒Five Easy PlusTM台式) 检测pH 的变化;采用200mmol/L叔丁醇作为·OH的捕获剂,研究·OH对催化臭氧氧化反应的影响;采用RE-530IPC 分子荧光光谱仪测定羟基自由基,最大吸收激发波长为354nm,发射波长为458nm,夹缝设为1.5nm×1.5nm;采用碘量法检测气相臭氧浓度[18]。
2 结果与讨论
2.1 催化剂的结构分析
天然沸石、有机改性天然沸石及负载金属氧化物改性沸石的TEM 图如图3 所示。由图3(a)可知,天然沸石具有微米级的片状颗粒团聚结构,有明显的分界线,表面粗糙;由图3(b)可以看到,经CTMAB 改性后的天然沸石,生成的羟基索氏体晶体表面形貌不规则[19],大多呈现花瓣状结构;然而,由图3(c)可知,负载Fe2O3的MNZ 晶粒明显变小,表面呈海绵状微孔晶体结构。这说明催化剂表面形态取决于相组成、晶体粒度、化学成分及空隙结构。
利用N2-吸附/脱附实验分析沸石改性前后的比表面积、孔容和孔径变化,结果如图4所示。由图4(a)可知,3种催化剂曲线均属于典型的Ⅳ-型等温线,在低P/P0区,曲线向上,与Ⅱ型等温线类似;在较高P/P0区,等温线迅速上升;当P/P0接近1时,发生毛细管凝聚,脱附与吸附得到的等温线不重合,脱附等温线位于吸附等温线之上,脱附滞后,产生H1 型滞留环,这种现象与孔的形状、大小及分布有关[19]。Fe2O3/MNZ 催化剂滞留环最小,其孔径分布均匀,空间中含有微孔和中孔,属于介孔结构。图4(b)表明,Fe2O3/MNZ 催化剂孔径分布主要在2.6~9.2nm,最大孔径为4.9nm,这说明Fe2O3/MNZ催化剂孔径均匀。

图3 天然沸石、有机改性天然沸石和Fe2O3/MNZ催化剂的TEM图

表1 催化剂的比表面积、孔容和孔径对比
由表1 可知,经CTMAB 改性后的天然沸石骨架稳定性变差,形成的微孔增加了沸石的比表面积。负载Fe2O3后的改性天然沸石比表面积小于CTMAB 改性的天然沸石,这主要有两方面原因:①掺杂的Fe2O3占据天然沸石的部分表面;②高温煅烧造成天然沸石内部微孔坍塌,形成介孔。

图4 不同催化剂的N2-吸附/脱附曲线及孔径分布图
利用EDS分析催化剂的元素组成,如图5(a)所示。天然沸石含有的主要元素为Si、Al、O等,改性后的天然沸石显著脱硅,添加活性组分后,Fe元素、O 元素含量明显增加。利用XRD 分析催化剂的晶型,如图5(b)所示。天然沸石的主要成分为Ca3Al6Si9O3·15H2O,是由共用氧连结在一起的硅-氧四面体和铝-氧四面体三维格架组成,属于典型的天然斜发沸石,在2θ为22.662°处出现了SiO2特征峰。经CTMAB改性后,未发现CTMAB衍射峰和其他杂峰,这说明天然沸石主要成分未发生变化,有机改性剂仅通过离子交换作用改变天然沸石的表面电负性和Si/Al 值,保持了原有的骨架结构;Fe2O3/MNZ 催 化 剂 在2θ为22.057° 、 33.316° 、35.897°、39.14°处出现了Fe2O3特征峰,制备的催化剂活性组分Fe2O3结晶效果好,未产生其他结构晶型,属于典型分子筛SRI结构[20]。
利用XPS 分析Fe2O3/MNZ 催化剂中各元素化合价的状态,结果如图5(c)所示。Fe2O3/MNZ 催化剂主要包含C、O、Al、Si、Fe 等元素,O 元素在结合能为532eV 处出现信号,结合能主要由催化剂中金属氧化物的晶格氧产生;Fe 2p1/2在结合能为710.7eV 处出现信号,Fe 以Fe2O3的形式存在,这与XRD 分析结果一致。催化剂的FTIR 谱图如图5(d)所示,3 种催化剂在495cm-1和782cm-1处的吸收峰是Si—O 四面体弯曲振动的特征峰,在1050cm-1处的吸收峰是Si—O 四面体反对称伸缩振动的特征峰[20-21],在3516cm-1处的吸收峰为羟基基团(—OH)伸缩和弯曲振动的特征峰。3 种催化剂均含有丰富的表面羟基。
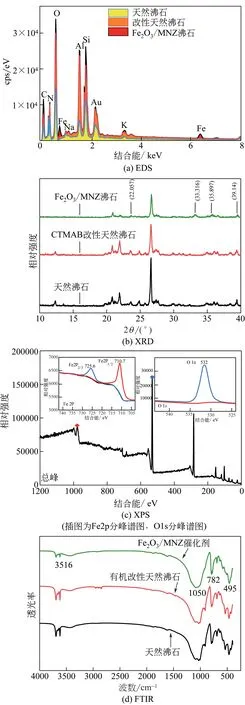
图5 催化剂的性能表征
2.2 不同反应体系降解对氯苯酚的效果
不同反应体系对对氯苯酚和COD 去除率的影响如图6所示,随着反应时间的增加,对氯苯酚和COD 去除率逐渐提高。催化剂对对氯苯酚存在吸附作用,按照对氯苯酚和COD 去除率大小顺序排列为:天然沸石<改性天然沸石<Fe2O3/MNZ 催化剂。但是催化剂的吸附效果均低于臭氧氧化体系对对氯苯酚的去除效果。金属氧化物催化剂催化臭氧氧化对氯苯酚的效率(87.26%)比单独臭氧氧化高43.52%,COD 去除率为48.83%,这因为Fe2O3/MNZ 催化剂为催化臭氧氧化提供了更大的反应空间,负载金属氧化物后,催化剂表面的活性位点增加,促进催化剂表面上的O3分解为氧化能力更强的·OH,去除有机物的反应由直接臭氧氧化转变为间接臭氧氧化为主。因此,O3-Fe2O3/MNZ 催化剂反应体系的催化效率更高。

图6 不同催化剂吸附和催化臭氧氧化对氯苯酚的去除率
2.3 改性沸石催化臭氧氧化降解对氯苯酚的机制
臭氧单独氧化与催化剂吸附作用去除对氯苯酚的能力较低,利用催化臭氧氧化降解对氯苯酚,其去除率大大提高[22-23]。叔丁醇与·OH的反应速率为5.0×108mol/(L·s),大于叔丁醇与臭氧的反应速率3.0×10-3mol/(L·s)[24]。叔丁醇首先与·OH 生成大量中间产物,阻止其生成O2·-和HO2·-,自由基链式反应受到抑制甚至停止[25]。在单独臭氧氧化体系和催化臭氧氧化反应体系中分别加入200mmol/L叔丁醇溶液,考察对氯苯酚去除率的变化,结果如图7所示。加入叔丁醇后,对氯苯酚去除率明显下降,说明在催化臭氧氧化过程中起主要作用的是·OH,催化臭氧氧化反应体系加入叔丁醇后,叔丁醇优先与体系中产生的·OH 反应,生成的中间产物具有高度选择性和惰性[26],从而抑制了自由基的链式反应,阻碍了对氯苯酚的降解和矿化。

图7 叔丁醇对催化臭氧氧化的影响
采用7-羟基香豆素作为·OH 捕获剂分析表面羟基自由基浓度,如图8所示。荧光强度反映·OH浓度的大小[27]。非均相催化臭氧氧化体系中的羟基自由基浓度高于单独臭氧体系,催化剂的加入加速了·OH的产生,而O3-Fe2O3/MNZ催化剂比臭氧-有机改性天然沸石羟基自由基浓度高,这是因为金属氧化物的负载为催化臭氧氧化的反应过程提供了更多的活性位点,产生了更多的·OH,提高了对氯苯酚的降解效能,这证明·OH越多,去除有机污染物的效果越好[28]。

图8 羟基自由基浓度的变化
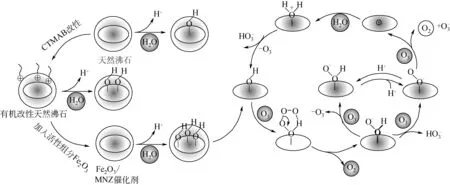
图9 催化臭氧氧化过程的反应机制
Fe2O3/MNZ 催化剂降解对氯苯酚反应机制如图9所示。金属氧化物表面阳离子不饱和配位对水分子有很强的吸附作用,吸附水分子分解OH-与H+,再与Fe2O3表面阳离子和氧阴离子形成表面羟基官能团,在催化臭氧氧化反应中与O3和对氯苯酚相互作用[29]。可溶性O3被吸附到催化剂的表面,发生了一系列的自由基链转移,产生大量的·OH,其较强的氧化能力可以降解水中有机污染物[30-31]。其中,催化剂表面Fe2O3的阳离子与中间产物·O3和HO3·发生的自由基链式反应,使催化剂表面羟基可以循环再生,有助于有机物的持续降解[14,24]。
可重复利用性是评价催化剂稳定性能的重要指标[14]。如图10 所示,Fe2O3/MNZ 催化剂重复利用5次后,对氯苯酚去除率仍高达83.06%,去除效果仅下降4.2%,这主要由于对氯苯酚降解为有机小分子过程中产生的中间物质在催化剂表面或孔道内沉积,掩盖或占据了催化剂的活性中心,造成催化剂或催化剂某些位置失活[32]。可通过高温煅烧去除孔道内有机杂质成分,使催化剂再生。其次,浸渍法提高了金属盐溶液与天然沸石的接触面积,经高温煅烧的Fe2O3负载在天然沸石上,使活性组分更大程度地与载体紧密结合,邵琴等[33]研究表明,采用沸石为载体的负载型催化剂重复利用后仍具备较高的催化活性。
3 结论
(1)利用CTMAB 表面活性剂的离子交换作用改变天然沸石的Si/Al 比,保持原有骨架结构,比表面积增加近2 倍,制备的Fe2O3/MNZ 催化剂晶相属于典型分子筛中的SRI 结构,孔径分布主要在2.6~9.2nm,最大孔径位于4.9nm处。
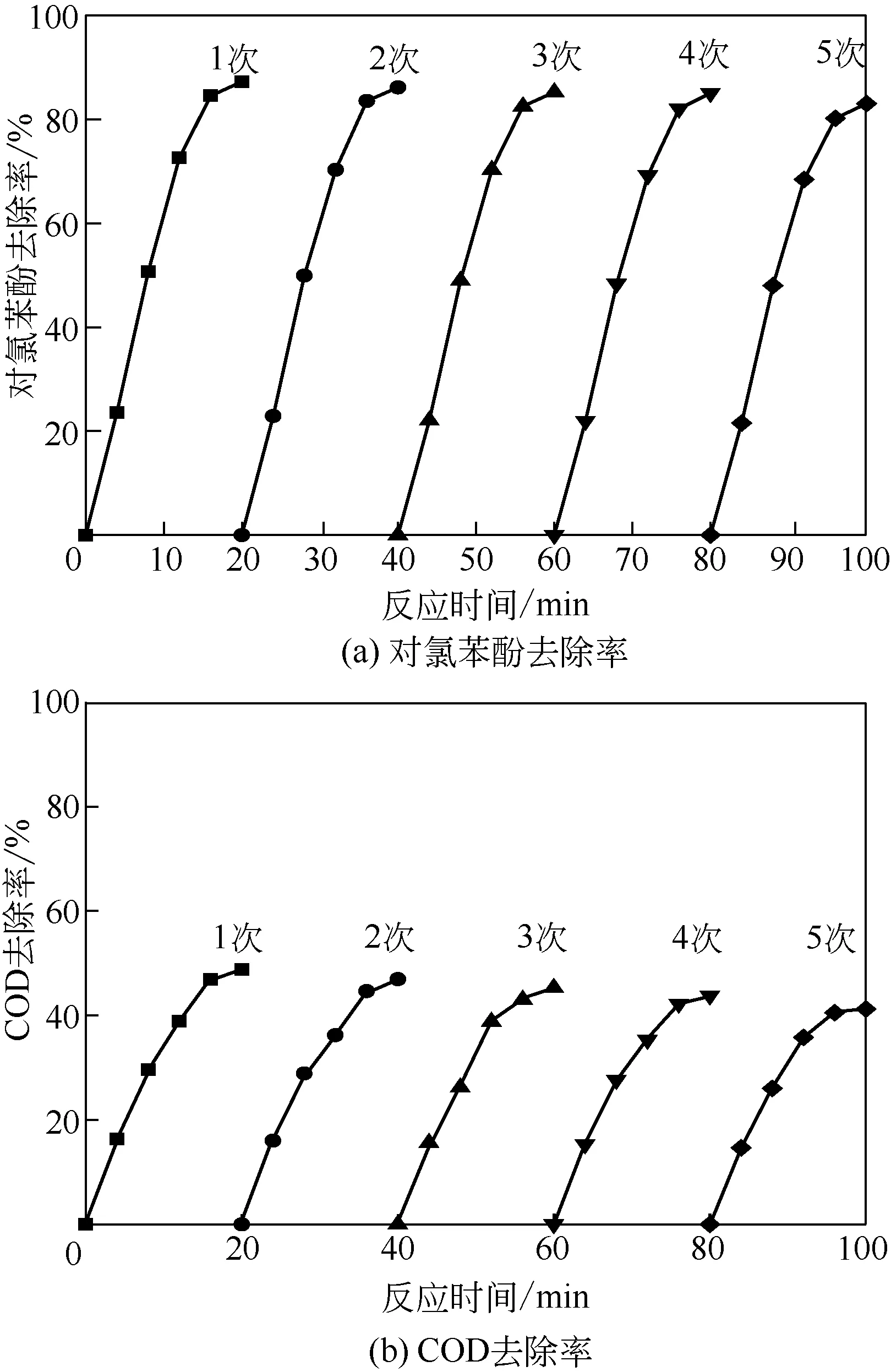
图10 Fe2O3/MNZ催化剂重复使用的效果
(2)O3-Fe2O3/MNZ 催化剂体系催化臭氧氧化对氯苯酚的去除率最高,反应过程中产生氧化性更强的·OH,促进对氯苯酚的快速降解,其反应遵循羟基自由基机理。在对氯苯酚浓度为100mg/L、催化剂投加量10g/L 和臭氧浓度2.6mg/L 条件下,对氯苯酚和COD去除率分别为87.26%和48.83%。
(3)浸渍法提高了金属盐溶液与天然沸石的接触面积,高温煅烧使金属活性组分Fe2O3更大程度地与载体紧密结合,重复使用5次后对氯苯酚去除率仍高达83.06%,具备高效性和经济性,应用前景好。

