贮藏环境与辅助添加物对紫米花色苷稳定性的影响
伍怡斐,钟锦耀,郑经绍,丁少云,梁丽月,黄 苇,*
(1.华南农业大学食品学院,广东广州 510642;2.华南农业大学电子工程学院,广东广州 510642;3.新兴县微丰农业科技有限公司,广东新兴 527400)
紫米,俗称“紫珍珠”,是有色稻中的一类[1],因其种皮、果皮以及糊粉层中富集花色苷,使其糙米呈现紫色[2]。紫糙米花色苷含量丰富,营养价值高,色彩美观,香气独特,具有深加工价值。花色苷不仅是一种色彩艳丽自然的天然食用色素[3],同时还具有抗氧化、抑菌、抗癌[4]、保护视力[5]、降血糖[6]等保健功能,是替代人工合成食用色素的理想资源[7]。但花色苷在水或乙醇溶液中极不稳定,其降解受到自身结构、光、氧、温度、pH、金属离子、酶、氧化剂等的影响[8-10],高度不稳定性为富含花色苷的物料加工及其在食品工业中的应用带来阻碍。研究环境和加工中各因素的影响,对提高紫米花色苷在食品贮藏加工中的保存率显得非常必要[7,11]。
食品中花色苷的降解与光照强度、光照持续时间等因素有关。唐榕等[12]研究光照对桑葚花色苷的影响时发现室外光下花色苷的稳定性明显变差,与室内光和避光相比,室外光下保存率急剧下降,总色差变化急剧上升。蒋新龙[14]证明黑米花色苷在pH1.0、3.0、4.5这3种酸度下,强光、自然光、避光条件对花色苷降解的影响有显著差异,室外强光会加速花色苷的降解。曾惠琴等[15]发现紫外线和阳光照射均会加速黑米色素的降解。目前的研究主要是区分自然光、紫外光对花色苷的影响。但光种类对其稳定性的影响鲜见报道。而太阳光根据不同的波长范围,可分为以下8种光:紫外光(190~380 nm)、紫光(380~450 nm)、蓝光(450~490 nm)、绿光(490~565 nm)、黄光(565~590 nm)、橙光(590~625 nm)、红光(625~740 nm)、红外光(740~1000 nm)。这些光具有不同性质,如果能了解其危害程度,在包装实际应用中就可以根据材料的透光性质进行选择,为避光包装提供更精确科学的判断,在保留包装物可透视性的同时尽可能保护内装物的稳定,获得良好的包装效果[16]。同时,也有研究报道表明,降低贮藏环境中的氧含量[17-18]和添加辅色剂[19]有利于提高食品中花色苷保存率,但综合几种因素应用于提高花色苷稳定性的研究较少。
本研究主要从光与氧这两个环境因素出发,探究了光辐照度、光的波长范围、溶氧量对花色苷溶液稳定性的影响。同时探究金属离子、辅色素两种添加物对花色苷溶液稳定性的影响,最后通过正交试验优选出维持紫米花色苷稳定的方案,为紫米产品的加工及货架期稳定提供理论依据。
1 材料与方法
1.1 材料与仪器
紫米米糠(紫稻经砻谷去壳后经过碾白所得的紫米皮层部分,紫米花色苷主要集中于该部分) 新兴县微丰农业科技有限公司提供;无水乙醇、盐酸、氢氧化钠、氯化钾、氯化钠、氯化镁、氯化钙、氯化铁、氯化亚铁、氯化铝、硫酸铜、硫酸锌、过氧化氢等 均为国产分析纯;香草醛、丁香醛、绿原酸、没食子酸、阿魏酸、咖啡酸等试剂(纯度大于95%) 上海阿拉丁生化科技股份有限公司;TL-50型脱氧剂 东莞市欣荣天丽科技实业有限公司。
ZWB1选择吸收型滤光片、JB400、JB450、JB490、HB610、HB700截止型滤光片 南通银兴光学有限公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限公司;Phs-3C数字pH计、JPB-607A便携式溶解氧测定仪 上海雷磁仪电科学仪器有限公司;SPX-150型生化培养箱 上海申贤恒温设备厂;AHD 500W球型氙灯 深圳市宏达光电科技有限公司;TXN-15020型外置调光器 深圳市兆信电子仪器设备有限公司;91150V太阳能光强测试仪 美国Newport公司。
1.2 实验方法
1.2.1 紫米花色苷溶液的制备 称取5 g过60目筛的紫米米糠于锥形瓶中,加入pH4的15%乙醇200 mL,塞上硅胶塞,60 ℃水浴加热提取120 min(按此条件获得的花色苷溶液浓度为0.075±0.015 mg/mL),抽滤,滤液继续用0.2 mol/L的盐酸调节pH到4(常见的酒精饮料的pH为3.5~5.0),得到紫米花色苷溶液,装棕色瓶备用。
1.2.2 贮藏环境中光与氧气对紫米花色苷稳定性的影响
1.2.2.1 光辐照度对紫米花色苷稳定性的影响 利用氙灯(模拟太阳光源)花色苷稳定性测试仪(图1)对花色苷稳定性进行测试。把花色苷溶液(1.2.1提取所得,下同)放置图1样品台,于不同光辐照度(0、10、30、50、70 mW/cm2)下照射30 h(预实验显示样品经过30 h的照射,处理间差异显著),腔体温度控制为25 ℃,取样测定花色苷含量,计算光辐照度对紫米花色苷的影响。
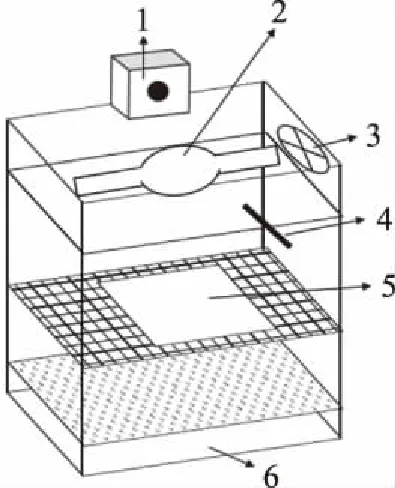
图1 氙灯(模拟太阳光源)花色苷稳定性测试仪示意图Fig.1 Schematic diagram of xenon lamp anthocyanin stability tester注:1:调光器;2:球型氙灯;3:散热风扇;4:温度探测仪;5:样品台;6:控温系统。
1.2.2.2 入射光波长范围对紫米花色苷稳定性的影响 量取20 mL花色苷溶液于无色透明玻璃瓶中,加塞封口,平放于样品台,置于光辐照度为25 mW/cm2的氙灯下。以不同型号的滤光片控制入射光的波长范围为:ZWB1(280~370 nm)、JB400(400~1000 nm)、JB450(450~1000 nm)、JB490(490~1000 nm)、JB610(610~1000 nm)、JB700(700~1000 nm)。以上述不同波长范围的光照射75 h,腔体温度为25 ℃,每15 h取样测定花色苷含量。计算不同入射光波长范围对花色苷稳定性的影响。
1.2.2.3 溶氧量对紫米花色苷稳定性的影响 向内径为240 mm的透明干燥器底部放入25包TL-50型脱氧剂,将花色苷溶液置于干燥器的瓷板上,盖上干燥器盖子密封保存3 d,获得低溶氧量的花色苷溶液处理组(溶氧量为0.2 mg/L);以正常溶氧量组(同样的透明干燥器,但不放入脱氧剂,花色苷溶液溶氧量为7.2 mg/L)为对照。于室内自然光照和完全避光条件下放置60 d,每10 d取样测定花色苷含量,计算溶氧量对花色苷稳定性的影响。
1.2.3 辅助添加物对紫米花色苷稳定性的影响
1.2.3.1 金属离子对紫米花色苷稳定性的影响 分别配制含10 mmol/L 不同金属离子(Al3+、Cu2+、Fe2+、Fe3+、Zn2+、Mg2+、K+、Na+、Ca2+)的花色苷溶液,放置室内(室内自然光照,室温25 ℃,下同)观察溶液的颜色变化与沉淀产生情况。
选择其中对花色苷有保护作用的金属离子(Zn2+、Mg2+、K+、Na+、Ca2+),分别配制含不同浓度梯度金属离子的花色苷溶液,放置室内60 d,每10 d取样测定花色苷含量,计算金属离子及浓度对紫米花色苷稳定性的影响。
1.2.3.2 辅色素对紫米花色苷稳定性的影响 向花色苷溶液中加入摩尔比(花色苷∶辅色素)为1∶10的6种(香草醛、丁香醛、绿原酸、没食子酸、咖啡酸、阿魏酸)辅色素。室内自然光照,室温25 ℃放置,测定第60天花色苷的含量,计算辅色素对紫米花色苷稳定性的影响。挑选出对紫米花色苷保护作用最佳的辅色素,加入不同摩尔比(1∶0.0、1∶2.5、1∶5、1∶10、1∶20)的辅色素,放置室内60 d,每10 d取样测定花色苷含量,计算不同摩尔比的辅色素对紫米花色苷稳定性的影响。
1.2.4 紫米花色苷的稳定性条件优选 在上述花色苷稳定性单因素试验基础上,选取入射光波长范围、Zn2+浓度、没食子酸的摩尔比及溶氧量为变量,把样品置于光辐照度为25 mW/cm2的氙灯下照射45 h,控制腔体温度为25 ℃,进行L9(34)的正交试验,优选保持紫米花色苷稳定性的条件。具体因素及水平见表1。
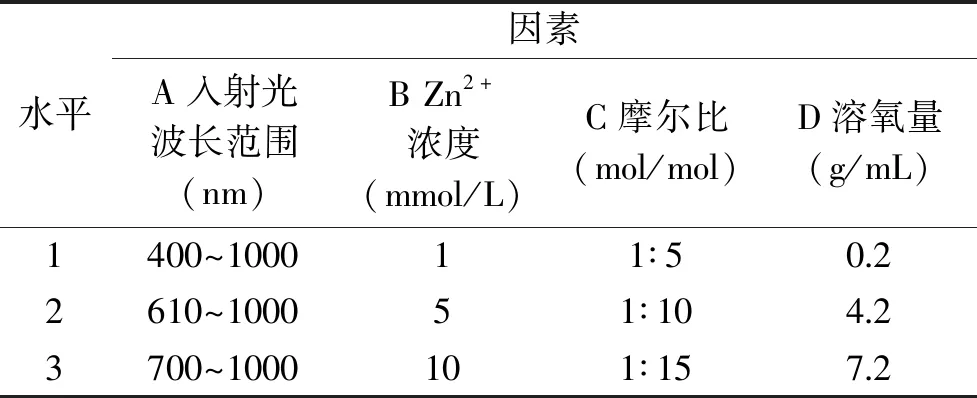
表1 紫米花色苷稳定性试验正交因素与水平设计Table 1 Orthogonal factors and level design for stability test of anthocyanins
1.2.5 测定与计算方法
1.2.5.1 花色苷含量测定方法 参考赵月等和修茹燕[20-21]的方法并加以改进,花色苷溶液离心(8000 r/min,15 min,25 ℃),取0.5 mL的上清液用pH1.0 HCl-KCl缓冲液定容至10 mL,静置15 min,在535 nm下测定吸光值A。
1.2.5.2 花色苷保存率与降解率计算方法 花色苷的保存率:
式中:At-处理时间为t时的吸光值;A0-初始的吸光值。
花色苷降解率:p(%)=1-s
1.2.5.3 不同波长范围的光对花色苷稳定性影响的计算方法 不同种类可见光的花色苷降解率:
Pa~b(%)=pa~1000-pb-1000
不同种类可见光的单位波段花色苷降解率:
紫外滤光片的透过率修正系数:
紫外光的单位波段花色苷降解率:
式中:p-波长范围内的花色苷总降解率%;a、b-透过相应滤光片的入射光起始值;单位波段-指每10 nm的光;P-单位波段光的花色苷降解率%;T为滤光片的光透过率%。
1.3 数据处理
采用SPSS 20.0对数据进行统计分析,采用Origin 8.6作图,所有实验进行3次重复,结果以平均值±标准差表示。
2 结果与分析
2.1 贮藏环境中光与氧气对紫米花色苷稳定性的影响
2.1.1 光辐照度对花色苷稳定性的影响 不同季节及一天中不同时段的光辐照度差别极大。以广州为例,7月份的太阳总辐射为460 MJ/m2,而2月份的太阳总辐射只有220 MJ/m2[22]。本研究于2019年10月20日对广州室外光辐照度进行测量,发现正午12点的光辐照度为50 mW/cm2,而傍晚6点只有1 mW/cm2,相差50倍,显示利用自然光连续开展光对花色苷稳定性影响实验具有一定的局限性。因此利用图1的装置,在模拟太阳光光谱条件下,研究光辐照度对花色苷稳定性的影响。经过30 h不同光辐照度处理,结果如图2所示,花色苷的保存率随着光辐照度的增强急速下降,二者呈负量效关系,决定系数为0.9859。光辐照度70 mW/cm2时,经过30 h的照射,花色苷的保存率只有49.60%。究其原因,光照会使基态的花色苷吸收光能后转变为激发态的花色苷,激发态的花色苷在C4位易发生水解后转变为C4加成化合物,随后该加成物的C2位发生水解开环形成中间产物,该中间产物继续降解生成酚酸和醛类[12]。光辐照度越大,其光能越强,对花色苷的稳定性破坏越大,因此,紫米花色苷溶液贮藏不宜暴露在强光中。已有报道也表明,在多种含花色苷的体系里,花色苷在黑暗的环境中的半衰期会比在光照中的要长[23-25]。但另一方面,在进行花色苷的破坏性加速实验时,利用强光处理来缩短实验时间,是一种高效简便的方法。
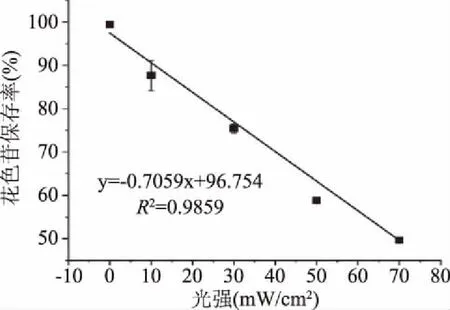
图2 光辐照度对紫米花色苷稳定性的影响Fig.2 Effect of light irradiance on the stability of anthocyanins
2.1.2 入射光波长范围对紫米花色苷稳定性的影响 经测试所得,图3为供试的各型号滤光片的透过率光谱,ZWB1在280~370 nm之间的平均透过率达81%,其余型号的滤光片在其透光范围的平均透过率达90%。从图4可看出,样品以完全避光环境为对照,经过不同波长范围的光照射后,花色苷的保存率均下降,紫外光和不同波长范围可见光都对花色苷有不同程度的破坏作用。处理75 h后,完全避光处理对照组的花色苷保存率最高,为82.46%,紫外光处理组(280~370 nm)的保存率为79.07%。经由波长范围为400~1000 nm光照射处理75 h后,花色苷的保存率最低仅有39.86%,经由450~1000、490~1000、610~1000、700~1000 nm波长范围的光处理后保存率分别为43.70%、56.37%、69.46%、74.01%。由此可以得知,入射光的波长范围越大,花色苷破坏越严重,范围越小,花色苷保存率越高。
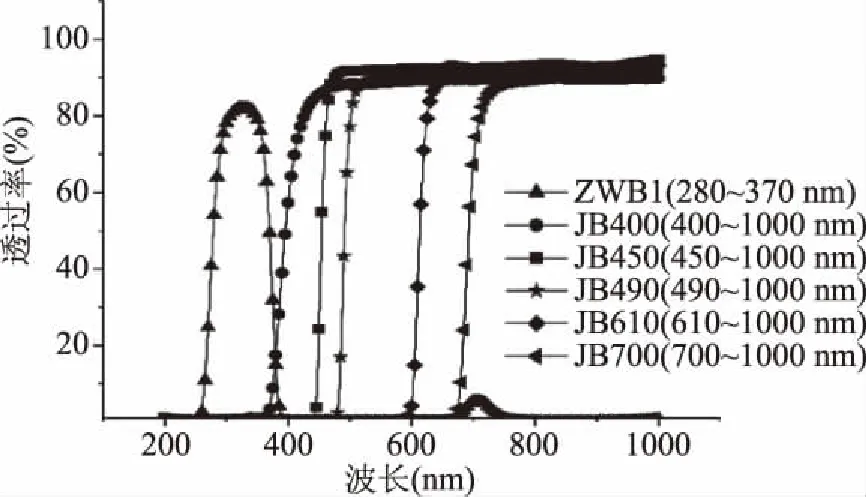
图3 滤光片的透过率光谱Fig.3 Filtering rate spectrum of filter
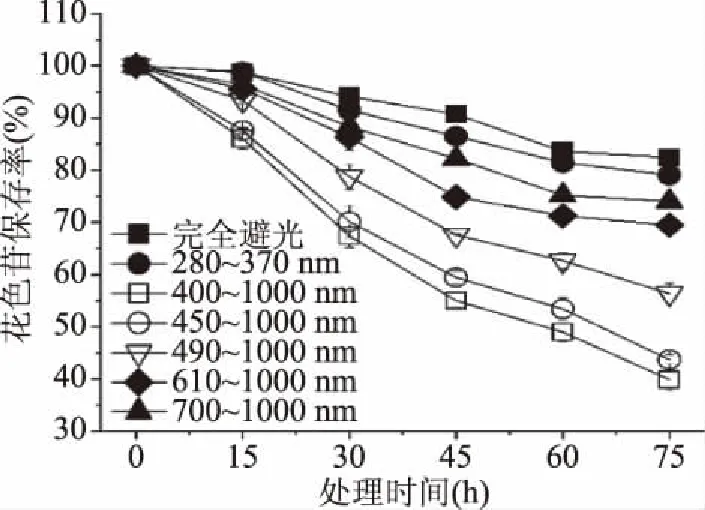
图4 不同波长范围的光对紫米花色苷稳定性的影响Fig.4 Effects of light of different wavelength range on the stability of anthocyanins
2.1.3 溶氧量对紫米花色苷稳定性的影响 花色苷的高度不饱和结构对氧气颇为敏感,在分子氧存在的条件下,花色苷会降解生成无色的或褐色的物质。由图5可以看出,在贮藏期内,正常溶氧量条件下,室内自然光照射处理组花色苷含量下降最快,60 d后,花色苷保存率只有36.58%,其次为正常溶氧量条件下,完全避光处理组,花色苷保存率为47.01%,而在低溶氧量条件下,室内自然光照射和完全避光处理组的花色苷含量下降速度均较慢,下降曲线几乎贴合,60天后,前者花色苷保存率为73.24%,后者为74.75%,二者差异并不显著。

图5 溶氧量与室内光对紫米花色苷稳定性的影响Fig.5 Effects of dissolved oxygen and indoor light on the stability of anthocyanins
室内的自然光照,经测定光强约为(0.15±0.05) mW/cm2,在较弱的光照条件下,溶氧量才是影响花色苷稳定性的主要因素,低溶氧量可以显著(P<0.05)提高花色苷的保存率。而室内自然光的影响只在较高溶氧量下才发挥显著作用,光对花色苷的破坏主要表现为激发氧对花色苷的破坏。已有的报道也表明,真空处理有利于蓝莓皮渣花色苷的保存[17],通氮气除氧可以提高桔柚果皮花色苷稳定性[18]。食品的加工、贮运及销售通常在室内自然光照条件下进行,由此可以推断,控制溶液中的溶氧量对花色苷的保护起关键的作用。在富含花色苷的产品生产、贮藏过程中,通过真空处理、通氮、使用脱氧剂等方法来去除产品中的氧,能够显著提高花色苷的保存率。
2.2 辅助添加物对紫米花色苷稳定性的影响
2.2.1 金属离子对紫米花色苷稳定性的影响 金属离子对花色苷稳定性表现出多样性。由表2可以看出,Al3+、Cu2+、Fe2+、Fe3+对维持紫米花色苷的稳定不利,会改变其溶液的颜色或产生大量沉淀物、絮状物,因此在富含花色苷产品的加工或贮藏过程中,应避免与Al3+、Cu2+、Fe2+、Fe3+接触。但Zn2+、Mg2+、K+、Na+、Ca2+离子则有维持花色苷稳定的作用。进一步研究Zn2+、Mg2+、K+、Na+、Ca2+浓度对花色苷保存率影响,如表3所示,添加该5种金属离子的花色苷保存率均比空白组要高,随着其浓度的不同展现不同的变化趋势。其中Zn2+对提高紫米花色苷的保存率最为有效,添加了5 mmol/L的Zn2+的花色苷比空白组保存率高14.27%。究其原因,可能是紫米花色苷的B环上含有邻位羟基与Zn2+发生络合反应[26],提高了花色苷的稳定性。

表2 不同金属离子对紫米花色苷稳定性的影响Table 2 Effects of different metal ions on the stability of anthocyanins

表3 金属离子浓度对紫米花色苷稳定性的影响Table 3 Effect of metal ion concentration on the stability of anthocyanins
2.2.2 辅色素对紫米花色苷稳定性的影响 辅色素是一类能与花色苷发生辅助成色作用的无色或颜色很浅(主要是浅黄色)的物质,能够在酸性溶液中增加和修饰花色苷颜色的表现,目前研究比较多的辅色素是类黄酮和酚酸[27-28]。由图6可以看出,添加香草醛、丁香醛、绿原酸、没食子酸、咖啡酸、阿魏酸6种物质为辅色素,在浓度相同,即摩尔比同样为1∶10的条件下,其花色苷保存率分别为53.61%、50.56%、59.01%、59.40%、50.03%、49.52%。空白对照组花色苷保存率为51.54%,丁香醛、咖啡酸、阿魏酸对紫米花色苷未表现出明显保护作用。而香草醛、绿原酸和没食子酸的花色苷保存率与空白对照差异显著(P<0.05),尤其是后二者保护效果更佳。因绿原酸价格昂贵,且其水溶液有刺激性气味,而没食子酸价格便宜、安全、无不良气味,在浓度高于850 mg/100 mL时才会产生柔和的酸感[29],低浓度的没食子酸不会对食品原有的风味产生影响。因此,添加没食子酸作为辅色素更适用于保护食品中的花色苷。
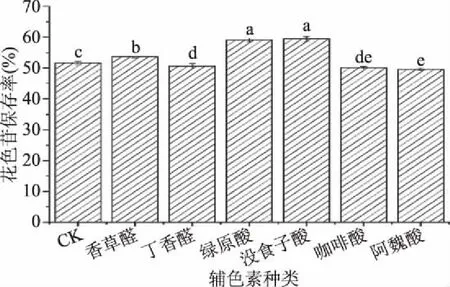
图6 辅色素种类对紫米花色苷稳定性的影响Fig.6 Effects of co-pigments on the stability of anthocyanins注:不同小写字母代表显著差异,P<0.05;图7~图8同。
探究没食子酸浓度对紫米花色苷稳定性影响,结果如图7,可以看出,花色苷保存率存在差异,摩尔比在1∶2.5~1∶10.0之间,效果较好,具有很好的辅色作用,这与Roidoung等[30]研究没食子酸对红莓汁花色苷有保护作用的结论相一致,没食子酸通过提供酚羟基中的H原子来清除自由基,使自由基的活性降低,从而限制了自由基与花色苷的相互作用。
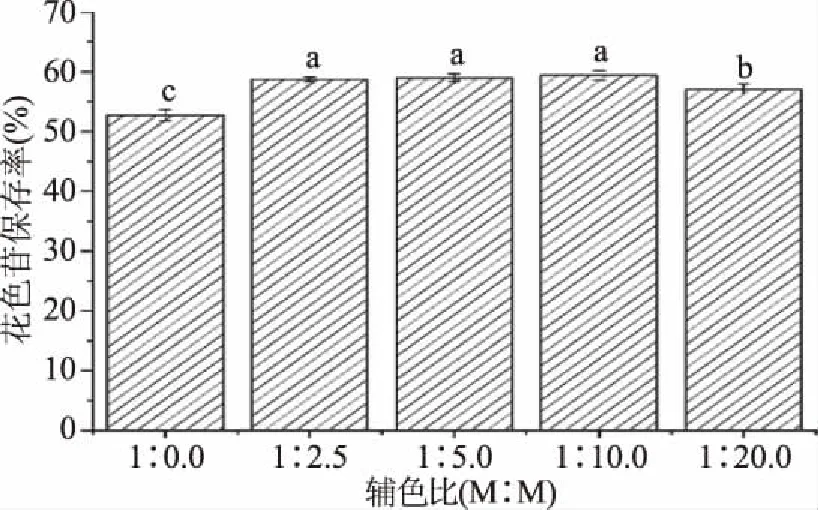
图7 没食子酸的浓度对紫米花色苷稳定性的影响Fig.7 Effect of gallic acid concentration on the stability of anthocyanins
2.3 紫米花色苷的稳定性条件优选结果分析
选取上述影响紫米花色苷稳定性的四种因素:入射光波长范围、Zn2+浓度、没食子酸摩尔比、溶氧量,进行L9(34)正交试验,正交试验结果与方差分析结果见表4及表5。由表4可知,四种因素的影响大小依次为A>D>B>C,即入射光波长范围>溶氧量>Zn2+浓度>没食子酸摩尔比。由表5可知入射光波长范围、Zn2+浓度、溶氧量对花色苷的稳定性的影响均极显著(P<0.01),在正交试验选取的水平范围内没食子酸的摩尔比影响不显著(可任选添加水平)。
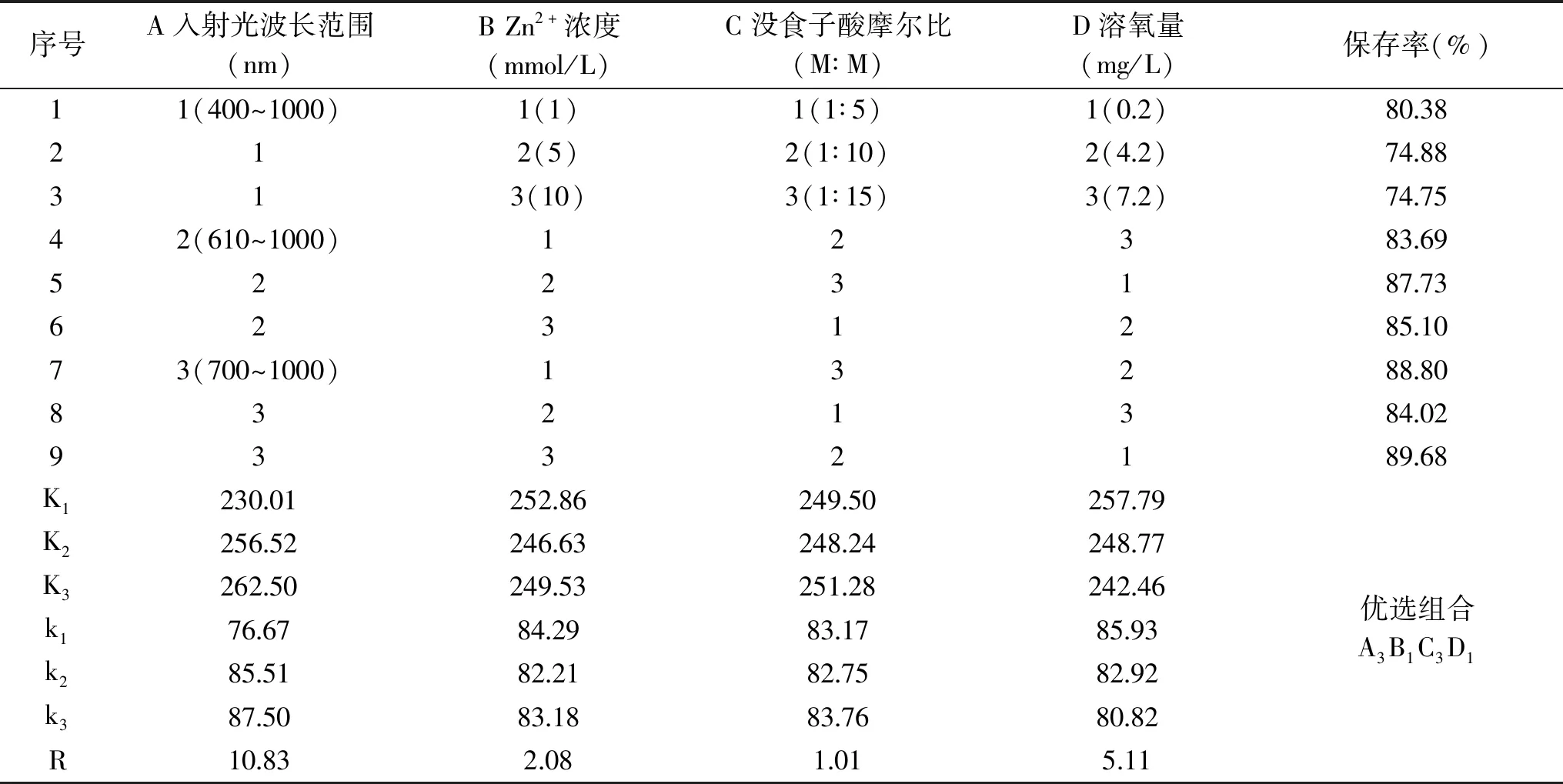
表4 紫米花色苷保护工艺的正交实验结果Table 4 Orthogonal experimental results of anthocyanins protection process

表5 紫米花色苷保护工艺的正交试验方差分析结果Table 5 Orthogonal experimental anova results of anthocyanins protection process
由K值可得最优组合为A3B1C3D1,即入射光波长范围700~1000 nm,添加1 mmol/L的Zn2+,摩尔比为1∶15的没食子酸,控制溶氧量为0.2 mg/L。因该优选组合不在表4的处理组中,进行三次平行验证实验,显示在此工艺条件下,紫米花色苷的保存率可达到91.12%±0.25%,与正交试验的较优组相比差异显著(P<0.05),而对照组只有70.95%±0.01%。优选组比对照组提高了28.43%。
2.4 不同种类光单位波段对紫米花色苷稳定性影响分析
因不同种类的光所覆盖的波长范围不同,通过对2.1.2中不同波长范围光对花色苷稳定性的影响结果进行进一步的计算,分析不同种类光单位波段(每10 nm)对花色苷的影响,计算方法见1.2.2.3。不同种类光280~370 nm(紫外光)、400~450 nm(紫光)、450~490 nm(蓝光)、490~610 nm(主要表现为绿光)、610~700 nm(主要表现为红光)单位波段对花色苷保存率的影响,如图8所示,单色光中蓝光的每单位波段对紫米花色苷造成3.17%降解率,紫外光、绿光、紫光、红光依次为1.14%、1.09%、0.94%、0.51%,单位波段的蓝光对花色苷的降解作用最强,处理间差异显著(P<0.05),红光最弱。在不采用完全避光包装,考虑选用可透视的透明包装时,尽量选取不透过蓝光(450~490 nm)的包装材料,而以选用透过红光的材料为宜。

图8 不同种类的光单位波段对紫米花色苷降解率的影响Fig.8 Effect of different light unit bands on the degradation rate of anthocyanins
3 结论
通过分析储藏环境与辅助添加物对紫米花色苷的稳定性影响可得,光辐照度与花色苷保存率呈负量效关系。利用强光照射进行破坏性加速实验是研究花色苷稳定性的高效简便方法。太阳光中的紫外光和可见光都对紫米花色苷有破坏作用,可见光波长范围越大,其破坏性越大,单色光中蓝光对花色苷的破坏最强,单位波段(每10 nm)破坏率达3.17%,是红光的6倍,其他光的3倍,差异显著(P<0.05)。使用只透过610~700 nm的红色半透明材料包装富含紫米花色苷的产品,不仅可以保持商品外观的可透视性,还可兼顾花色苷在强光下的高保存率。在室内光照射条件下,氧气是影响花色苷稳定性的主要因素。正常溶氧量的花色苷60 d后保存率为36.58%,脱氧处理后花色苷保存率为73.24%,保存率是前者的2倍,所以降低产品中的氧气含量,是保护花色苷稳定的关键。辅助添加物中,Zn2+和没食子酸的护色效果较佳。本研究优选出维持紫米花色苷稳定性的工艺参数:入射光波长范围控制在700~1000 nm,控制溶氧量降低到0.2 mg/L,添加1 mmol/L的Zn2+及摩尔比为1∶15的没食子酸,为紫米花色苷的包装与贮藏提供一种方法。本研究使用脱氧的方法进行贮藏,可能导致厌氧菌的生长,所以如何避免厌氧菌的滋生仍需要进一步研究完善。

