腈水合酶区域选择性与对映选择性的研究进展
沈瑞华 程中一
(1.江苏昌九农科化工有限公司,江苏 南通 226413;2.江南大学生物工程学院,江苏 无锡 214122)
腈类化合物在自然界中分布广泛,通常以氰苷化合物、氰基酯类化合物以及扁桃腈类化合物等形式存在于植物及昆虫体内。此外,人工合成的腈类化合物在医药及农业等领域也发挥着重要的作用。然而,腈类化合物具有致畸致突变性,且对环境有一定的危害[1,2]。
自然界代谢腈类物质主要通过三种酶进行:腈水解酶(EC 3.5.5.1和3.5.5.7,nitrilase)、腈水合酶(EC 4.2.1.84,nitrile hydratase,NHase)和酰胺酶(EC 3.5.1.4,amidase)。腈水解酶可将腈类物质一步催化生成相对应的羧酸,而NHase可将腈类物质催化生成对应的酰胺类化合物,随后在酰胺酶的作用下,进一步生成对应的羧酸[3](图1)。
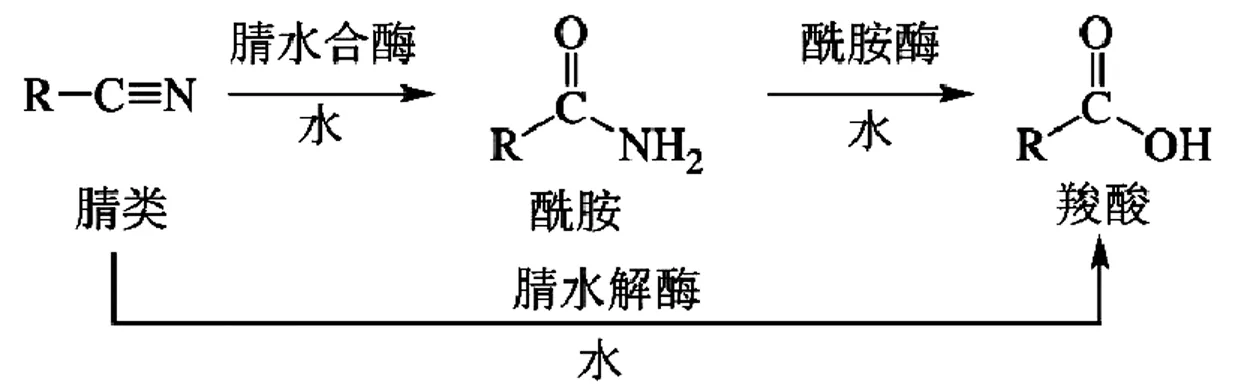
图1 腈类代谢的主要途径
1 NHase概述
酰胺类化合物可作为重要的有机合成中间体,在医药及农业领域有着广泛的应用价值。NHase是一类能够水化腈类化合物中氰基合成对应酰胺的金属酶,按照活性中心结合的金属离子不同可分为铁型NHase(Fe-NHase)和钴型NHase(Co-NHase),NHase内的金属离子和活性中心高度保守的[-半胱氨酸(Cys)-半胱氨酸(Cys)-丝氨酸(Ser)-半胱氨酸(Cys)-]氨基酸基序构成活性中心的爪状结构[4]。NHase的来源广泛,目前已发现的NHase主要来源于原核生物[5,6]。NHase含有α和β两种亚基,一般以四聚体形式存在,原核生物来源的NHase中α和β两种亚基以亚基分开的形式表达,2008年Foerstner等首次从真核生物领鞭毛虫(Monosiga brevicollis)中发现亚基融合型的NHase,即α和β两种亚基以单条肽链的形式表达[7](图2)。
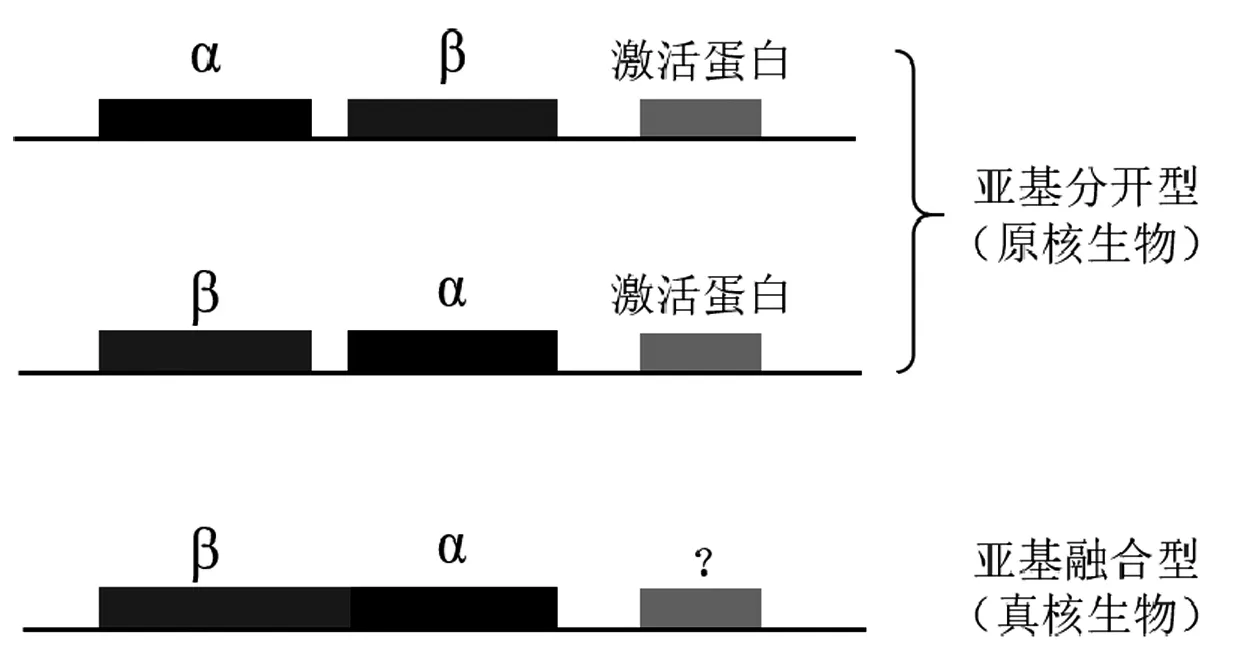
图2 NHase基因型
由于生物催化剂通常具有反应条件温和,催化效率高,工艺环保等优势,因此利用NHase生产酰胺类产品已逐渐取代传统的化学合成法。Yamada等利用Rhodococcus sp.N-774,Pseudomonas chlororaphis B23以及Rhodococcus.rhodochrous J1来源的三代NHase成功地实现了丙烯酰胺的工业化生产[8]。到目前为止,第三代工业菌株R.rhodochrous J1在丙烯酰胺的生产中已经占据了主导地位。国内沈寅初、郑裕国团队以及沈忠耀团队亦开发并优化了多种基于NHase的丙烯酰胺生产菌株,极大推动了我国NHase的产业化[9,10]。
NHase在国内主要用于烟酰胺及丙烯酰胺的生产。烟酰胺属于B族维生素,在医药领域中用来预防糙皮病,也用来作为食品和饲料添加剂,近年来亦作为护肤品原料广泛应用在美容行业。丙烯酰胺是一种重要的大宗化学品,在石油开采、污水处理及制浆造纸等领域发挥着重要作用。然而,NHase在工业生产过程中存在着稳定性较差的问题,例如,来源于Pseudomonas chlororaphils B23、R.rhodochrous J1以及Rhodococcus sp.N-774的NHase仅在20 ℃以下保持较高的酶活性[11-13]。
对于大多数工业酶,反应速度往往随着催化温度增加而显着提高,但是酶在较高温度下会因构象变化逐渐失活[14]。NHase在工业应用过程中热稳定性不高,而腈类的水合过程属于放热反应,所以在工业催化过程中,需要对反应釜进行冷却降温,能耗较大;此外,NHase的不稳定还体现在对高浓度腈类底物和酰胺类产物耐受性差,这往往导致NHase失活,从而使得产物丙烯酰胺浓度只能维持较低的水平,给后续的丙烯酰胺浓缩工艺带来影响。随着市场的不断拓展,酰胺类化合物的需求也日益剧增,因此如何提高NHase的热稳定性及产物耐受性已成为研究重点[15]。
获得高稳定性NHase的方法主要有筛选自然界中天然存在的高稳定性NHase和改造现有的NHase。挖掘新酶具有重要意义,不仅有可能筛选出耐高温耐有机溶剂的新型NHase,还能为研究者们改造现有NHase提供新的方向。挖掘嗜热微生物来源的NHase以及对NHase进行体外定向进化同样能够筛选稳定性提升的突变体,以实现工业菌株的更新换代。近年来,多种分子改造策略已被用于提高NHase的稳定性,例如增设盐桥[16]、降低自由能[17]、同源片段交换[18]、基因融合[19]等(图3)。这些策略为工业用酶的应用研究提供理论依据。

图3 NHase热稳定性改造方法
2 NHase的区域选择性
与传统的化学催化剂相比,NHase在催化腈类底物时展现出一定的区域选择性[20]。NHase对于腈类底物的区域选择性目前主要体现在催化二腈类底物上,即NHase能选择性地水合二腈底物中的一个氰基,使其转化成氰基单酰胺,亦或先后将二腈类底物中的两个氰基全部水合,生成二酰胺终产物[21-23](图4)。
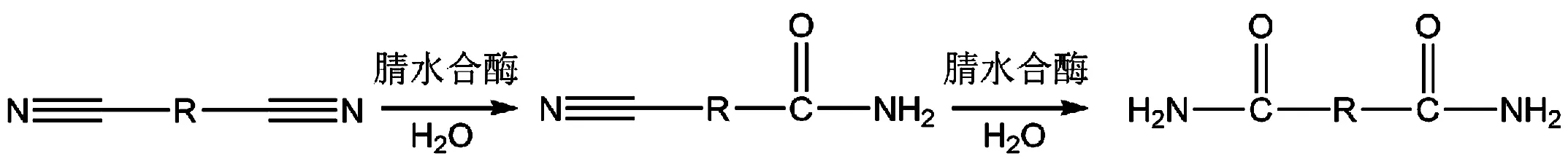
图4 NHase的区域选择性
NHase区域选择性催化二腈类底物最具代表性的例子为水化己二腈生产5-氰基戊酰胺或己二酰胺[24,25]。5-氰基戊酰胺可以作为农药唑啉酮类除草剂的生产前体,也可以用于合成己内酰胺;己二酰胺则可以作为多种药物的合成砌块[26]。Shen等研究发现赤红球菌Rhodococcus.ruber CGMCC3090来源的NHase能够催化己二腈生成5-氰基戊酰胺,区域选择性达到99%,而来源于睾丸酮丛毛单胞菌Comamonas.testosteroni 5-MGAM-4D的NHase能够将己二腈完全转化为己二酰胺终产物[27]。此外,有研究已经报道了分离自嗜酸红球菌Rhodococcus.aetherivorans ZJB1208的NHase能够催化1-氰基环己基乙腈生成1-氰基环己基乙酰胺,产物得率(产物质量/催化剂用量)达到204.2[28]。
近年来,研究人员虽然已经分离出了一些含有区域选择性NHase的菌株(表1),但对于NHase展现出区域选择性的原因还未有定论,且通过蛋白质工程手段改造NHase对于二腈类底物区域选择性的研究也较少。最近,Cheng等通过序列比对方式,发现来源于睾丸酮丛毛单胞菌C.testosteroni 5-MGAM-4D的NHase与来源于恶臭假单胞菌Pseudomonas.Putida NRRL-18668的NHase具有95%以上的序列相似度,但两者对于二腈类底物的区域选择性完全不同。通过同源建模、底物通道计算等计算机技术的辅助,研究人员发现了位于NHase底物通道上的βPhe37关键氨基酸残基,该位点可以作为“开关”调控NHase的区域选择性。在该位点进行定点突变可以翻转该酶对于脂肪族二腈类底物的区域选择性[29]。除此之外,Cheng等通过分子对接与分子动力学模拟,定位了NHase底物结合口袋中潜在影响NHase区域选择性的关键氨基酸残基,并基于迭代饱和突变,筛选到βY68T/W72Y优势突变体,该突变体较野生型NHase展现出完全相反的区域选择性[30]。这些发现阐明了NHase底物通道及底物结合口袋构成氨基酸对于NHase催化二腈类底物区域选择性的关键作用,可以为今后改造NHase催化其他含有两个以上腈基的腈类底物的区域选择性提供一定的理论依据。

表1 近五年报道的具有区域选择性的NHase
3 NHase的对映选择性
近些年,利用酶分子进行不对称催化已经成为有机合成领域的热门研究方向之一。手性酰胺类产品广泛存在于天然产物、药物和各种生物活性化合物中,如抗细胞增殖剂、抗生素头孢孟多和缓激肽拮抗剂药物等,在抑制肿瘤发展、治疗细菌感染及抗过敏等方面有着广泛的应用价值[31-33]。此外,手性酰胺可以作为重要的有机合成砌块制备结构多样的药理活性分子,如具有抗休克及强心作用的氨基醇衍生物、具有杀菌作用的烷氧基酰胺及氨基酸衍生物等[34]。基于手性酰胺在制药等领域的巨大工业价值,研究人员对手性酰胺不对称合成的方法学进行了较为深入的研究,开发出了多种制备方法,主要分为化学合成法与生物催化法。然而,化学合成法的反应条件往往较为苛刻,且存在对映选择性差、催化活性低和底物谱窄等缺点。相较于化学合成法,生物催化法具有反应条件温和及副产物少等优势。NHase能够催化腈类化合物水合生成相应的酰胺类化合物,在不对称合成手性酰胺方面有着较大的应用潜力。
近年来,一些NHase在合成酰胺类化合物过程中,展现出一定的对映选择性。具有对映选择性的NHase主要分布在农杆菌属(Agrobacterium)、莫拉氏菌属(Moraxella)、沙雷菌属(Serratia)、红球菌属(Rhodococcus)及假单胞菌属(Pseudomonas)中[5]。Fallon等发现来源于恶臭假单胞菌Pseudomonas putida 5B的NHase能够催化α-异丙基对氯苯基乙腈生成对应的S型酰胺产物,对映体过量值(ee值)达到90%以上[35]。国内王梅祥课题组发现来源于红球菌Rhodococcus sp.AJ270的NHase能够选择性地催化α-取代苯乙腈类底物生成对应的手性酰胺类产物[36]。此外,Pawar等将来源于玫瑰色红球菌R.rhodochrous ATCC BAA-870的NHase和聚乙烯醇/壳聚糖-戊二醛相交联,得到的固定化NHase对于(R)-扁桃腈的对映体过量值(ee值)达到了81%[37]。国内杨立荣课题组发现来源于产酸克雷伯菌Klebsiella oxytoca KCTC 1686的NHase能催化扁桃腈不对称合成(S)-扁桃酰胺,对映体比率(E值)为14[38]。还有一些其他来源的NHase对于不同的外消旋腈类底物也显示出了不同的对映选择性或立体选择性[39]。值得注意的是,现有关NHase对映选择性的研究主要集中于筛选含有对映选择性NHase的菌株上,鲜有文献报道通过蛋白质工程手段改造NHase的对映选择性。
酶分子的对映选择性是由底物结合、反应能垒等各因素共同作用的结果,而酶的底物结合口袋及底物通道的构象对于底物结合及反应能垒有着重要影响。酶的底物结合口袋往往具有一种特定的构象,使得酶分子催化的反应偏好生成一种特定的产物对映体,而酶的底物通道通常在底物与酶分子的结合过程中发挥重要作用,影响底物在结合口袋中的空间取向,进而使酶分子具有一定的对映选择性。通过一定的酶分子改造手段,在底物结合口袋或底物通道引入突变,往往能够实现酶分子对映选择性的调控,使酶分子优先形成所需的对映体,甚至实现对映选择性的逆转[40]。因此,选用高效可靠的酶分子改造手段重构酶底物结合口袋及底物通道构象,对于提升酶不对称催化的性能、解析酶的对映选择性机制具有重要意义。
最近,Cheng等报道了一种用于改造NHase对映选择性的半理性设计方法。通过将分子对接、底物通道计算和拉伸分子动力学模拟相结合,研究人员成功定位到来源于R.rhodochrous J1的L-NHase中的βPhe37氨基酸残基,对该位点进行定点饱和突变后,该酶不对称合成(S)-扁桃酰胺的ee值从52.6%提升至96.8%。在此基础上,综合计算机辅助分析,研究人员发现具有不同手性的对映体在通过NHase底物通道过程中所受的空位阻碍不同,从而进一步影响了配体在底物结合口袋中的最终取向[41]。这些发现对于指导基于半理性设计的酶分子改造有一定的理论意义。
4 结语
经过研究人员多年的努力,目前已有多种来源的NHase被成功分离并进行酶学性质的表征。同时,亦有多种NHase经过蛋白质工程的改造在稳定性及活性等方面有了质的提升。NHase的应用已经不再限于传统的大宗化学品合成领域,未来该酶在精细化学品、农药及高附加值药品等领域的应用将把NHase的发展推入新的纪元。在这一过程中,NHase仍有面临底物谱不宽泛、稳定性低等问题,但随着蛋白质工程及生物信息学等技术的发展,NHase这一绿色催化剂将在生物化工领域继续发光。

