药(食)真菌发酵豆渣的主要功能物质及生物活性变化
吴永祥,吴丽萍,朴银美,金泰完*
1(黄山学院 生命与环境科学学院,安徽 黄山,245041) 2(安东国立大学 食品科学与生物技术学院,庆尚北道 安东,760749)
豆浆、豆干、豆腐等大豆食品深受人们喜爱,然而在大豆食品加工过程中,会产生大量的豆渣副产物,目前我国每年约产生2 000多万吨湿豆渣[1]。经研究分析,豆渣具有较高的营养价值,富含膳食纤维、蛋白质、维生素、微量元素、多糖、异黄酮和总酚等生物活性物质[2-3]。现代研究表明,食用豆渣能显著降低血液中胆固醇的含量,改善2型糖尿病患者的胰岛素敏感性,并具有预防高血压、肠癌等功效[4-5]。目前,豆渣被越来越多的国家作为新的保健食品原料,然而我国豆渣由于缺乏经济易行的加工方法,限制其在食品加工中的应用,大部分只作为废渣或饲料处理,造成了生态环境的污染及资源的极大浪费[6]。
微生物发酵技术经济易行,可提高食品的营养和风味,一直被广泛应用于食品的生产和加工过程中。近年来,研究者以豆渣为基质,接种不同菌种进行了微生物发酵的诸多研究:李艳芳等[7]利用黑曲霉和米曲霉发酵豆渣,降低了豆渣粒度分布进而改善其口感、增加可食性;王慧等[8]用根霉、毛霉和米曲霉菌对豆渣进行发酵,豆渣中蛋白酶活力和淀粉酶活力较发酵前显著增加,豆渣营养价值得到明显提高;VONG等[9]利用解脂耶氏酵母发酵豆渣,不溶性膳食纤维降低了33%,游离氨基酸提高了254%,游离酚酸提高了197%,豆渣的营养价值及风味得到改善;朱运平等[10]以枯草芽孢杆菌、纳豆杆菌和少孢根霉为菌种发酵豆渣,提高了豆渣中蛋白质含量,显著增强豆渣ABTS阳离子自由基与DPPH自由基的清除能力;LI等[11]以羊肚菌为发酵菌种对豆渣进行固体发酵,发酵后豆渣多糖具有显著的抗癌与免疫调节作用。由此可见,微生物在豆渣发酵过程中产生的高活性酶系和功效成分,有利于改善口感、提高营养价值,增强发酵后豆渣的生物活性。云芝、灵芝和杏鲍菇等作为一类药(食)用真菌,对人体多种疾病有预防和一定程度的治疗作用[12]。目前缺乏药(食)真菌对豆渣进行固体发酵的深入研究。本实验以豆渣为原料,筛选出豆渣固体发酵的优势药(食)真菌,分析云芝、灵芝和杏鲍菇发酵前后豆渣中主要生物活性物质含量的变化,并对其体外抗氧化、α-葡萄糖苷酶抑制活性进行评价,以期为豆渣的品质改良提供技术依据,并作为一个例证,为药(食)真菌固体发酵在食品加工中应用提供了一个思路。
1 材料与方法
1.1 材料与试剂
新鲜豆渣,热加工豆浆后的剩余物,样品含水率为72.17%。10种药(食)真菌,韩国微生物培养中心(Korea Culture Center of Microorganisms,KCCM)。α-葡萄糖苷酶、阿卡波糖、DPPH、牛血清白蛋白、ABTS等,美国sigma公司;总膳食纤维检测试剂盒,爱尔兰Megazyme公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、麦芽浸出液琼脂(Malt)培养基、酵母麦芽糖(yeast malt,YM)培养基、酵母粉、蛋白胨等,美国 BD Difco 公司。
1.2 主要仪器与设备
Liflus GX型实验室发酵罐,韩国Biotron公司;CleanVac 8型冷冻干燥机,韩国Hanil公司;Systec V型立式高压灭菌器,德国Systec公司;SpectraMax-190型全波长酶标仪,美国Molecular Devices公司。
1.3 试验方法
1.3.1 菌种活化和菌悬液的制备
将保藏的云芝、灵芝和杏鲍菇等10种发酵菌株分别接种于相应平板培养基上,于24~26 ℃恒温培养箱中培养。待菌种长满平板后,分别用打孔器打取直径为 6 mm的菌苔接种于相应液体培养基中,于最适宜的条件下培养7 d(见表1)。培养后,可见各菌种颗粒大小均匀,培养液澄清透明,并用高速搅拌机在10 000 r/min转速下搅拌10 s,即得到均匀的菌悬液[13-14]。

表1 不同药(食)真菌的培养条件Table 1 Culture conditions of various medicinal andedible fungi
1.3.2 豆渣固体发酵及菌质生长直径的测定
将新鲜豆渣置于121 ℃高压灭菌锅内灭菌15 min。取灭菌后的豆渣于2 L发酵罐中,分别以5%的接种量接种制备好的云芝、灵芝和杏鲍菇等10种药(食)真菌菌悬液。于3、5、7、10、14 d分别测定豆渣固体发酵过程中各菌质的生长直径。设立未发酵豆渣组,即接种等体积灭菌蒸馏水。
1.3.3 固体发酵前后豆渣中酶活力的测定
将云芝、灵芝和杏鲍菇固体发酵完全的豆渣分别冷冻干燥,粉碎过40目筛,得各豆渣粉末。取2.5 g样品,加0.1 mol/L pH 6.0的柠檬酸缓冲溶液50 mL,充分搅拌30 min。在4 ℃、10 000 r/min条件下离心20 min,取上清液,即为粗酶液。淀粉酶活力测定参照二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂法[8],其中淀粉酶活力(U)单位定义为在37 ℃下,每分钟水解生成1 μg葡萄糖所需的酶质量。蛋白酶活力测定参照福林试剂法[6],其中蛋白酶活力(U)单位定义为在40 ℃下,每分钟水解生成1 μg酪氨酸所需的酶质量。纤维素酶活力测定参照羧甲基纤维素(sodium carboxymethyl cellulose,CMC)糖化力法[6],其中纤维素酶活力(U)单位定义为在37 ℃下,每分钟水解生成1 μg葡萄糖所需的酶质量。
1.3.4 膳食纤维含量的测定
总膳食纤维(total dietary fiber,TDF)、可溶性膳食纤维(soluble dietary fiber,SDF)、不溶性膳食纤维(insoluble dietary fiber,IDF)的测定采用Megazyme试剂盒,操作方法参考试剂盒说明书。
1.3.5 豆渣醇提物的制备及提取效率的测定
取发酵前后的豆渣粉末100.0 g,加入体积分数70%乙醇1 000 mL,于180 r/min条件下震荡提取4 h,过滤后收集上清液,剩余残渣在按照上述条件提取2次,合并3次上清液,减压浓缩后冷冻干燥成粉末,即得固体发酵前后的豆渣醇提物。按公式(1)计算各提取物的提取效率:
(1)
式中:Y表示各提取物的提取效率,%;m1为各提取物浓缩干燥后的重量,g;m0为各原料的质量,100.0 g。
1.3.6 豆渣醇提物理化指标的测定
将制备好的各豆渣醇提物,测定理化指标。蛋白质含量的测定采用考马斯亮蓝法[15];游离氨基酸含量的测定采用茚三酮法[16];总糖含量的测定采用苯酚-硫酸法[17];还原糖含量的测定采用DNS法[6];总酚含量的测定采用Folin- Ciocalteu比色法[18]。
1.3.7 豆渣醇提物抗氧化活性的测定
ABTS阳离子自由基清除能力的测定采用文献[19]报道的方法;DPPH自由基清除能力的测定采用文献[20]报道的方法;亚铁离子螯合能力的测定采用文献[21]报道的方法。固体发酵前后豆渣醇提物的抗氧化能力以半数抑制率IC50表示,IC50指的是清除率为50%时,所需要样品的有效质量浓度。
1.3.8 豆渣醇提物α-葡萄糖苷酶抑制活性的测定
参考文献[22]方法并加以改进,向96孔板中加入50 μL不同质量浓度(3.75、7.5、15 mg/mL)固体发酵前后的豆渣醇提物、90 μL 0.1 mol/L磷酸盐缓冲液(pH 6.8)以及10 μL 1 U/mL的α-葡萄糖苷酶溶液,混匀后于37 ℃恒温反应5 min。然后加入50 μL 5 mmol/L对硝基苯酚α-D-吡喃葡萄糖苷溶液,充分混匀后反应20 min后,于酶标仪405 nm处测定吸光值。以1 mg/mL阿卡波糖为阳性对照,每样重复3次,取平均值,并按公式(2)计算α-葡萄糖苷酶活性的抑制率:

(2)
式中:AS为样品组吸光值;ASB为50 μL醇提物与10 μL磷酸盐缓冲液(替代α-葡萄糖苷酶溶液)的样品对照组吸光值;AC为50 μL二甲基亚砜(样品溶剂)与10 μL α-葡萄糖苷酶溶液的空白组吸光值;ACB为50 μL二甲基亚砜与10 μL磷酸盐缓冲液的空白对照组吸光值。
1.4 数据统计与分析
采用Origin 8.5软件作图。应用SPSS 18.0软件进行统计分析,采用单因素方差分析中的Duncan’s多重比较法分析数据间的显著差异,P<0.05表示显著性差异;采用Pearson’s法分析发酵前后豆渣醇提物的总酚物质含量与其抗氧化、α-葡萄糖苷酶抑制活性之间的相关性。
2 结果与分析
2.1 豆渣固体发酵优势菌种的筛选
豆渣经10种药(食)真菌固体发酵后,各菌质的生长变化如表2所示。在生长前期(0~10 d),相比于其他菌种,云芝、灵芝和杏鲍菇的菌丝体生长速度快,随着发酵的进行,菌丝体均呈发散状向四周扩展,菌丝数量逐步增多,逐步形成菌丝束。如图1所示,至第10天时,豆渣表面被各菌丝完全覆盖,颜色洁白,云芝、灵芝和杏鲍菇菌质的生长直径分别达到了(29±1.4)、(30±0.0)、(28±0.3) cm,表明3种药(食)真菌能充分利用豆渣进行固体发酵。在生长后期(10~14 d),云芝、灵芝和杏鲍菇的菌丝数量进一步增加但生长速度减缓,菌丝体洁白浓密,部分菌丝因缺氧导致菌质与发酵壁分离,基内菌丝发生自溶,并伴有水珠产生。从菌种生长状态和发酵周期综合考虑,选定云芝、灵芝和杏鲍菇为优势菌种进行后续试验,确定10 d为最适发酵时间。

表2 发酵过程中不同药(食)真菌菌质的生长直径变化 单位:cm

NF-未发酵组;CV-云芝发酵组;GL-灵芝发酵组;PE-杏鲍菇发酵组(下同)图1 发酵前后豆渣中不同药(食)真菌的生长变化Fig.1 Changes in the growth of native and fermentedokara with various medicinal and edible fungi
2.2 不同菌种发酵前后豆渣中酶活力变化
选用云芝、灵芝和杏鲍菇对豆渣进行固体发酵,比较发酵前后豆渣中的淀粉酶活力、蛋白酶活力和纤维素酶活力,结果见图2。未发酵豆渣中淀粉酶活力较低,仅为3.00 U/g,经云芝、灵芝和杏鲍菇发酵后,淀粉酶活力得到显著增加(P<0.05),分别为(211.80±11.57)、(187.80±12.77)、(180.60±12.25) U/g。相比于未发酵豆渣组,3种药(食)真菌发酵后豆渣中蛋白酶活力、纤维素酶活力得到显著性提高(P<0.05),其中灵芝发酵后豆渣中蛋白酶活力、纤维素酶活力较云芝、杏鲍菇发酵组的高。结果表明,3种药(食)真菌在发酵豆渣过程中能产生高活性的淀粉酶、蛋白酶和纤维素酶,有利于提高发酵后豆渣的营养价值,改善豆渣的功能活性[23-24]。
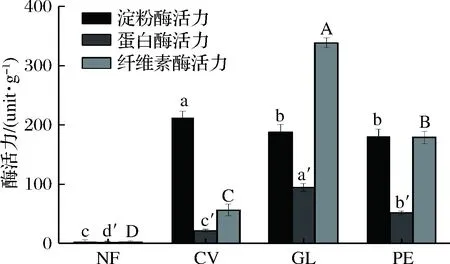
图2 发酵前后豆渣中酶活力变化Fig.2 Changes in enzyme activity of native and fermented okara注:不同字母表示组间差异显著(P<0.05)(下同)
2.3 不同菌种发酵前后豆渣中膳食纤维含量变化
由图3可知,未发酵豆渣中TDF含量很高,占豆渣干质量的76.15%,其中主要成分是IDF,含量为71.32%,而SDF含量相对较低,仅为4.82%。云芝、灵芝和杏鲍菇固体发酵后豆渣中IDF含量显著降低,分别为51.75%、28.53%、42.92%,而SDF含量显著提高(P<0.05)。未发酵豆渣组的IDF/SDF比值为14.79,经云芝、灵芝和杏鲍菇发酵后,IDF/SDF比值分别降低到6.87、4.38、5.01。结果表明,3种药(食)真菌在发酵过程中产生的纤维素酶,能将IDF水解成SDF,造成IDF/SDF值的降低,且IDF/SDF值的变化与纤维素酶活力变化规律基本一致。
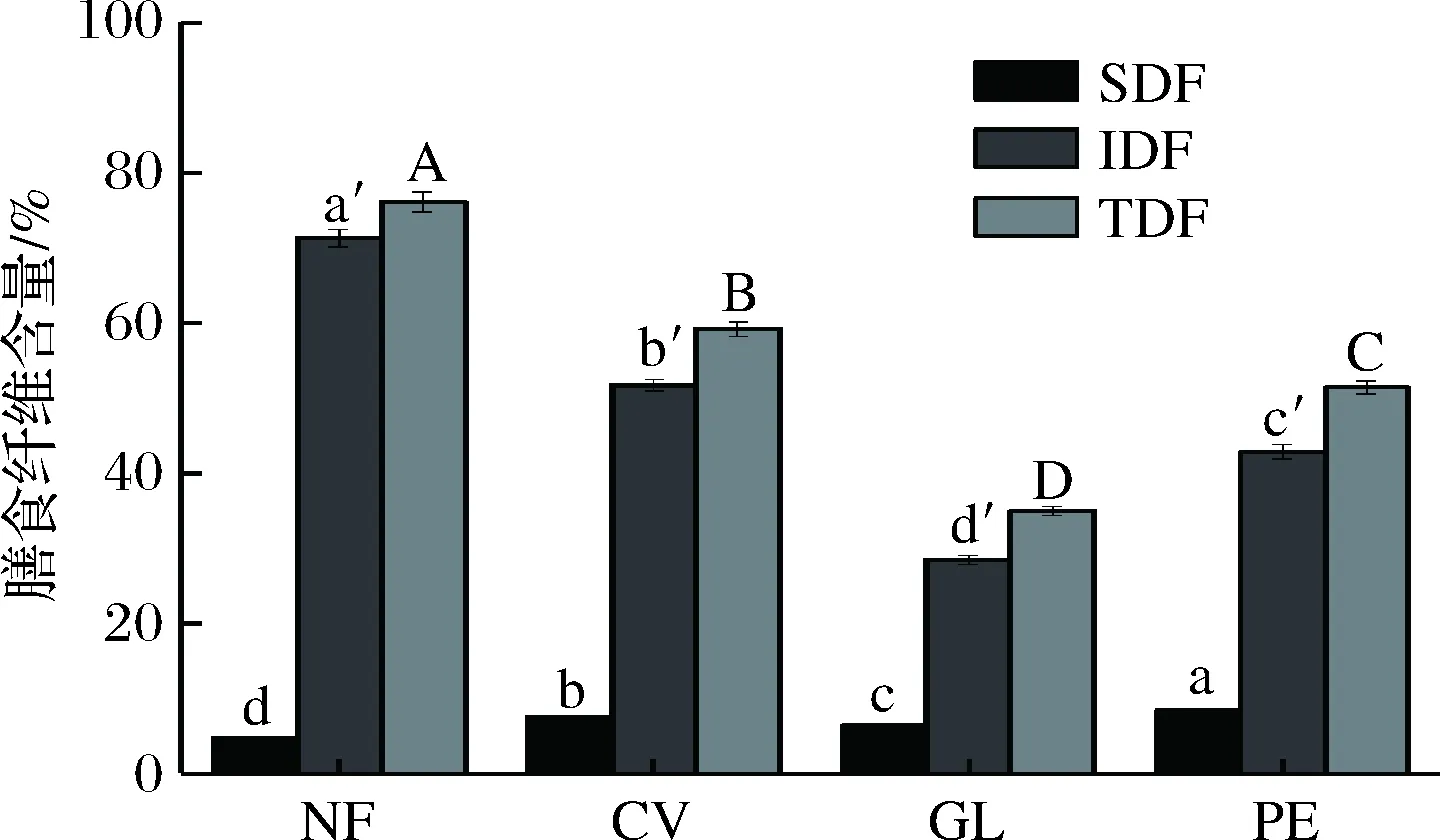
图3 发酵前后豆渣中膳食纤维含量变化Fig.3 Changes in dietary fiber contents of native andfermented okara
2.4 不同菌种发酵前后豆渣醇提物的主要活性物质含量变化
由表3可知,云芝、灵芝和杏鲍菇固体发酵后豆渣醇提物的提取效率显著高于未发酵豆渣(P<0.05),其提取效率分别为12.84%、38.31%、33.27%,而未发酵豆渣的提取效率仅为5.74%。云芝、灵芝和杏鲍菇固体发酵后豆渣醇提物的蛋白质、游离氨基酸、总糖、还原糖、总酚含量较发酵前均显著性增加(P<0.05),其中总酚含量分别达到了(0.42±0.01)、(1.48±0.81)、(0.81±0.02) mg/g,而未发酵豆渣中总酚含量仅为(0.02±0.01) mg/g。灵芝发酵后豆渣的主要活性物质含量较云芝、杏鲍菇发酵组的高(P<0.05)。结果表明,云芝、灵芝和杏鲍菇在豆渣固体发酵过程中产生高活性的淀粉酶、蛋白酶以及纤维素酶等,可将豆渣中的淀粉、蛋白质、纤维素等大分子酶解成还原糖、功能性小肽和氨基酸,并且可以促进豆渣中一些结合状态的生物活性成分的释放[25-26]。发酵后豆渣中蛋白质、游离氨基酸、总糖、总酚等物质含量的变化与ORTS等[27]、申春莉等[28]的研究结果基本一致。
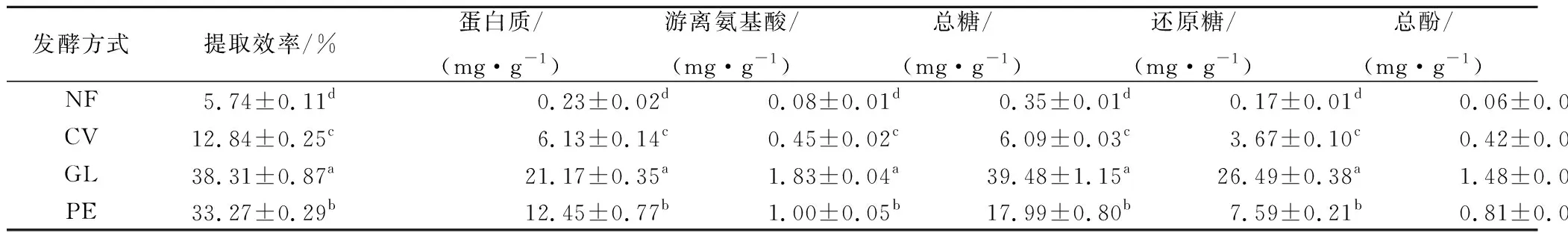
表3 发酵前后豆渣醇提物的提取效率及主要活性物质含量Table 3 Extraction yields and the main active substances contents in native and fermented okara ethanol extracts
2.5 不同菌种发酵对豆渣醇提物抗氧化活性的影响
由表4可知,云芝、灵芝和杏鲍菇固体发酵后豆渣醇提物的DPPH自由基、ABTS阳离子自由基清除能力以及亚铁离子螯合能力较发酵前均显著性提高(P<0.05),其中DPPH自由基清除作用的IC50值分别为(5.66±0.08)、(3.63±0.04)、(4.72±0.01) mg/mL,而未发酵豆渣的IC50值为(9.50±0.07) mg/mL。3种药(食)真菌固体发酵对豆渣醇提物抗氧化活性的影响差异显著(P<0.05),其中抗氧化能力排序为灵芝发酵组>杏鲍菇发酵组>云芝发酵组>未发酵组。结果表明,3种药(食)真菌均能显著提高发酵后豆渣的抗氧化活性,这可能与发酵过程中豆渣中的总酚、异黄酮等生物活性物质含量的增加有关[29-30]。
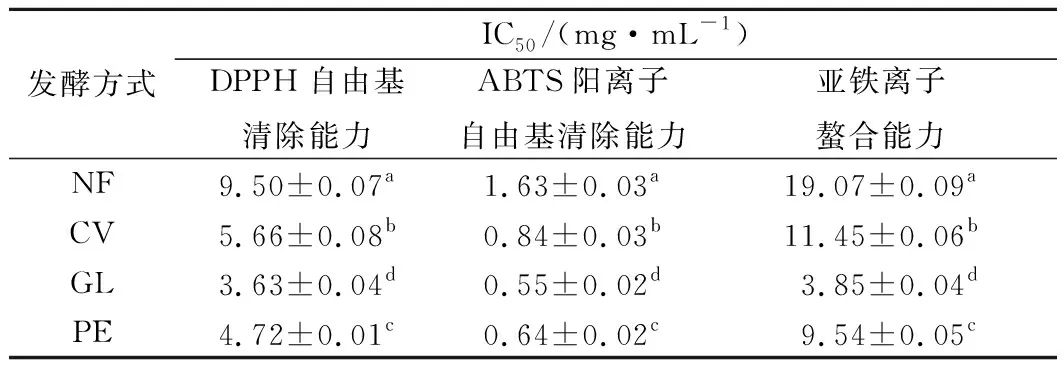
表4 发酵前后豆渣醇提物的抗氧化活性Table 4 Antioxidant activity of native and fermentedokara ethanol extracts
2.6 不同菌种发酵对豆渣醇提物α-葡萄糖苷酶抑制活性的影响
α-葡萄糖苷酶抑制剂可以通过抑制α-葡萄糖苷酶的活性,抑制食物中碳水化合物的水解,延缓或减少葡萄糖在肠道中的吸收,从而有效降低餐后高血糖,往往作为改善和治疗高血糖、2型糖尿病的一类药物[31]。图4结果显示,发酵与未发酵豆渣醇提物对α-葡萄糖苷酶均有一定的抑制作用,且随着样品质量浓度增加,α-葡萄糖苷酶抑制能力增强。3种药(食)真菌发酵后豆渣醇提物对α-葡萄糖苷酶抑制作用效果较未发酵豆渣显著提高(P<0.05)。当质量浓度为15 mg/mL时,未发酵豆渣醇提物对α-葡萄糖苷酶的抑制率为35.76%,而经云芝、灵芝和杏鲍菇固体发酵后的抑制率分别为62.25%、77.45%、47.91%。发酵后豆渣的α-葡萄糖苷酶抑制活性显著提高,与朱运平等[32]的研究结果一致,表明微生物发酵能促进豆渣中异黄酮、皂苷等生物活性成分的释放,从而提高发酵后豆渣α-葡萄糖苷酶的抑制作用效果。
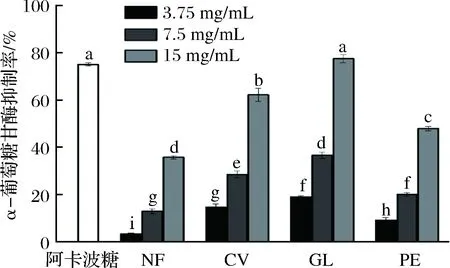
图4 发酵前后豆渣醇提物的α-葡萄糖苷酶抑制活性Fig.4 α-Glucosidase inhibitory activity of native andfermented okara ethanol extracts
2.7 发酵前后豆渣醇提物总酚物质含量与其抗氧化、α-葡萄糖苷酶抑制能力的相关性分析
由表5可知,发酵前后豆渣醇提物的总酚含量与DPPH自由基清除能力、ABTS阳离子自由基清除能力以及亚铁离子螯合能力呈现显著的相关性(P<0.05),其相关系数分别为0.982、0.951、0.956,表明发酵后豆渣醇提物的总酚含量越高,其体外抗氧化能力越强。但发酵前后豆渣醇提物的总酚含量与α-葡萄糖苷酶抑制能力无显著相关性(P>0.05),表明3种药(食)真菌发酵后豆渣中还存在着其他生物活性物质,如异黄酮、皂苷等,需进一步深入分析,以明确发酵后豆渣中的α-葡萄糖苷酶抑制作用活性成分。
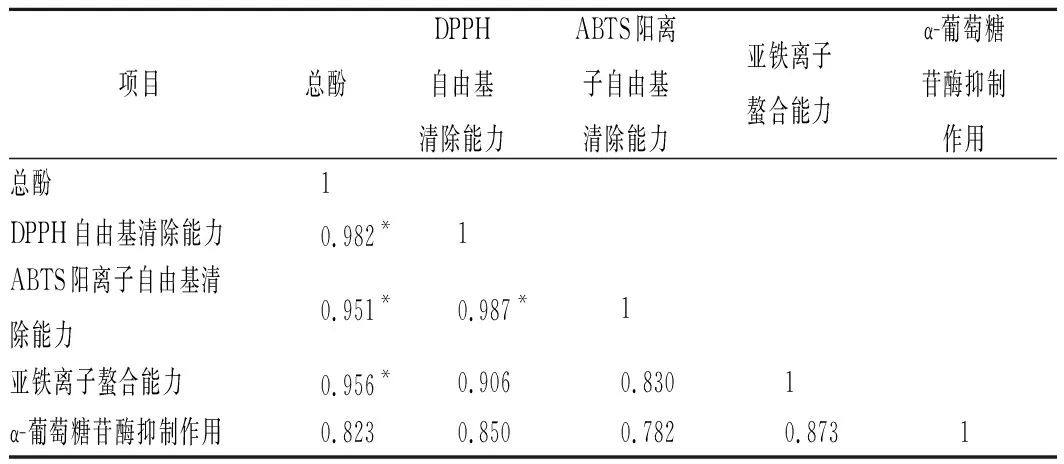
表5 发酵前后豆渣醇提物总酚物质含量与其抗氧化、α-葡萄糖苷酶抑制能力的相关性分析Table 5 Correlation analysis between total phenoliccontents and antioxidant,α-glucosidase inhibitory activitiesof native and fermented okara ethanol extracts
3 结论
经云芝、灵芝和杏鲍菇3种药(食)真菌固体发酵后,豆渣的总膳食纤维、不溶性膳食纤维含量减少,可溶性膳食纤维、蛋白质、游离氨基酸、还原糖、总酚等主要活性物质含量增加,这与发酵后豆渣中的淀粉酶活力、蛋白酶活力和纤维素酶活力显著提高有关。与未发酵豆渣相比,3种药(食)真菌固体发酵后豆渣醇提物表现出更为显著的DPPH自由基和ABTS阳离子自由基清除能力、亚铁离子螯合能力以及α-葡萄糖苷酶抑制能力,其中灵芝发酵后豆渣的生物功效更为突出。相关性分析结果表明,发酵前后豆渣醇提物的总酚物质含量与其抗氧化能力有较好的相关性,是其主要抗氧化物质。本研究揭示了云芝、灵芝和杏鲍菇固体发酵能有效改善豆渣的可食用性和营养价值,显著提高了发酵后豆渣的生物功效,为豆渣的功能性食品开发提供了科学依据。

