乳脂球表皮生长因子8介导的凋亡清除在子宫内膜异位症发病中的作用
赵宇 胡佳宁 杜心怡 王丹菡 卢晓声 胡越 张琼


[摘要] 目的 探討乳脂球表皮生长因子8(MFG-E8)与子宫内膜异位症发生发展的关系,及其对子宫内膜异位症的改善作用。 方法 检测2018年1~6月本院收治的子宫内膜异位症患者与对照组研究对象的腹腔腹水巨噬细胞的吞噬凋亡细胞能力,以及外周血、腹水及异位腹膜中MFG-E8表达差异;雌性SD大鼠随机分为模型组、MFG-E8+模型组、MFG-E8组、PBS+模型组和对照组,观察MFG-E8对异位移植病灶大小的作用,检测模型腹腔微环境中炎症因子白细胞介素-6、肿瘤坏死因子、白细胞介素-1β等的表达变化。 结果 子宫内膜异位症患者腹腔巨噬细胞吞噬功能显著低于正常对照组;子宫内膜异位症患者血清MFG-E8浓度为(0.71±0.08)ng/mL显著低于健康对照志愿者的(0.98±0.11)ng/mL(P<0.05),子宫内膜异位症患者腹水MFG-E8浓度为(0.40±0.05)ng/mL,显著低于健康对照志愿者的(0.59±0.07)ng/mL(P<0.05),异位内膜MFG-E8 mRNA 相对表达量显著低于对照组腹膜组织;重组MFG-E8干预后,能显著减小内异症模型的异位移植病灶体积,同时降低腹腔微环境中炎性细胞因子TNF-α、IL-1β和IL-6水平。 结论 MFG-E8在子宫内膜异位症与对照组人群存在表达差异,MFG-E8能改善子宫内膜异位症。
[关键词] 乳脂球表皮生长因子8;子宫内膜异位症;凋亡;清除
[中图分类号] R711.7 [文献标识码] A [文章编号] 1673-9701(2020)18-0037-05
The role of milk fat globule epidermal growth factor 8 mediated apoptotic clearance in the pathogenesis of endometriosis
ZHAO Yu1 HU Jia'ning2 DU Xinyi2 WANG Danhan1 LU Xiaosheng1 HU Yue1 ZHANG Qiong1
1.Department of Gynaecology and Obstetrics,the Second Affiliated Hospital & Yuying Childrens Hospital of Wenzhou Medical University, Wenzhou 325000, China; 2.The Second School of Medicine, Wenzhou Medical University, Wenzhou 325000, China
[Abstract] Objective To explore the relationship between milk fat globule epidermal growth factor 8(MFG-E8) and the development of endometriosis, and its improvement effect on endometriosis. Methods The phagocytic ability of macrophages towards apoptotic cells in peritoneal ascites, as well as the expression difference of MFG-E8 in peripheral blood, ascites and ectopic peritoneum, was detected in patients with endometriosis and controls in our hospital from January 2018 to June 2018. Female SD rats were randomLy divided into model group, MFG-E8+model group, MFG-E8 group, PBS+model group and control group. The effect of MFG-E8 on the size of ectopic transplantation lesions was observed. The expression changes of inflammatory factors including interleukin-6,tumor necrosis factor, interleukin-1β in the abdominal microenvironment of the model were detected. Results The phagocytic function of peritoneal macrophages in patients with endometriosis was significantly lower than that in the normal control group. The serum MFG-E8 concentration(0.71±0.08 ng/mL) in patients with endometriosis was significantly lower than that in healthy control volunteers(0.98±0.11)ng/mL(P<0.05). The ascites MFG-E8 concentration in endometriosis patients was(0.40± 0.05)ng/mL,which was significantly lower than that in healthy control volunteers (0.59±0.07)ng/mL (P<0.05). The relative expression of ectopic endometrium MFG-E8 mRNA was significantly lower than that of the control group. Intervention with recombinant MFG-E8 can significantly reduce the volume of ectopic transplantation lesions in the endometriosis model and reduce inflammatory cytokines TNF-α,IL-1β and IL-6 levels in the abdominal microenvironment. Conclusion MFG-E8 has different expression between endometriosis and control population, which can improve endometriosis.
[Key words] Milk fat globule epidermal growth factor 8; Endometriosis; Apoptosis; Clearance
子宫内膜异位症(Endometriosis,EMT)是常见的良性妇科疾病,但该病具有侵袭、转移与复发等恶性行为,严重影响育龄期妇女的健康和生活质量[1],该病的发病率高达30%~50%[2]。但其病因及发病机制仍不清楚。在目前诸多的发病学说中,Sampson的经血逆流学说占主导理论。当经期子宫黏膜碎片逆流入腹腔时,需经历细胞凋亡,凋亡细胞会被其邻近细胞以及招募的吞噬细胞快速有效清除。倘若机体内凋亡细胞不能得到及时清除,凋亡碎片长期存在,则可能引起继发性坏死,释放促炎介质,继而诱发慢性炎症和自身免疫性疾病[3]。
乳脂球表皮生长因子-8(milk fat globule-EGF factor 8,MFG-E8)[4],最初被发现是作为一个黏附在乳汁脂肪小球膜表面的镶嵌型外周蛋白,参与机体免疫清除过程及其他细胞间相互作用。吞噬细胞清除凋亡细胞过程中,当吞噬细胞被激活并遇到凋亡细胞后即可分泌MFG-E8。MFG-E8在吞噬细胞和凋亡细胞之间起到桥连作用,加强了凋亡细胞的吞噬清除,对维持机体的内环境稳定起到重要作用。
目前,国内外均未见有关子宫内膜异位症凋亡清除障碍及其与MFG-E8方面的相关报道,本文旨在探讨MFG-E8在子宫内膜异位症发病中的作用及机制,以期进一步明确子宫内膜异位症的发生发病机制,寻找该病治疗的新靶点,从根本上有效预防和治疗子宫内膜异位症。
1 材料与方法
1.1 主要试剂
MFG-E8 Elisa试剂盒购自美国R&D Systems公司,TNF-α、IL-1β和IL-6的Elisa試剂盒购自美国的BioLegend公司,实验步骤严格按照试剂盒说明书执行。rMFG-E8购自美国R&D Systems公司。
1.2 研究对象
1.2.1 样本来源 选择2018年1~6月温州医科大学附属第二医院收治的子宫内膜异位症患者40例(EMs组),年龄18~44岁,平均(30.90±6.38)岁,所有子宫内膜异位症病例均经腹腔镜或开腹手术,病理检查结果确诊。按1997年第3次修订的美国生育协会r-AFS分期标准进行分期,其中Ⅰ~Ⅱ期20例,评分5~14分,平均(9.60±3.20)分,Ⅲ~Ⅳ期20例,评分16~112分,平均(60.60±30.32)分,月经规律,周期28~32 d,无其他内分泌、免疫和代谢性疾病,手术前3个月内未接受激素及抗炎治疗;对照组为同期因卵巢囊肿(畸胎瘤、单纯囊肿、卵巢冠囊肿等)或宫颈病变等原因行手术,子宫内膜正常,同时排除子宫内膜异位症的患者,其余条件同子宫内膜异位症组;收集对照组40例,年龄18~41岁,平均(30.10±6.52)岁。所有患者均签订知情同意书,研究经本院伦理委员会批准。
术前抽取患者外周血,用于检测MFG-E8浓度;术中由手术医生抽取腹水,用于检测MFG-E8浓度和巨噬细胞吞噬凋亡细胞能力;并剪取腹膜异位病灶或盆壁处表面光滑、无异常表现的腹膜1×1 cm2大小,术中只夹取腹膜边缘,不触及其表面,从左下穿刺孔小心夹出,置于冻存管,进行液氮保存。
1.2.2 实验动物 雌性成熟未孕清洁级SD大鼠50只,实验前质量为200~250 g,由北京维通利华实验动物技术有限公司提供。
1.3 实验方法
1.3.1 动物模型制备 SD大鼠适应性喂养7 d,饲养环境:室温18℃~22℃,相对湿度40%~50%,标准饲料和水饲养。每天同一时间进行阴道涂片(以0.9%生理盐水冲洗阴道后,吸取少量阴道分泌物涂片镜检,镜下见有大量表层脱落细胞者为动情期),监测并统计大鼠动情规律。选取动情周期规则的SD大鼠40只。手术在无菌环境中进行,以3%戊巴比妥钠麻醉大鼠1 mL/kg。将大鼠仰卧位固定于手术操作台上,腹部消毒后做2~3 cm切口,游离右侧子宫,剪取靠近卵巢处约1.5 cm一段子宫置入含生理盐水的培养皿中,将子宫内膜层与子宫肌层分离后,将内膜剪成5 mm×5 mm大小,以可吸收缝线四角缝固于右侧腹壁血管交叉处,内膜面贴腹壁。以生理盐水冲洗腹腔,逐层缝合腹部切口。术后肌注青霉素0.4万U/只,连续5 d,预防感染。术后大鼠分笼单放,使其自然苏醒,常规饲养。于术后3周再次开腹。本实验经温州医科大学动物伦理委员会批准。
1.3.2 模型的判定 模型建立3周后,对实验大鼠进行第2次剖腹,用测量尺测量移植物的长、宽、高,并记录观察移植物的生长情况与存活情况。子宫内膜异位症模型建模成功观察标准:移植灶体积增大(体积大于25 mm3;高度大于1 mm),呈透明的结节状、囊状、有澄清液体积聚,移植物被结缔组织覆盖并有血管形成,质地软。
1.3.3 动物分组及给药 将大鼠饲养1周后,取50只随机平均分为5组,分别为模型组、MFGE8+模型组、MFGE8组、PBS+模型组和对照组:模型组按建模方法常规建模;MFG-E8+模型组建模后每日腹腔注射15 μg/kg rMFG-E8,持续3周;MFGE8组每日腹腔注射15 μg/kg rMFG-E8,持续3周;PBS+模型组每日腹腔注射rMFG-E8溶解剂PBS 0.1 mL,持续3周;对照组不做任何处理。
1.3.4 观察异位病灶 建模3周,大鼠全部颈椎脱臼法处死,以游标卡尺测量给药前后各组异位病灶的体积(V=0.52×长×宽×高,mm3)。
1.4 观察指标
收集40例子宫内膜异位症患者和40例对照组血清样本,利用酶联免疫吸附法(Elisa)检测血清中MFG-E8浓度;收集各组实验大鼠腹腔液,分别利用IL-1β、IL-6和TNF-α Elisa 试剂盒检测腹腔液中IL-1β、IL-6和TNF-α含量。实验步骤严格按照试剂盒说明书执行。
1.5 统计学处理
采用SPSS 20.0软件对本研究中数据进行统计学处理,计量资料用(x±s)表示,两组间比较采用t检验,多组间变量比较采用单因素方差分析,组间差异分析采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜异位症患者与正常对照腹水中巨噬细胞吞噬凋亡细胞能力的情况
本研究检测了10例子宫内膜异位症患者和10例非子宫内膜异位症对照组腹水/腹腔冲洗液中巨噬细胞吞噬凋亡细胞能力的情况,结果发现子宫内膜异位症患者腹腔巨噬细胞吞噬功能为(35.50±2.10)%,显著低于对照组的(57.75±3.82)%。见图1。
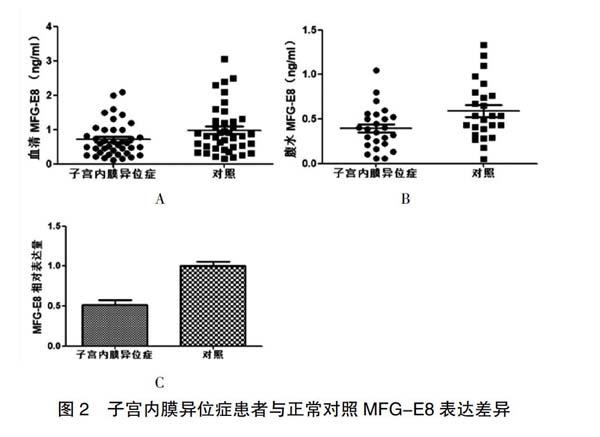
2.2 子宫内膜异位症患者与正常对照MFG-E8表达差异
为确定MFG-E8在子宫内膜异位症中的作用,本研究收集子宫内膜异位症临床样本及正常对照组,并检测其血清和腹水MFG-E8的浓度。ELISA检测结果显示子宫内膜异位症患者血清MFG-E8浓度为(0.71±0.08) ng/mL,显著低于健康对照志愿者(0.98±0.11) ng/mL,P<0.05,图2A;子宫内膜异位症患者腹水MFG-E8浓度为(0.40±0.05) ng/mL,显著低于健康对照志愿者的(0.59±0.07) ng/mL,P<0.05,图2B。qPCR 法检测结果显示,异位内膜MFG-E8 mRNA 相对表达量与对照组腹膜组织比较,差异有统计学意义(P<0.05;图2C)。
2.3 MFG-E8干预后子宫内膜异位症模型异位病灶的改变
子宫内膜异位症主要病理性改变表现为异位内膜病灶体积的变化,观察病灶部位呈圆形或扁圆形的囊状,囊内充满白色或淡黄色透明积液,其表面有血管生長。经rMFG-E8干预后,异位病灶体积对比模型组有减小,差异有统计学意义(P<0.05)。见表1。
注:与模型组比较,*P<0.05
2.4 各组腹腔微环境中炎症因子白细胞介素-6、肿瘤坏死因子、白细胞介素-1β等的表达变化比较
结果显示,与对照组比较,模型组和MFG-E8+模型组腹腔液中TNF-α、IL-1β和IL-6含量均显著升高(P<0.05);与模型组比较,MFG-E8组大鼠腹腔液中TNF-α、IL-1β和IL-6含量均显著降低(P<0.05)。见表2。
3 讨论
子宫内膜异位症是育龄期妇女的常见病和多发病,可严重影响患者的生活质量和生育能力[5-8]。该病尽管是良性疾病,但具有转移、浸润和复发等恶性生物学行为,该病的发病率高达30%~50%。但其病因及发病机制仍不清楚,探讨子宫内膜异位症的发病机制,寻找预防其发病的有效方法和手段,是目前妇科研究的热点和难点。目前尚无一元论可解释该疾病的发生机制,多个研究提示子宫内膜异位病灶的形成是一个多因素共同参与的复杂过程[9-12]。
3.1 子宫内膜异位症凋亡吞噬功能障碍
在目前诸多的发病学说中,Sampson的经血逆流学说占主导理论,其认为经期时子宫内膜腺上皮和间质细胞可随经血逆流进入盆腔,种植于卵巢和邻近的盆腔腹膜,并继续生长形成盆腔内异病灶。但是该理论不能解释经血逆流是生理现象,却只有部分妇女发生子宫内膜异位症。有研究显示,经血逆流只是诱因,更深层的原因可能是子宫内膜异位症患者盆腹腔内微环境的改变[13]。然而子宫内膜异位症患者盆腹腔内微环境变化的始动原因仍不明确。在健康机体中,当经期子宫黏膜碎片逆流入腹腔时,需经历细胞凋亡,凋亡细胞会被其邻近细胞以及招募的吞噬细胞快速有效清除,从而避免死亡细胞内容物外流引起的炎症反应。倘若机体内凋亡细胞不能得到及时清除,凋亡碎片长期存在,则可能引起继发性坏死,释放促炎介质,继而诱发慢性炎症和自身免疫病[3]。本研究结果提示,子宫内膜异位症的发生可能与凋亡细胞的清除障碍有关。逆流盆腹腔的内膜细胞发生凋亡,不能被及时有效地清除,继而发生次级的细胞坏死,细胞核膜和细胞核裂解,细胞解体,释放出有毒内容物,导致严重炎症,继而诱使异位子宫内膜细胞发生黏附、种植、侵袭和新生血管的形成,最终表现为子宫内膜异位症。显然,凋亡细胞的清除障碍的深入研究将为子宫内膜异位症病因探索提供新的思路。但是,目前对子宫内膜异位症的凋亡清除机制障碍的原因仍不清楚。
3.2 子宫内膜异位症患者与正常对照MFG-E8表达差异
关于MFG-E8,最初被发现它是作为一个黏附在乳汁脂肪小球膜表面的镶嵌型外周蛋白,由乳腺上皮细胞、巨噬细胞、不成熟树突状细胞分泌,参与机体免疫清除过程及其他细胞间相互作用。研究发现在妇科卵巢恶性肿瘤中,MFG-E8的表达量显著高于正常对照组[14],且拮抗MFG-E8有明显的抑癌作用[15]。MFG-E8是一种存在于多种物种体内的亲脂性糖蛋白。在机体清除凋亡细胞上起着重要的作用[16]。吞噬细胞清除凋亡细胞过程中,当吞噬细胞被激活并遇到凋亡细胞后即可分泌MFG-E8。MFG-E8在吞噬细胞和凋亡细胞之间起到桥连作用,加强了凋亡细胞的吞噬清除,对维持机体的内环境稳定起到重要作用。研究证实[17,18],与野生型的动物比较,无MFG-E8分泌的动物体内活化巨噬细胞对凋亡细胞的吞噬功能减弱。Kamran等[19]研究发现,MFG-E8通过辨认暴露于凋亡上皮细胞表面的丝氨酸与凋亡的上皮细胞结合,并促进吞噬细胞对凋亡细胞的清除,缺乏MFG-E8的小鼠乳腺组织凋亡的细胞数增多,乳腺退化和脂肪细胞再生受阻,并随乳腺退化的进行,乳腺组织出现炎症。凋亡细胞碎片的吞噬清除对维持机体内环境的稳定及激活抗炎通路是至关重要的。本研究结果显示,子宫内膜异位症患者外周血、腹水及腹膜病灶和正常对照比较,MFG-E8的含量及mRNA的表达显著降低,提示MFG-E8可能在介导子宫内膜异位症的凋亡细胞清除过程中起重要作用。
3.3 MFG-E8与子宫内膜异位症发病的关系
在确认MFG-E8在子宫内膜异位症和正常对照存在表达差异的基础上,为深入探讨MFG-E8在子宫内膜异位症中的意义,本研究予重组MFG-E8干预子宫内膜异位症动物模型,结果发现,应用MFG-E8后,异位移植病灶显著缩小。显然,对介导凋亡细胞的清除的MFG-E8的深入研究为探索子宫内膜异位症的病因提供了新线索。凋亡细胞碎片的吞噬清除对维持机体内环境的稳定及激活抗炎通路是至关重要的。进一步检测炎症因子,结果发现,炎性细胞因子TNF-α、IL-1β和IL-6在子宫内膜异位症模型中显著增加,MFG-E8干预后,能使子宫内膜异位症模型大鼠腹腔液中炎性细胞因子TNF-α、IL-1β和IL-6显著降低,具有明显抑制腹腔微环境中炎症反应作用。盆腹腔内异位病灶周围有大量促炎因子存在。微环境中的促炎性细胞因子及生长因子[10-22],如白细胞介素-6,肿瘤坏死因子,白细胞介素-1β等增加了细胞的增殖,促进了异位组织的粘连及细胞黏附分子的脱落,促进形成新生血管。由此可见,盆腹腔微环境与子宫内膜异位症发生发展关系密切。提示,MFG-E8通过介导凋亡细胞的有效清除,进而抑制炎症因子,改善子宫内膜异位症的发生发展。
本研究首次阐述子宫内膜异位症存在凋亡细胞清除障碍现象的存在,并揭示了MFG-E8与子宫内膜异位症发病的关系,探讨通过MFG-E8来防治子宫内膜异位症的发生的可行性,寻找该病治疗的新靶点,从根本上有效预防和治疗子宫内膜异位症。
[参考文献]
[1] Bhide S,Flyckt R,Yao M,et al.A comparative study of the impact of chronic pelvic pain on quality of life in women with and without endometriosis[J]. Obstetrics and Gynecology,2019,133:19S.
[2] Totev T,Tihomirova T,Tomov S,et al. Laparoxcopic surgery in pelvic endometrosis and sterility[J]. Akusherstvo I Ginekologii A,2015,54(4):57-60.
[3] Vandivier RW,Henson PM,Douglas IS.Burying the dead:The impact of failed apoptotic cell removal (efferocytosis) on chronic inflammatory lung disease[J]. Chest,2006,129(6):1673-1682.
[4] Xiao W,Bu H,Liu SX,et al. Molecular mechanisms underlying the regulation of the MFG-E8 gene promoter activity in physiological and inflammatory conditions[J].Journal of Cellular Biochemistry,2015,116(9):1867-1879.
[5] Anna Marklund,Annika Sj■vall,Lennart Blomqvist,et al. Endometriosis, the great imitator-A successful case of fertility preservation in a woman receiving sterilizing treatment due to a diagnosis of rectosigmoid carcinoma[J].Gynecological Endocrinology,2019,35(11):945-948.
[6] Georgia Rush,RoseAnne Misajon,John A,et al.The relationship between endometriosis-related pelvic pain and symptom frequency,and subjective wellbeing[J]. Health and Quality of Life Outcomes,2019,17(1):123.
[7] Shigesi N,Kvaskoff M,Kirtley S,et al. The association between endometriosis and autoimmune diseases:A systematic review and meta-analysis[J].Hum Reprod Update,2019,25(4):486-503.
[8] Broi MGD,Ferriani RA,Navarro PA.Ethiopathogenic mechanisms of endometriosis-related infertility[J].JBRA Assist Reprod,2019,23(3):273-280.
[9] Matalliotaki C,Matalliotakis M,Rahmioglu N,et al. Role of FN1 and GREB1 gene polymorphisms in endometriosis[J].Mol Med Rep,2019,20(1):111-116.
[10] 李雪,張宗峰.巨噬细胞在子宫内膜异位症中作用的研究进展[J].中华生殖与避孕杂志, 2019,39(4):325-328.
[11] Yeon Jean Cho,Jiyeun E Lee,Mi Jin Park,et al. Bufalin suppresses endometriosis progression by inducing pyroptosis and apoptosis[J].Journal of Endocrinology,2018,237(3):255-269.
[12] Viganò D,Zara F,Usai P.Irritable bowel syndrome and endometriosis:New insights for old diseases[J].Dig Liver Dis,2018,50(3):213-219.
[13] Gonalves GA,Invitti AL,Parreira RM,et al.p27(kip1) overexpression regulates IL-1β in the microenvironment of stem cells and eutopic endometriosis co-cultures[J].Cytokine,2016,89:229-234.
[14] Li N,Dai C,Yang Y,et al.The expression levels and clinical significance of MFG-E8 and CD133 in epithelial ovarian cancer[J].Gynecol Endocrinol,2020,VN:1-5.
[15] Lorenzo T,Shirley L,Nicolas André,et al. New blocking antibodies impede adhesion,migration and survival of ovarian cancer cells,highlighting MFGE8 as a potential therapeutic target of human ovarian carcinoma[J]. PLoS ONE,2013,8(8):e72708.
[16] 王秋實,王导新.MFG-E8参与细胞凋亡机制及在慢性阻塞性肺疾病中作用的研究进展[J].重庆医学,2019, 13:2289-2291.
[17] Hanayama R,Tanaka M,Miwa K,et al.Identification of a factor that links apoptotic cells to phagocytes[J].Nature,2002,417(6885):182-187.
[18] Das A,Ghatak S,Sinha M,et al. Correction of MFG-E8 resolves inflammation and promotes cutaneous wound healing in diabetes[J].Journal of Immunology,2016,196(12):5089-5100.
[19] Kamran A,Rafael F,Xiaozhu H,et al. Autoimmune disease and impaired uptake of apoptotic ceils in MFGE8 deficient mice[J].Molecular Biology of the Cell, 2005,16(3):5528-5537.
[20] Wang XM,Ma ZY,Song N.Inflammatory cytokines IL-6,IL-10,IL-13,TNF-α and peritoneal fluid flora were associated with infertility in patients with endometriosis[J].Eur Rev Med Pharmacol Sci,2018,22(9):2513-2518.
[21] Sikora Justyna,Ferrero Simone,Mielczarek-Palacz,et al. The delicate balance between the good and the bad IL-1 proinflammatory effects in endometriosis[J]. Current Medicinal Chemistry,2018,25(18):2105-2121.
[22] Wei Zhao,Shan Kang,Jian Zhao,et al. Aberrant methylation of the IL-12B promotor region contributes to the risk of developing ovarian endometriosis[J]. Molecular Reproduction and Development,2019,86(8):632-638.
(收稿日期:2020-02-05)

