牙龈卟啉单胞菌特异性单克隆抗体的制备
陈园园 李明霞 刘颖 张子路 杨秋波


[摘要] 目的 制备特异性识别牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)的单克隆抗体(monoclonal antibody,mAb)。 方法 ①采用杂交瘤的方法制备mAb,用P.g重组血凝素2(recombinant Hemagglutinin 2,rHA2)免疫BALB/c小鼠,间接ELISA筛选特异性识别P.g的杂交瘤细胞株;②间接ELISA检测mAb的效价及识别P.g的特异性、敏感性。 结果 筛选到5株特异性识别P.g的mAbs,C10、F3、F3-2、G3和G3-2。其中,C10、G3和G3-2免疫球蛋白亚类为IgG2a型;F3和F3-2免疫球蛋白亚类为IgG1型。mAb C10、G3、F3和F3-2識别P.g的效价均>1∶128 000;mAb G3-2识别P.g的效价>1∶16 000;5株mAb识别rHA2的效价均>1∶128 000。5株mAb均特异性识别>5×105 cfu/mL的P.g ATCC33277。 结论 制备了5株特异性识别P.g的mAb,可用于各种免疫学技术,为开发P.g检测工具提供了条件,对牙周病的诊断和治疗有一定的意义。
[关键词] 单克隆抗体;牙龈卟啉单胞菌;血凝素;杂交瘤技术
[中图分类号] R781.4 [文献标识码] B [文章编号] 1673-9701(2020)18-0042-05
Preparation of specific anti-Porphyromonas gingivalis monoclonal antibody
CHEN Yuanyuan LI Mingxia LIU Ying ZHANG Zilu YANG Qiubo
School of Stomatology, Capital Medical University, Beijing Institute of Dental Research, Beijing 100050, China
[Abstract] Objective To prepare specific anti-Porphyromonas gingivalis(P.g) monoclonal antibody(mAb). Methods (1)mAb was prepared through the hybridoma method, BALB/c mice were immunized with recombinant hemagglutinin 2(rHA2), and hybridoma cell lines were screened by indirect ELISA. (2)Indirect ELISA was used to detect the titer of mAb and to recognize the specificity and sensitivity of P.g. Results The five mAbs of C10, F3, F3-2, G3 and G3-2 were screened for specific recognition of P.g. Among them, C10, G3 and G3-2 immunoglobulin subclasses were the IgG2a type; F3 and F3-2 immunoglobulin subclasses were the IgG1 type. The titer of mAb C10, G3, F3 and F3-2 recognizing P.g was>1:128 000; the titer of mAb G3-2 recognizing P.g was>1:16 000; the titer of 5 mAbs recognizing rHA2 was>1:128 000. All specific mAbs recognize P.g ATCC33277 no less than 5×105 cfu/mL. Conclusion 5 mAbs for P.g specific recognition have been prepared, which can be used in various immunological techniques, providing conditions for the development of P.g detection tools. It is of a certain significance for the diagnosis and treatment of periodontal diseases.
[Key words] Monoclonal antibody; Porphyromonas gingivalis; Hemagglutinin; Hybridoma technique
牙周炎是牙周支持组织的破坏性疾病,是全球广泛流行的口腔疾病之一。牙周炎不仅降低患者的生活质量,还会给患者造成沉重的经济负担[1]。2015年全球有35亿人罹患口腔疾病,其中5.38亿为重度牙周炎,随着人口的不断增长和老龄化,该数字会继续增长[2]。牙周炎不仅是成年人失牙的主要因素,还是心血管疾病[3]、类风湿性关节炎[4]、糖尿病[5]以及阿尔茨海默症[6]等系统性疾病的危险因素。在牙周致病菌中,牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)被认为是最主要的致病菌之一[7,8],其口内水平可以预测疾病的进展[9],且与以上系统性疾病均相关[10],因此对P.g的检测至关重要。目前P.g的检测主要依靠实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR),但RT-PCR存在昂贵,需要提取、分离DNA,需要大型设备及熟练操作人员的问题而难以在临床应用[11]。随着个性化医疗的发展,基于抗原抗体相互作用的椅旁检测占据主导地位[12],亟需制备P.g特异性的单克隆抗体(monoclonal antibody,mAb)来开发椅旁检测装置。
P.g依靠血凝素2(Hemagglutinin 2,HA2)与血红素结合以获取维持生存和感染能力所需要的铁和卟啉[13]。Yang等[14]重组表达了HA2,测序结果与ATCC 33277 HA2序列100%相似,并通过结合实验明确重组血凝素2(recombinant Hemagglutinin 2,rHA2)可以结合氯化血红素。DeCarlo等[15]用rHA2免疫大鼠,可抑制 P.g感染引起的牙槽骨吸收,亦表明HA2在P.g感染中起重要作用。本研究用rHA2免疫小鼠制备P.g特异性的mAb,为P.g特异性检测奠定基础。
1 材料与方法
1.1 细胞
小鼠骨髓瘤细胞系Sp2/0-Ag14购于中国协和医科大学细胞中心。
1.2 菌株
P.g ATCC33277、381和临床菌株;中间普氏菌(Prevotella intermedia,P.i)ATCC25611、具核梭杆菌(Fusobacterium necrophorum,F.n)ATCC10953、黏性放线菌(Aggregatibacter viscosus,A.v)ATCC19246、伴放线放线杆菌(Aggregatibacter actinomycetemcomitans,A.a)ATCC24523、变形链球菌(Streptococcus mutans,S.m)血清c型均由北京口腔医学研究所提供。
1.3 实验动物
BALB/c小鼠(体重18~22 g、雌性、6周龄,用于免疫;体重>20 g、雌性、>10周龄,用于腹水制备),购自北京维通利华实验动物技术有限公司。
1.4主要试剂
rHA2由北京口腔医学研究所制备保存并提供;mAb D1(抗孔雀石绿单抗,P.g无关单抗)购自北京点石科创生物技术有限公司;辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司;二喹啉甲酸(Bicin-choninic Acid,BCA)蛋白定量试剂盒购自康为世纪生物科技有限公司;Mouse单克隆抗体亚型鉴定试剂盒购自Proteintech Group;脱脂奶粉购自北京普利莱基因技术有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)购自HyClone;包被液、四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB)显色液、含0.05% Tween-20的PBS、终止液和氯化血红素购自北京索莱宝科技有限公司;维生素K1购自国药集团容生制药有限公司;脑心浸液(Brain Heart Infusion,BHI)购自OXOID,混合气体(80% N2、10% H2和10% CO2)购自北京普莱克斯实用气体有限公司。
1.5 细菌培养及计数
细菌培养:P.g、P.i、F.n和A.v在CDC固体培养基上37℃厌氧培养(80% N2、10% H2和10% CO2)5~7 d;A.a在TSBV固体培养基上37℃厌氧培养5 d;S.m在MSA固体培养基上37℃培养2 d后,革兰染色镜检证实为纯培养物后,挑取P.g、P.i、F.n、A.v和A.a菌落接种BHI液体培养基(BHI 37 g/L+5 mg氯化血红素+10 mg维生素K1),37℃厌氧培养24 h;S.m菌落接种于MSA液体培养基中24 h。将菌液4℃、6500 g、离心10 min,弃上清,PBS洗两次(4℃、7000 g、离心20 min)。细菌计数:菌液4℃、6500 g、离心10 min,弃上清,十倍比稀释成10-1~10-7,用10-5、10-6和10-7稀释的菌液涂布CDC固体培养基平板,100 μL/板,每个浓度涂布3个平板,厌氧培养7 d后计数,计算3个平板的平均菌落值;菌液2倍比从2~32倍稀释,测定A600 nm,根据A600 nm对应平板平均菌落数绘制散点图,回归分析生成标准曲线,每次测定P.g的A600nm,根据标准曲线换算细菌浓度,将菌液稀释至适当浓度。
1.6 小鼠免疫、细胞融合、腹水制备、纯化
小鼠免疫(6只用于rHA2免疫,2只制备阴性血清)、细胞融合、腹水制备和纯化的具体方法参见文献[16]。
1.7 阳性克隆筛选和克隆化培养
间接ELISA篩选阳性孔,用P.i、A.a、A.v、F.n和S.m作阴性对照筛选,得到特异性识别P.g的孔。将筛选的细胞株克隆培养,再次进行特异性检测,选择分泌特异性抗体的杂交瘤细胞株。
1.8 亚型测定
试剂盒室温平衡30 min,用PBST将mAb 1∶2000稀释,50 μL/孔,加山羊抗小鼠IgG+IgM-HRP 50 μL/孔,混匀,盖上封板膜,室温孵育1 h;PBST洗板3次,吸水纸拍干,加现配的显色液(A∶B=1∶100)100 μL/孔,室温避光显色15 min;加终止液100 μL/孔;酶标仪读取A450nm结果,值最高孔对应的HRP标记的山羊抗小鼠IgG类型为相应亚型。
1.9 单克隆抗体浓度测定
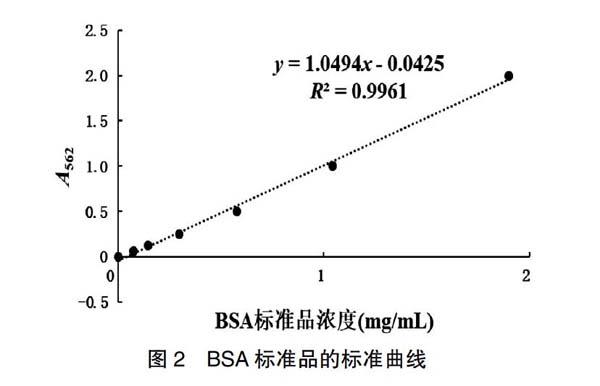
用PBS将BSA标准品稀释成2、1、0.5、0.25、0.125、0.0625和0 mg/mL,稀释好的BSA标准品和待测蛋白(C10、G3稀释5倍,G3-2稀释3倍,F3、F3-2未稀释)各25 μL/孔,每个浓度设置3个复孔;加200 μL/孔BCA工作液(BCA-A∶BCA-B= 50∶1),充分混匀,盖上96孔板盖,37℃孵育30 min;冷却至室温,测定A562nm结果;浓度对应A562nm结果绘制散点图得标准曲线,将待测蛋白A562nm代入曲线所得x值乘以稀释倍数即待测蛋白的浓度。
1.10 单克隆抗体效价的测定
包被:酶标板上加入100 μL/孔浓度为5×108 cfu/mL的P.g菌液或4 μg/mL rHA2,贴上封板膜,4℃过夜;封闭:倒掉孔内液体,300 μL/孔PBST洗涤,甩干,在不脱纤维的纸上拍干,重复3次,300 μL/孔5%的脱脂奶粉37℃封闭1 h;加样:洗涤3次,分别加入2倍比稀释的单抗100 μL/孔,单抗均稀释成0.5 mg/mL后,用样稀(5%脱脂奶粉:PBST=1∶15配制)二倍比从1∶1 000到1∶128 000稀释,以不相关单抗D1作阴性对照,每个浓度设置3个复孔,37℃孵育30 min;加二抗:洗涤3次,加入1∶5000稀释的HRP标记的山羊抗小鼠IgG 100 μL/孔,37℃孵育30 min;显色:洗涤4次,加入TMB显色液100 μL/孔,室温避光30 min;终止:加入50 μL/孔的终止液;读数:立即用酶标仪读取A450 nm结果。结果判定:按三复孔的平均值计算,mAb的A450 nm值为(P),D1的A450 nm为阴性对照(N),P/N>2为阳性,表明当前稀释倍数时mAb识别P.g或rHA2。
1.11 单克隆抗体特异性检测
包被5×107 cfu/mL的P.g、P.i、F.n、A.a、A.v和S.m;mAb均1∶1000稀释;其余操作步骤同效价测定。结果判定:P/N>2为阳性,表明mAb识别该细菌。
1.12单克隆抗体敏感性检测
分别包被十倍比稀释从5×108到50 cfu/mL的ATCC33277、381和临床菌株;mAb均1∶1000稀释;其余操作步骤同效价测定。结果判定:P/N>2为阳性,表明mAb识别该浓度的P.g。
2 结果
2.1 细菌计数标准曲线
10-6稀释的菌液涂布的平板上平均有124个菌落,根据平板计数得P.g的标准曲线为y=0.2745x-0.0007,R2=0.9997,见图1。
2.2 小鼠免疫
免疫的6只小鼠中仅小鼠5特异性识别P.g,选择小鼠5进行细胞融合。
2.3 阳性克隆筛选和克隆化培养
经融合、筛选及亚克隆得到特异性识别P.g的杂交瘤细胞5株,命名为C10、F3、F3-2、G3和G3-2。
2.4 单克隆抗体亚型鉴定
mAb C10、G3、G3-2亚型为IgG2a型,轻链为λ链;mAb F3、F3-2亚型为IgG1型,轻链为k链,见表1。
注:标*数值对应mAb亚型为相应mAb的亚型
2.5 单克隆抗体的浓度
标准曲线y=1.0494x-0.0425,R2=0.9961,见图2。mAb C10、F3、F3-2、G3和G3-2的A562nm值分别为1.053、1.056、0.481、1.591和1.134,浓度分别为5、1、0.5、7.8和3.4 mg/mL。
2.6 单克隆抗体的效价
见封三图3,mAb C10、F3、F3-2和G3识别P.g的效价>1∶128 000,mAb G3-2识别P.g的效价>1∶16 000,见封三图3a;mAb C10、F3、F3-2、G3和G3-2识别rHA2的效价均>1∶128 000,见封三图3b。
2.7 单克隆抗体识别P.g菌株的特异性
mAb C10、F3、F3-2、G3和G3-2仅在检测P.g时P/N>2,与P.i、F.n、A.a、A.v和S.m均无交叉反应,特异性良好,见封三图4。
2.8 单克隆抗体识别P.g菌株的敏感性
mAb C10、F3、F3-2、G3和G3-2均识别>5×105 cfu/mL的ATCC33277;mAb C10、F3、F3-2和G3均识别>5×106 cfu/mL的381,mAb G3-2识别>5×107 cfu/mL的381;mAb C10、F3、F3-2和G3均识别>5×105 cfu/mL的P.g临床菌株,mAb G3-2识别>5×106 cfu/mL的P.g临床菌株,见封三图5。
3 讨论
本研究利用P.g ATCC33277的rHA2免疫BALB/c小鼠,得到了5株效价较高的mAb。5株mAb不仅识别实验室菌株ATCC33277、381,还识别P.g临床菌株。5株mAb与口腔内常见细菌P.i、F.n、A.a、A.v和S.m无交叉反应,可以特异性识别P.g。
在口腔菌群中,链球菌属、放线菌属、普氏菌属、梭杆菌属是丰度很高的菌属[17]。其中A.v和S.m是常见的致龋菌,S.m血清c型的检出率可达80%;A.a是局限性侵袭性牙周炎的主要致病菌;P.i形态及一些致病性与P.g相似;F.n有很强的粘附性,常与P.g聚集,因此选择P.i、F.n、A.a、A.v和S.m作为对照进行了mAb的特异性检测。本研究mAb的敏感性检测中,应用的菌株数量较少,后续实验将增加检测的菌株类型。
相比于多克隆抗体,mAb因其效价高、特异性好而被广泛应用于ELISA、侧流免疫层析等以抗体-抗原结合为基本原理的免疫分析技术中[18],尤其微生物检测和疾病诊断领域[19-20]。Booth等[21]以P.gW83为抗原制备的Mab 61BG1.3,可以识别22个P.g实验室菌株和105个临床分离菌株。但是全菌成分较复杂,易引起交叉反应,所以研究P.g的主要毒力因子,利用其具有誘导免疫保护作用的抗原有望成功制备P.g特异性抗体。P.g细胞表面和外膜囊泡中40 KDa的外膜蛋白(outer membrane protein,OMP)是P.g共聚集和血红素凝集的毒力因子之一,且具有免疫保护作用;Imamura等[22]用P.gW83的OMP40免疫小鼠制备了mAb,用口腔和呼吸道常见的细菌作对照验证了mAb的特异性,但未提供mAb的敏感性数据。牙龈素(包括精氨酸和赖氨酸特异性蛋白酶复合物)是P.g独特的蛋白酶,该蛋白酶在细菌粘附、定植,组织破坏,血红蛋白的结合和降解,宿主防御失活和宿主免疫系统调节中发挥作用。研究表明,精氨酸和赖氨酸特异性蛋白酶的粘附区(haemagglutinin/adhesin,HA)在牙龈素的致病中起主要作用。HA1在菌株间高度保守,HA1免疫小鼠可以对P.g引起的牙周炎起到保护作用,抗HA1抗体可以抑制蛋白水解;OBrien-Simpson等[9]用P.gW50的HA1免疫小鼠制备了mAb,mAb可以特异性识别>2×102的P.g。HA2是P.g与血红蛋白和血红素结合的主要参与者[13],Yang等[14]重组表达的HA2在菌株间相似性>98%,rHA2的氯化血红素结合位点多肽免疫大鼠可以产生保护作用[23];本研究用ATCC 33277的rHA2免疫小鼠制备mAb,制备的mAb能特异性识别>5×105 cfu/mL的P.g。造成OBrien-Simpson等制备的mAb和本研究中mAb识别阈值差异的原因可能为:①检测的实验室菌株不同,前者用P.gW50,本研究应用P.gATCC 33277;②实验方法不同,前者ELISA实验应用两种二抗(山羊抗小鼠IgG和HRP标记的兔抗山羊IgG),有信号放大作用;本研究中应用HRP标记的山羊抗小鼠IgG。
RT-PCR檢测牙周炎患者龈下菌斑中P.g均>106 cfu/mL[24-26],本研究制备的mAb能识别>5×105 cfu/mL的P.g,可以用于龈下菌斑中P.g的检测。P.g是牙周炎病变区或活动部位最主要的优势菌,牙周炎治疗后复发或病情继续加重与P.g存在有关[24]。牙周炎患者治疗效果不佳时,用P.g特异性的抗体进行微生物评估,可以帮助寻找病因,指导临床治疗方案的制订。
[参考文献]
[1] Peres MA,Macpherson LMD,Weyant RJ,et al. Oral diseases:A global public health challenge[J]. Lancet,2019, 394(10194):249-260.
[2] Kassebaum NJ,Smith AGC,Bernabé E,et al. Global,regional,and national prevalence,incidence,and disability-adjusted life years for oral conditions for 195 countries,1990-2015:A systematic analysis for the global burden of diseases,injuries,and risk factors[J]. J Dent Res,2017,96(4):380-387.
[3] Sanz M,Marco del Castillo A,Jepsen S,et al. Periodontitis and cardiovascular diseases:Consensus report[J]. J Clin Periodontol,2020,47(3):268-288.
[4] De Molon RS,Rossa C,Thurlings RM,et al. Linkage of periodontitis and rheumatoid arthritis:Current evidence and potential biological interactions[J]. Int J Mol Sci,2019, 20(18):4541.
[5] Balmasova IP,Lomakin YA,Babaev EA,et al. “Shielding” of cytokine induction by the periodontal microbiome in patients with periodontitis associated with type 2 diabetes mellitus[J]. Acta Naturae,2019,11(4):79-87.
[6] Sureda A,Daglia M,Argüelles Castilla S,et al. Oral microbiota and Alzheimers disease:Do all roads lead to Rome?[J]. Pharmacol Res,2020,151:104582.
[7] Xu W,Zhou W,Wang H,et al. Roles of Porphyromonas gingivalis and its virulence factors in periodontitis[J]. Adv Protein Chem Struct Biol,2020,120:45-84.
[8] Jia L,Han N,Du J,et al. Pathogenesis of important virulence factors of Porphyromonas gingivalis via toll-like receptors[J]. Front Cell Infect Microbiol,2019,9:262.
[9] OBrien-Simpson NM,Burgess K,Lenzo JC,et al. Rapid chair-side test for detection of porphyromonas gingivalis[J].J Dent Res,2017,96(6):618-625.
[10] Bui FQ,Almeida-da-Silva CLC,Huynh B,et al. Association between periodontal pathogens and systemic disease[J]. Biomed J,2019,42(1):27-35.
[11] Alhogail S,Suaifan GARY,Bizzarro S,et al. On site visual detection of Porphyromonas gingivalis related periodontitis by using a magnetic-nanobead based assay for gingipains protease biomarkers[J]. Microchimica Acta,2018,185(2):149.
[12] Hanafiah KM,Garcia M,Anderson D. Point-of-care testing and the control of infectious diseases[J]. Biomark Med,2013,7(3):333-347.
[13] Smalley JW,T Olczak. Heme acquisition mechanisms of Porphyromonas gingivalis-strategies used in a polymicrobial community in a heme-limited host environment[J]. Mol Oral Microbiol,2017,32(1):1-23.
[14] Yang QB,Yu FY,Sun L,et al. Identification of amino acid residues involved in hemin binding in Porphyromonas gingivalis hemagglutinin 2[J]. Mol Oral Microbiol,2015,30(5):337-346.
[15] DeCarlo AA,Huang Y,Collyer CA,et al. Feasibility of an HA2 domain-based periodontitis vaccine[J]. Infect Immun,2003,71(1):562-566.
[16] 孫璐,杨秋波,杨圣辉,等. 抗牙龈卟啉单胞菌血凝素2单克隆抗体的制备[J]. 中国微生态学杂志, 2011,23(4):332-334.
[17] Robert J,Palmer JR. Composition and development of oral bacterial communities[J]. Periodontol 2000,2014,64(1):20-39.
[18] Gao Y,Huang X,Zhu Y,et al. A brief review of monoclonal antibody technology and its representative applications in immunoassays[J]. J Immunoass Immunochem,2018,39(4):351-364.
[19] 王方,张泽财,袁悦,等. 伪狂犬病病毒gB蛋白单抗的制备及其夹心ELISA检测方法的建立[J]. 中国兽医学报,2020,40(2):225-230.
[20] 王朝元,黄圣,尹玉莹,等. 脊髓灰质炎病毒 I 型抗体胶体金检测试纸条的研制[J]. 中南民族大学学报,2019,38(4):509-515.
[21] Booth V,Ashley FP. Passive immunization with monoclonal antibodies against porphyromonas gingivalis in patients with periodontitis[J]. Infect Immun,1996,64(2):422-427.
[22] Imamura K,Takayama S,Saito A,et al. Evaluation of a novel immunochromatographic device for rapid and accurate clinical detection of Porphyromonas gingivalis in subgingival plaque[J]. J Microbiol Methods,2015,117:4-10.
[23] Zhu YC,An T,Liu Y,et al. Immunoprotective effects of a hemin-binding peptide derived from hemagglutinin-2 against infection with Porphyromonas gingivalis[J]. Mol Oral Microbiol,2017,33(1):81-88.
[24] 张风秋,李曙霞,杨连甲,等. 牙龈卟啉单胞菌牙龈蛋白酶K催化结构域融合蛋白的纯化及其多克隆抗体的制备[J]. 北京口腔医学,2011,19(4):202-205.
[25] José Marín M,Ambrosio N,OConnor A,et al. Validation of a multiplex qPCR assay for detection and quantification of Aggregatibacter actinomycetemcomitans,Porphyromonas gingivalis and Tannerella forsythia in subgingival plaque samples. A comparison with anaerobic culture[J].Archives of Oral Biology,2019,102:199-204.
[26] Ambrosioa N,José Marína M,Laguna E,et al. Detection and quantification of Porphyromonas gingivalis and Aggregatibacter actinomycetemcomitans in bacteremia induced by interdental brushing in periodontally healthy and periodontitis patients[J]. Archives of Oral Biology,2019, 98:213-219.
(收稿日期:2020-03-30)

