沙坡头地区地衣和藓类结皮丛枝菌根真菌多样性研究*
漆婧华刘玉冰†李新荣赵丽娜张雯莉王岩松
沙坡头地区地衣和藓类结皮丛枝菌根真菌多样性研究*
漆婧华1,2,刘玉冰1†,李新荣1,赵丽娜1,2,张雯莉1,2,王岩松1,2
(1. 中国科学院西北生态环境资源研究院,沙坡头沙漠试验研究站,兰州 730000;2. 中国科学院大学,北京 100049)
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是自然界分布最广的一类植物共生真菌,可与生物土壤结皮(Biological soil crust,BSC)的隐花植物形成共生体,对荒漠植被的恢复和演替具有重要意义。目前针对不同类型BSC的AMF群落结构及其多样性研究较少,限制了AMF群落对BSC发育的作用和对荒漠生态系统贡献的理解。利用高通量测序技术,对腾格里沙漠东南缘沙坡头固沙植被区地衣和藓类结皮及其下层土壤AMF群落组成与多样性进行研究,分析不同结皮类型AMF群落结构的差异。结果发现,AMF群落丰富度和多样性表现为:藓类结皮下层土壤>地衣结皮下层土壤>藓类结皮>地衣结皮。地衣和藓类结皮及其下层土壤AMF均属于球囊菌门、球囊菌纲,以球囊霉属、类球囊霉属、盾巨孢囊霉属、巨孢囊霉属和一种未分类属为优势,且地衣和藓类结皮AMF群落在属水平差异显著。主成分分析结果显示,藓类结皮下层土壤中AMF群落物种组成与其他各组有显著差异,表明随着结皮的发育,AMF群落多样性增加,结皮演替与AMF群落多样性之间具有相互促进的作用。
生物土壤结皮;丛枝菌根真菌;高通量测序技术;群落结构和多样性
荒漠生态系统是全球陆地生态系统的重要组成部分。在荒漠生态系统中,生物土壤结皮(Biological soil crust,BSC)占荒漠生态系统活体盖度的40%~70%。BSC是指隐花植物与土壤中的细菌、真菌等微小生物通过与土壤颗粒“胶结”形成的荒漠地表的一种生物覆盖体[1]。作为寒区、旱区严酷荒漠生境地表组成和景观的重要特征[1],BSC扮演了“生态系统工程师”的重要角色,能够有效地改善地表微生境,对荒漠生态系统的能流、物流、养分循环以及维管束植物的萌发、定居和繁衍等具有重要作用[2]。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是陆地生态系统最重要的土壤微生物之一,能与约80%的陆生高等植物根系形成寄生—共生统一体[3]。AMF从宿主植物获得碳水化合物,同时帮助其吸收水分和养分,促进植物的生长,提高植物对干旱、盐渍、重金属以及极端温度的耐受性[4-5]。AMF主导的菌根共生系统已成为应对全球变化的一种新型生物修复主体[6-7]。从生物进化的角度看,荒漠植物与AMF建立共生关系是适应水分和资源极度匮乏的荒漠生态系统双赢的重要生存策略[8]。
国内外对于荒漠生态系统AMF群落多样性已经进行了大量研究[9-11],在荒漠生境中已发现AMF寄主植物69科389种,AMF7属89种,且有新种不断出现[12]。菌根真菌与隐花植物共生的最早报道是在花斑烟杆藓()的孢蒴中发现了真菌菌丝[13]。近年来有关培养的AMF和苔藓植物共生的研究也越来越多,尤其Schüßler[14]在试管中培养与角苔()后使得该种研究更加深入。但关于荒漠生态系统重要组成部分BSC层AMF物种的多样性鲜有报道。最近,Hernández-Hernández等[15]提出AMF存在于BSC层,并认为AMF在养分匮乏和水分亏缺的荒漠生态系统中扮演着重要角色。然而,由于受到所研究BSC类型的限制,并没有考虑到BSC可能作为AMF的寄主植物。那么,BSC类型的变化是否会影响荒漠生态系统中AMF联合体的群落特征呢?本研究以腾格里沙漠东南缘固沙植被区典型地衣和藓类结皮及其下层土壤为对象,利用Illumina MiSeq测序技术研究地衣和藓类结皮中AMF群落结构组成和多样性,分析地衣和藓类结皮对AMF群落结构多样性的影响,以期探明结皮的演替与AMF群落多样性之间的关系。
1 材料与方法
1.1 研究区概况
试验区位于腾格里沙漠东南缘中国科学院沙坡头沙漠研究试验站的人工固沙植被区(37°32′ N,105°02′ E)。沙坡头人工固沙植被区始建于1956年,人工植被的建立使生态环境得到改善,表面的流沙得到固定,在固定的沙面上逐步形成包括藻类(algae)结皮、地衣(lichen)结皮、藓类(moss)结皮以及过渡混生结皮[1]的研究干旱区生态恢复的以空间代替时间的经典演替序列。该区属干旱、半干旱气候过渡区,海拔1 250 m,年均温9.6℃,最高温38.1℃,最低温–25.1℃,年均降水量186.2 mm(1956—2012年),70%的降水主要集中在6—9月,年潜在蒸发量为2 300~2 500 mm,主要集中在生长季(5—9月)。目前,该区人工植被主要物种有花棒()、柠条()、油蒿()、小画眉草()等。
1.2 样品采集
以研究区分布最广泛的地衣和藓类结皮及其下层土壤为研究对象,选取相对均质且发育完好的实验区。在实验区内选取10 m´10 m的大样方,再在大样方内随机选取3个0.1 m´0.1 m的小样方,按照“五点混合法”进行采样。采样时用无菌手术刀垂直切取完整的BSC层样品及BSC下层土壤(0~5 cm),迅速放入4℃的保温箱中带回实验室。样品命名为:LB:地衣结皮;MB:藓类结皮;LBS:地衣结皮下层土壤;MBS:藓类结皮下层土壤。所有样品过2mm筛去除大颗粒和植物根后保存于–80℃,用于群落结构的分子生物学分析。
1.3 DNA提取和PCR扩增
采用试剂盒Fast DNA® SPIN Kit for Soil(QBIOgene Inc.,Carlsbad,CA,USA)提取样品DNA。参考Stockinger[16]和Krüger[17]等的方法,选用AML1/AML2为第一对引物[18],AMV4.5NF/ AMDGR[19]为第二对引物,采用巢式PCR的方法扩增18S rDNA片段。扩增得到的PCR产物用2%琼脂糖凝胶电泳检测后,利用Illumina MiSeq测序技术对样品进行测序(Illumina MiSeq测序委托上海美吉生物医药科技有限公司完成)。
1.4 生物信息学及统计学分析
使用FLASH、Trimmomatic软件对原始序列进行数据去杂和质控过滤,得到优化数据。利用上海美吉生物医药科技有限公司I-sanger云平台提供的数据处理软件进行数据处理分析。基于Usearch软件平台对得到的高质量序列按照97%的相似度进行操作分类单元(Operational taxonomic units,OTU)的聚类,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,比对数据库为Silva的真菌18S rRNA数据库。基于OTU聚类和注释的结果,利用R语言工具绘制稀释性曲线、Venn图和群落组成分析图,并通过mothur指数分析软件进行Alpha(α)多样性指数的计算。其他数据分析和作图利用SPSS 22.0和Origin 9.0软件完成。
2 结 果
2.1 测序样本的质量检测和稀释性曲线
通过Miseq平台对4组样品进行测序,共获得176 175条原始序列,经数据去杂后获得132 636条优化序列,97%相似水平下聚类分析后共获得56个AMF操作分类单元(OTU)。对测序样品中的序列进行随机抽样,以测序数据量为横坐标,各测序量下微生物多样性指数(香农指数)大小为纵坐标获得稀释性曲线如图1所示。从图中可以看出,当测序量达到200条左右时曲线趋于平坦,香农指数不再增加,说明测序数据量足够大,可以充分反映样本中绝大多数的微生物多样性信息。

注:LB、MB、LBS、MBS分别代表地衣结皮、藓类结皮、地衣结皮下层土壤和藓类结皮下层土壤;下同。Note:The letters LB,MB,LBS and MBS stands for lichen crusts,moss crusts,underlying soils of lichen crusts and underlying soils of moss crusts,respectively. The same below.
统计地衣、藓类结皮及其下层土壤中共有和特有的OTU数目,选用相似水平为97%的OTU样品表画出维恩图,如图2所示。LB、MB、LBS、MBS样品分别有23、18、26和22个OTUs,各组特有OTU数目分别为11、6、7和12个,MBS样品中特有OTU数目占到所有OTU数目的54.5%。两两比较共有OTU数目,依次排序为:LB与LBS组(12个)、LBS与MB组(11个)、LB与MB组(9个)、LBS与MBS组(9个)、MB与MBS组(5个)、LB与MBS组(4个)。其中LB与LBS组共有的OTU数目最多,占到总OTU数的21.43%;LB与MBS组共有的OTU数目最少,占总OTU数的7.14%。所有样品共同包含的OTU数目仅为4个,占总OTU数目的7.14%。说明不同样品中含有相同物种,但占比较小;地衣结皮与地衣结皮下层土壤AMF群落物种组成最为相似,地衣和藓类结皮下层土壤之间AMF群落物种组成差别最大。
2.2 AMF群落多样性
地衣、藓类结皮及其下层土壤AMF群落多样性指数如表1所示,群落丰富度和多样性指数均表现出藓类结皮下层土壤高于地衣结皮下层土壤高于藓类结皮高于地衣结皮的变化趋势。说明AMF群落丰富度和多样性指数藓类结皮下层土壤最大,地衣结皮最小,且藓类结皮下层土壤AMF群落多样性与其他各组有显著差异;且结皮下层土壤高于结皮层,藓类结皮高于地衣结皮。
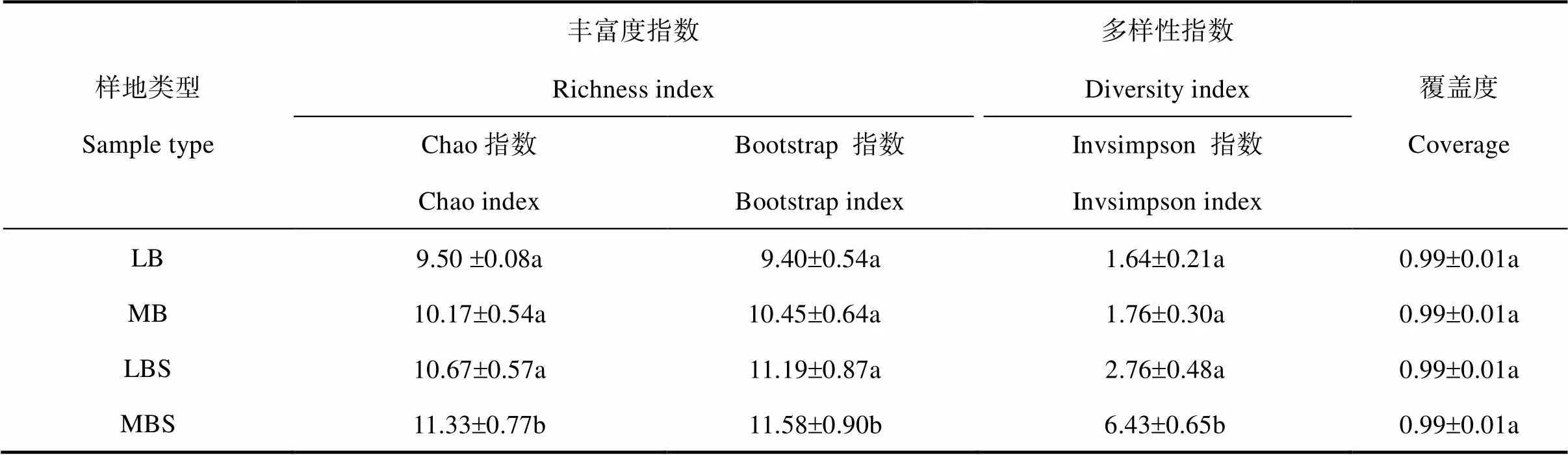
表1 地衣、藓类结皮及其下层土壤AMF群落丰富度与多样性指数
注:平均值±标准误差,=3,不同字母表示在<0.05水平下有显著差异。Note:Means±standard error,=3. Different letters indicate significant difference at 0.05 level.
2.3 AMF群落组成
群落组成分析结果表明,样本中检测到的OTUs分属于球囊菌门、球囊菌纲的4目、5科、6属。在目分类水平上(图3a),除只能分类到球囊菌纲的物种外,按照相对丰度大小排序依次为:球囊霉目(Glomerales,6.69%~99.99%)、类球囊霉目(Paraglomerales,0~20.91%)和多样孢囊霉目(Diversisporales,25.22%)。

图3 地衣、藓类结皮及其下层土壤目(a)、科(b)和属(c)分类水平上AMF群落组成
科分类水平的AMF群落组成如图3b所示,按照相对丰度大小依次为:只能分类到球囊菌纲的物种(f_unclassified_c_Glomeromycetes,6.69%~99.99%)和球囊霉科(Glomeraceae,0.01%~47.18%)、类球囊霉科(Paraglomeraceae,0.01%~20.91%)、巨孢囊霉科(Gigasporaceae,0~21.10%)、多样孢囊霉科(Diversisporaceae,0~4.13%)物种。其中球囊霉目进一步分类为球囊霉科;类球囊霉目分类为类球囊霉科;藓类结皮下层土壤中多样孢囊霉目分类为巨孢囊霉科和多样孢囊霉科。
在属分类水平(图3c),AMF群落按照相对丰度大小依次为:只分类到纲的球囊菌纲物种(g_unclassified_c_Glomeromycetes,6.69%~99.99%)和分类到属的球囊霉属(,19.55%~47.18%)、类球囊霉属(,0.01%~20.91%)、盾巨孢囊霉属(,13.37%)、巨孢囊霉属(,7.72%)以及只能分类到科的多样孢囊霉科物种(g_unclassified_ f_Diversisporaceae,4.13%)。其中,球囊霉科分类为球囊霉属,类球囊霉科分类为类球囊霉属,藓类结皮下层土壤中巨孢囊霉科进一步分类为盾巨孢囊霉属和巨孢囊霉属。
2.4 不同BSC对AMF属水平物种丰度的影响
图4为地衣、藓类结皮及其下层土壤中AMF属水平的物种相对丰度图。从图中可以看出,地衣结皮中AMF主要由仅能分类到球囊菌纲的物种(占到99.99%)组成,极少部分分类到球囊霉属(仅占0.01%)和类球囊霉属(少于0.01%);藓类结皮主要由未能分类到属的球囊菌纲物种(66.48%)和球囊霉属(33.52%)物种组成;地衣结皮下层土壤主要由未能分类到属的球囊菌纲物种(74.29%)和分类到属的球囊霉属(19.55%)、类球囊霉属(6.16%)物种组成;藓类结皮下层土壤由未能分类到属的球囊菌纲(6.69%)、多样孢囊霉科(4.13%)物种和分类到属的球囊霉属(47.18%)、类球囊霉属(20.91%)、盾巨孢囊霉属(13.37%)、巨孢囊霉属(7.72%)物种组成。其中藓类结皮下层土壤中仅能分类到球囊菌纲的物种显著降低(<0.05),而类球囊霉属的物种显著增加(<0.05)。
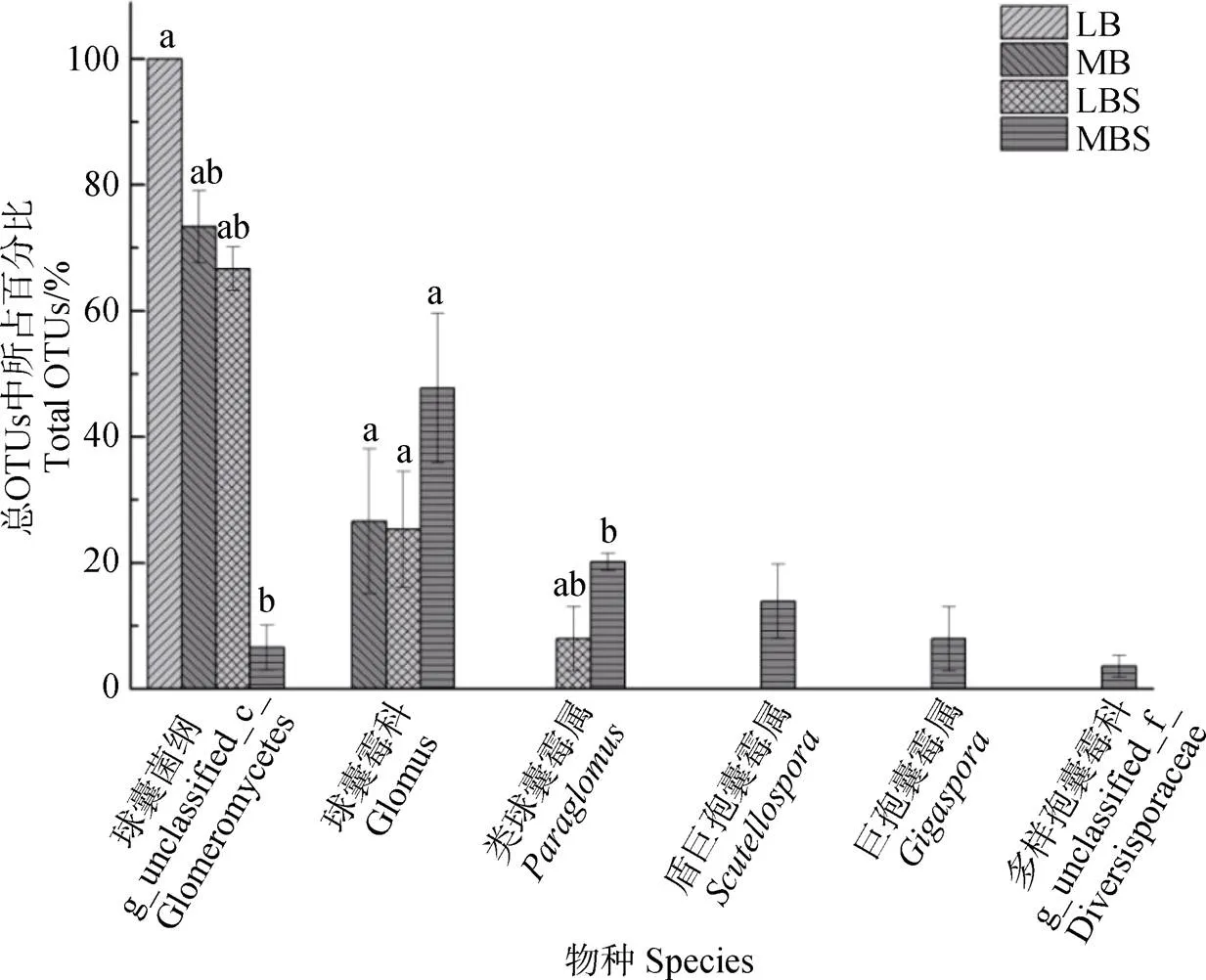
注:图中不同小写字母表示处理间差异显著(P<0.05)。Note:Different letters indicate significant difference at 0.05 level.
分析可知,地衣结皮和地衣结皮下层土壤中AMF物种完全相同,只是相对丰度不同。与地衣结皮及其下层土壤相比,藓类结皮中仅存在未能分类到属的球囊菌纲物种和球囊霉属物种,未发现类球囊霉属的物种。藓类结皮下层土壤中除出现了其他3个样品中所有物种外,还出现了未能分类到属的多样孢囊霉科物种和分类到属的类球囊霉属、盾巨孢囊霉属、巨孢囊霉属物种。未能分类到属的球囊菌纲物种和球囊霉属物种在四种样品中同时存在,只是相对丰度不同,说明未能分类到属的球囊菌纲物种和球囊霉属物种属于该区生物土壤结皮区的优势菌群。未能分类到属的球囊菌纲物种在藓类结皮下层土壤中显著降低;类球囊霉属物种在地衣结皮下层土壤和藓类结皮下层土壤中出现且二者之间差异不显著,但与地衣结皮和藓类结皮有显著差异,说明类球囊霉属可能是周围环境中植物共生菌。主成分分析(Principal Component Analysis,PCA)如图5所示,前两轴解释了76%的群落变异,藓类结皮下层土壤AMF群落与其他各组相比位置发生了明显的变化,说明藓类结皮下层土壤AMF群落组成与其他各组有显著的差异。

图5 地衣、藓类结皮及其下层土壤AMF群落主成分分析
3 讨 论
AMF专性共生的特性是传统微生物生态学研究的最大障碍。近年来,随着分子生物学技术和新一代测序技术的快速发展和应用,使得AMF的研究更加全面和准确。包美丽[9]的研究发现,鄂尔多斯沙地生物土壤结皮AMF种类优势菌属为球囊霉属、无梗囊霉属()、多孢囊霉属和盾巨孢囊霉属。包玉英[20]通过对内蒙古典型荒漠群落AMF种类的研究发现,球囊霉属种类、频度最高,球囊霉属和无梗囊霉属是该区的优势属,其次为巨孢囊霉属和盾巨孢囊霉属。Wang等[21]对毛乌素沙漠AMF群落结构和多样性的研究发现,来自不同土壤深度和植物的AMF属的组成中,球囊霉属、无梗囊霉属和盾巨孢囊霉属占总数的70%以上,多样孢囊霉属和巨孢囊霉属仅在浅层土壤中发现。我们对腾格里沙漠东南缘沙坡头地区地衣和藓类结皮及其下层土壤AMF群落的研究结果与前人基本一致,主要由未能分类到属的球囊菌纲物种、多样孢囊霉科物种和分类到属的球囊霉属、类球囊霉属、盾巨孢囊霉属和巨孢囊霉属物种组成。其中,未能分类到属的球囊菌纲物种和球囊霉属物种属于优势菌群。鄂尔多斯沙地、内蒙古典型荒漠以及毛乌素沙漠AMF群落中均出现了无梗囊霉属物种,但本研究结果中未发现。已有研究表明[20,22],AMF多样性及分布不仅与海拔及气候因子中年降水量、年均温显著相关,还与土壤pH、有机质及N、P含量等显著相关。包玉英和闫伟[23]对蒙古韭()共生真菌及其菌根形态学的研究表明,沙坡头地区AMF优势种与其他沙地有较大差异。此外,有研究表明[24]宿主植物也会影响AMF的多样性。所以推测一方面可能与所研究的宿主植物不同有关,另一方面未分类到属的球囊菌纲物种中可能存在该地区特有的无梗囊霉属新物种,未能和已有无梗囊霉属物种序列库进行比对,需要通过其他鉴定方法进一步确定。
球囊霉属物种同时出现在藓类结皮、地衣结皮下层土壤和藓类结皮下层土壤中;与结皮层相比,地衣和藓类结皮下层土壤中出现了类球囊霉属物种,而巨孢囊霉科的盾巨孢囊霉属、巨孢囊霉属和只能分类到科水平的多孢囊霉科物种仅在藓类结皮下层土壤中出现。说明球囊霉属的物种可能是藓类植物共生菌属,地衣结皮下层土壤中球囊霉属物种可能来源于周围环境。类球囊霉属物种仅在地衣结皮下层土壤和藓类结皮下层土壤中出现,推测该物种很有可能属于该区周围环境中植物共生菌,还需要通过对周围环境中植物共生AMF进一步研究从而找到其具体来源。盾巨孢囊霉属、巨孢囊霉属和只能分类到科的多样孢囊霉科物种仅在藓类结皮下层土壤中出现,推测这几种物种很有可能也属于藓类植物共生菌,对于在藓类结皮中未发现的原因还需要进一步探究。
本研究AMF群落丰富度和多样性结果表现为藓类结皮下层土壤高于地衣结皮下层土壤高于藓类结皮高于地衣结皮。结皮下层土壤AMF群落丰富度和多样性高于结皮层土壤,这与前人的研究结果一致[9]。BSC形成的早期阶段,随着土壤微生物在沙土表面的生长,逐渐形成以藻类植物为主体的藻结皮[1]。藻类植物的定居,使得土壤微环境得到有效的改善,地衣植物开始在此定植。藻类和地衣植物使得沙土结构得以改善,当土壤表面得到一定固定后,开始形成以地衣和苔藓植物为优势的生物结皮类型[25-29]。相对干燥、稳定的地表景观形成多以地衣为主的BSC[1,30-31],相对潮湿的局部土表或有利于集结雨水以及能产生凝结水的微地形有利于藓类结皮的拓殖和繁衍,这些部位被藓类为优势种的BSC所替代[1]。此外,物种组成分析结果表明,藓类结皮下层土壤中包括了地衣结皮、藓类结皮以及地衣结皮下层土壤中出现的所有物种;PCA分析结果表明,藓类结皮下层土壤中AMF群落与其他各组有显著差异。物种组成分析与PCA分析结果一致。说明随着BSC的发育演替,土壤环境得到了逐步改善,AMF群落多样性逐渐增加。同时,由于AMF与植物的共生,有效地改善了微生境,提高了植物对恶劣环境的适应,反过来可以促进BSC的发育,从而加速荒漠生态系统的恢复。
4 结 论
沙坡头地区地衣和藓类结皮中共鉴定出AMF 4目、5科、6属。其中,属为优势种,其次为和属的真菌种类,而属的种类较少。不同土层中分布的AMF种类有一定的差异,藓类结皮下层土壤中包括了地衣结皮、地衣结皮下层土壤及藓类结皮中出现的所有AMF种类。结皮的发育与AMF群落多样性之间有明显的相互促进作用,AMF群落多样性结皮下层土壤高于结皮层,藓类结皮高于地衣结皮,且藓类结皮下层土壤显著高于其他各组。
[1] Li X R. Eco-hydrology of biological soil crusts in desert regions of China[M]. Beijing:Higher Education Press,2012. [李新荣. 荒漠生物土壤结皮生态与水文学研究[M]. 北京:高等教育出版社,2012.]
[2] Li X R,Hui R,Zhao Y. Eco-physiology of biological soil crusts in desert regions of China[M]. Beijing:Higher Education Press,2017. [李新荣,回嵘,赵洋. 中国荒漠生物土壤结皮生态生理学研究[M]. 北京:高等教育出版社,2017.]
[3] Wang B,Qiu Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants[J]. Mycorrhiza,2006,16(5):299—363.
[4] Liu M,Zheng R,Bai S L,et al. Advances of species diversity of arbuscular mycorrhizal fungi[J]. Microbiology China,2016,43(8):1836—1843. [刘敏,峥嵘,白淑兰,等. 丛枝菌根真菌物种多样性研究进展[J]. 微生物学通报,2016,43(8):1836—1843.]
[5] Xu L J,Zhang J Z,Yuan Y Q,et al. Effects of arbuscular mycorrhizal fungi and plant growth-promoting rhizobacteria on remediation of soil polluted with methamidophos[J]. Acta Pedologica Sinica,2016,53(4):919—929. [徐丽娟,张金政,袁玉清,等. AMF和PGPR修复甲胺磷污染土壤的效应[J]. 土壤学报,2016,53(4):919—929.]
[6] Asmelash F,Bekele T,Birhane E. The potential role of arbuscular mycorrhizal fungi in the restoration of degraded lands[J]. Frontiers in Microbiology,2016,7:1095. https://doi.org/10.3389/fmicb.2016.01095.
[7] Rajtor M,Piotrowska-Seget Z. Prospects for native arbuscular mycorrhizal fungi community to assist in phytoremediation of soil hydrocarbon contaminants[J]. New Biotechnology,2016,33:S141—S142.
[8] Wu N,Zhang J,Wang Y,et al. Effects of snow cover and arbuscular mycorrhizal fungi network on the seedling growth of erodium oxyrrhynchum[J]. Arid Zone Research,2018,35(3):624—632. [吴楠,张静,王玥,等. 积雪和丛枝菌根真菌网络对尖喙牻牛儿苗幼苗生长的影响[J]. 干旱区研究,2018,35(3):624—632.]
[9] Bao M L. The diversity and ecological distribution of AM fungi in desert biological soil crus[D]. Hohhot:Inner Mogolia University,2009. [包美丽. 沙地生物结皮层AM真菌多样性及生态分布[D]. 呼和浩特:内蒙古大学,2009.]
[10] Wu B Y,Hogetsu T,Isobe K,et al. Community structure of arbuscular mycorrhizal fungi in a primary successional volcanic desert on the southeast slope of Mount Fuji[J]. Mycorrhiza,2007,17(6):495—506.
[11] Shi Z Y,Liu D H,Wang F Y. Spatial variation of arbuscular mycorrhizal fungi in two vegetation types in Gurbantonggut Desert[J]. Contemporary Problems of Ecology,2013,6(4):455—464.
[12] He X L,Chen Z,Guo H J,et al. Diversity of arbuscular mycorrhizal fungi in the rhizosphere ofKom. in desert zone[J]. Acta Ecologica Sinica,2012,32(10):3041—3049. [贺学礼,陈烝,郭辉娟,等. 荒漠柠条锦鸡儿AM真菌多样性[J]. 生态学报,2012,32(10):3041—3049.]
[13] Raven J A. Long-distance transport in non-vascular plants[J]. Plant,Cell and Environment,2003,26(1):73—85.
[14] Schüßler A.forms an arbuscular mycorrhiza-like symbiosis with the hornwort[J]. Mycorrhiza,2000,10(1):15—21.
[15] Hernández-Hernández R M,Roldán A,Caravaca F,et al. Arbuscular mycorrhizal fungal assemblages in biological crusts from a Neotropical savanna are not related to the dominant perennial[J]. Science of the Total Environment,2017,575:1203—1210.
[16] Stockinger H,Krüger M,Schüßler A. DNA barcoding of arbuscular mycorrhizal fungi[J]. New Phytologist,2010,187(2):461—474.
[17] Krüger M,Krüger C,Walker C,et al. Phylogenetic reference data for systematics and phylotaxonomy of arbuscular mycorrhizal fungi from phylum to species level[J]. New Phytologist,2012,193(4):970—984.
[18] Lee J,Lee S,Young J P W. Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J]. FEMS Microbiology Ecology,2008,65(2):339—349.
[19] Sato K,Suyama Y,Saito M,et al. A new primer for discrimination of arbuscular mycorrhizal fungi with polymerase chain reaction-denature gradient gel electrophoresis[J]. Grassland Science,2005,51(2):179—181.
[20] Bao Y Y. Diversity and ecological distribution of arbuscular mycorrhizal association in the grassland and desert of Inner Mongolia[D]. Hohhot:Inner Mongolia Agricultural University,2004. [包玉英. 内蒙古草原和荒漠丛枝菌根共生多样性及其生态分布[D]. 呼和浩特:内蒙古农业大学,2004.]
[21] Wang K,He X L,Xie L L,et al. Arbuscular mycorrhizal fungal community structure and diversity are affected by host plant species and soil depth in the Mu Us Desert,northwest China[J]. Arid Land Research and Management,2018,32(2):198—211.
[22] Zhang M Q,Wang Y S,Zhang C,et al. The ecological distribution characteristics of some genera and species of vam fungi in Northern China[J]. Acta Mycologica Sinica,1994(3):166—172. [张美庆,王幼珊,张弛,等. 我国北方VA菌根真菌某些属和种的生态分布[J]. 真菌学报,1994(3):166—172.]
[23] Bao Y Y,Yan W. Mycorrhizal morphology and associated fungi of[J]. Mycosystema,2004,23(2):286—293. [包玉英,闫伟. 蒙古韭共生真菌及其菌根形态学的研究[J]. 菌物学报,2004,23(2):286—293.]
[24] Zhang M Q,Wang Y S. Seven species of VA mycorrhizal fungi from northern China[J]. Mycosystema,1991,10(1):13—21. [张美庆,王幼珊. 我国北部的七种VA菌根真菌[J]. 真菌学报,1991,10(1):13—21.]
[25] Eldridge D J. Distribution and floristics of terricolous lichens in soil crusts in arid and semi-arid New South Wales,Australia[J]. Australian Journal of Botany,1996,44(5):581.
[26] Scott G A M. Desert bryophytes[M]//Bryophyte ecology. Dordrecht:Springer Netherlands,1982:105—122.
[27] West N E. Structure and function of microphytic soil crusts in wildland ecosystems of arid to semi-arid regions[M]//Advances in Ecological Research. Elsevier Ltd.,1990:179—223.
[28] Smith E P. Niche breadth,resource availability,and inference[J]. Ecology,1982,63(6):1675—1681.
[29] Zhang Y M,Wang X Q. Summary on formation and developmental characteristics of biological soil crusts in desert areas[J]. Acta Ecologica Sinica,2010,30(16):4484—4492. [张元明,王雪芹. 荒漠地表生物土壤结皮形成与演替特征概述[J]. 生态学报,2010,30(16):4484—4492.]
[30] Belnap J,Phillips S L. Soil biota in an ungrazed grassland:Response to annual grass()invasion[J]. Ecological Applications,2001,11(5):1261—1275.
[31]Li X R,Zhang Y M,Zhao Y G. A study of biological soil crusts:Recent development,trend and prospect[J]. Advances in Earth Science,2009,24(1):11—24. [李新荣,张元明,赵允格. 生物土壤结皮研究:进展、前沿与展望[J]. 地球科学进展,2009,24(1):11—24.]
AMF Diversity Analysis of Lichen and Moss Biocrusts in Shapotou Region
QI Jinghua1, 2, LIU Yubing1†, LI Xinrong1, ZHAO Lina1, 2, ZHANG Wenli1, 2, WANG Yansong1, 2
(1. Shapotou Desert Research and Experimental Station, Northwest Institute of Eco-environment and Resource, Chinese Academy of Sciences, Lanzhou 730000, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
【】Arbuscular mycorrhizal fungi (AMF) are one of the most widely distributed plant symbiotic fungi in nature. They can form symbiont with cryptogam in biological soil crust (BSC), which is of great significance to the restoration and succession of desert vegetation. However, there are few studies on AMF community structure and diversity in different BSCs types, which limited the understanding of the roles of AMF community in the development of BSCs and its contribution to desert ecosystems. So, will the changes of BSC type affect the community characteristics of AMF complexes in desert ecosystems? 【】 In view of the problems mentioned above, this study was based on enclosed revegetation sites in the southeast fridge of the Tengger Desert located at the Shapotou Desert Research &Experiment Station, with the lichen and moss crusts and their underlying soils as the research object. We used high-throughput sequencing technologies studied the AMF community structure composition and diversity of lichen, moss crusts and their underlying soils, and to determine whether different BSCs types will cause differences in AMF community characteristics. 【】 The following results were obtained. AMF community richness and diversity index of the underlying soils of moss crusts were the largest and the underlying soils of lichen crusts were the smallest. The AMF community diversity of the underlying soils of moss crusts is significantly different from other groups. The richness and diversity of AMF community of underlying soils were higher than crusts layers, and moss crusts was higher than lichen cursts. The AMF in the lichen and moss crusts and their underlying soils consisted by Glomeromycetes, Glomeromycota. At the genus level, one unclassified species(g_unclassified_c_Glomeromycetes, 6.69%-99.99%)and(19.55%-47.18%),(0.01%-20.91%),(13.37%) and(7.72%) were the dominant species, and the species that could be classified into Diversisporaceae (g_unclassified_f_Diversisporaceae, 4.13%) were quite limited in percentage. The species of AMF community in the lichen crusts and their underlying soils were exactly the same in composition, but their relative abundance was different. Compared with lichen crusts and their underlying soils, only the species of Glomeromycetes andwere found in the moss crusts, and the species ofcould not be found. Except for species that appeared in the other samples, there were also found an unclassified Diversisporaceae species and,,in the underlying soils of moss crusts. The species of the unclassified Glomeromycota andwere coexisted in all samples, but the relative abundance was different, which indicates that they belonged to the dominant fungi in the BSCs of this area. The species ofwere found in the underlying soils of lichen and moss crusts, and the difference between them was not significant, but there were significant differences with lichen and moss crusts, which suggested thatmay be the plant symbiotic fungi in the surrounding environment. 【】 With the development of BSCs, the diversity of AMF community increased, and the succession of BSC and diversity of AMF communities can promote each other.
Biological soil crust; Arbuscular mycorrhizal fungi; Illumina MiSeq high-throughput sequencing technique; Community structure and diversity
Q938.1
A
10.11766/trxb201904190054
漆婧华,刘玉冰,李新荣,赵丽娜,张雯莉,王岩松. 沙坡头地区地衣和藓类结皮丛枝菌根真菌多样性研究[J]. 土壤学报,2020,57(4):986–994.
QI Jinghua,LIU Yubing,LI Xinrong,ZHAO Lina,ZHANG Wenli,WANG Yansong. AMF Diversity Analysis of Lichen and Moss Biocrusts in Shapotou Region[J]. Acta Pedologica Sinica,2020,57(4):986–994.
* 国家自然科学基金项目(41977204)资助 Supported by the National Natural Science Foundation of China(No. 41977204)
,E-mail:liuyb@lzb.ac.cn
漆婧华(1990—),女,甘肃定西人,博士研究生,研究方向为微生物生态学。E-mail:qijinghua18@mails.ucas.ac.cn
2019–04–19;
2019–07–22;
2019–09–03
(责任编辑:卢 萍)

