珠江口自源有机颗粒物沉降对沉积物反硝化过程的影响
岳维忠, 孙翠慈, 施平, 洪义国, 何伟宏, 王友绍, 3, 4
珠江口自源有机颗粒物沉降对沉积物反硝化过程的影响
岳维忠1, 2, 3, 孙翠慈2, 3, 4, *, 施平2, 洪义国5, 何伟宏3, 6, 王友绍2, 3, 4
1. 中国科学院大学, 北京 100049 2. 热带海洋环境国家重点实验室, 中国科学院南海海洋研究所, 广州 510301 3. 南方海洋科学与工程广东省实验室(广州), 广州 511458 4. 大亚湾海洋生物综合实验站, 中国科学院南海海洋研究所, 深圳 518121 5. 大湾区环境研究院, 广州大学, 广州 510006 6. 中国科学院南海海洋研究所, 广州 510301
由微生物主导、依赖有机物供给的反硝化过程是珠江口氮移除的主要途径之一, 可有效地将生态系统中的固定氮转化为N2或N2O 释放到大气中。珠江口水体存在大量富含多糖和蛋白的生源有机颗粒物, 该类有机颗粒物沉降到底层, 影响反硝化过程的机制迄今尚不明确。通过培养实验, 分析了富含蛋白的中肋骨条藻()和多糖颗粒对珠江口沉积物反硝化速率和反硝化功能基因的影响。研究结果表明: 这两类有机物的添加能够刺激微生物矿化过程的发生, 16S rRNA丰度和反硝化过程有关的基因Z 与S丰度显著提高, 矿化发生同时能够有效的为沉积物脱氮过程提供碳源与能量, 提高了反硝化速率。就有机质可利用性而言, 富含蛋白的中肋骨条藻和多糖的生物利用性存在差异, 在添加中肋骨条藻组中, 因有机质中蛋白含量高于多糖组, 有机质降解速率高于多糖组, 其可利用性高于多糖类有机质, 并且蛋白类物质矿化过程中产生的NH4+也比多糖组高, NH4+通过硝化作用转换为硝酸盐, 继续为反硝化过程提供硝酸盐, 因此添加中肋骨条藻组反硝化速率显著高于添加多糖组。总之水体中生源有机颗粒沉降促进了沉积物—水界面中氮移除过程, 并且这种促进作用与生源有机颗粒的可利用性呈正相关。
自源有机颗粒物; 蛋白类颗粒物; 多糖类颗粒物; 反硝化; 珠江口
0 前言
在上世纪八十年代, 珠江河流水体有机碳主要来自陆源土壤有机碳[1-3], 珠江浮游植物的初级生产量不足以影响河口POC 的分布[4-6]。但上世纪90年代以后, 珠江上游的大型水库拦截作用导致入海泥沙、悬浮颗粒物和陆源输入的有机碳浓度减小[7]。相反, 随着珠江流域和沿海地区人为活动影响的不断加剧, 大量的人为活性氮输入到该生态系统使珠江口的营养盐大量增加, 促进了浮游植物的生长[8,9]。因此, 珠江口有机物的来源在最近30年发生了一定的变化, 尤其在虎门以下的南部海域, 河口自源生物颗粒物对有机物贡献加大[8,9]。有报道生源颗粒物中包含了大量生源凝胶颗粒物, 一类以多糖为骨架的聚合颗粒物[10], 一类是可以被考马斯亮蓝染色的蛋白类颗粒物。这两类聚合颗粒物具有一定的吸附粘性, 可以吸附有机和无机颗粒物, 改变颗粒物的沉降速度, 并且在珠江河口湾底层的分布高于表层。在珠江流域, 约有80%悬浮物沉降在珠江口, 20% 被输送出邻近海域[11]。这两类颗粒物在珠江口迁移过程中, 垂直沉降使河口底层富集大量此类有机颗粒物, 说明河口对其捕获作用强烈[10]。
就两种生源颗粒物的可利用性而言, 以酸性多糖为骨架的颗粒物, 因有机氮含量低不易被细菌降解[12], 此类颗粒物通常具有较高的C/N 比值(C/N≥14)[13], 并且在沉降过程中, 细菌的吸收和改造使其粘性增强, 进而提高了颗粒物的聚集和沉降速度[14], 同时被细菌吸收利用性进一步降低[15,16]。He等研究表明珠江口沉积物糖类不仅是有机碳重要组分之一, 并且在中下游多糖含量占总碳水化合物最高达80%, 是糖类中占比最大的成分[17], 与此契合的是Sun 等在珠江口底层水中发现大量由酸性多糖形成的大粒径絮团, 尤其在盐度10—25的河口地带富集明显[10]。
近三十年来, 珠江流域大量的活性氮通过河流排放至珠江口水域, 导致珠江口水体富营养化严重, 而由微生物主导、依赖有机物供给能量的反硝化过程是珠江口氮移除的主要途径之一, 可有效地将生态系统中的固定氮转化为N2或N2O 释放到大气中[18-20]。在自然环境条件下, 有机物是反硝化过程的能量基础, 同时有机质矿化产生的NH4+进一步硝化反应生成NO3-, 为反硝化提供营养盐物质, 因此有机物的浓度高低也会在一定程度上控制着脱氮速率[21]。另外, 有机物矿化过程伴随着沉积物中的溶解氧消耗, 改变沉积物中的氧化还原条件, 进而影响沉积物脱氮过程[22]。到目前为止, 涉及生源大分子颗粒有机物对氮移除过程的效应研究未见报道, 尤其是在珠江口存在大量蛋白与多糖有机颗粒的背景下, 探讨它们对沉积物氮移除过程的影响, 有助于深入了解沉积物中所发生的有关化学和生物过程。
1 材料与方法
1.1 研究区域与样品采集
本试验选取盐度范围约15—20、泥质区水动力条件影响下的站点作为研究对象, 该区域上层初级生产力较高, 由于沉降作用使底层水富集了大量自产生源颗粒有机物。于2017年7月在珠江口站点(东经113.7221°, 北纬22.2574°, 水深9 m)采集沉积物开展实验。
1.2 实验设计
硅藻中肋骨条藻()是珠江口伶仃洋及外海口区域优势种。本实验以中肋骨条藻不同时期的培养物(富含蛋白和多糖)作为添加物, 以此模拟上层自源颗粒有机物沉降到沉积物-水界面层后, 沉积物脱氮过程对可利用性有机物输入的响应。
1.2.1 富含蛋白和多糖有机颗粒来源
使用富含硅酸盐的F/2培养基培养中肋骨条藻, 光照和黑暗培养时间为14: 10 h, 光照强度190 μmol photons·m–2·s–2, 培养期间监测蛋白颗粒动态变化, 72 h指数生长期时培养液中可被考马斯亮蓝染色的蛋白颗粒含量最高, 以小牛血清为标准换算其含量为3039.7±393.2 μg BSA eq·L-1(BSA, 小牛血清))。在指数生长期时离心收集藻类, 藻类细胞内蛋白和总碳水化合物之比为0.72, 然后-80 ℃冷冻干燥, 获得富含蛋白的藻粉备用。
另外将静止期的中肋骨条藻()(此阶段多糖颗粒含量最高)培养液中加入未经处理的珠江口海水(体积比例10: 1), 避光培养9 d(参照以往实验, 0—9 d内多糖颗粒含量波动下降64.5%, 而且粘性增强, 第9 天后呈缓慢下降趋势), 使用截留分子量1000 Da的透析袋透析36 h, 去除小分子和盐分, 然后加入乙醇低温沉淀多糖12 h, 分别加入乙醇进行3次沉淀, 最后合并沉淀物, 使用超纯水清洗去除乙醇, 冷冻干燥获得经过细菌降解后的多糖。
1.2.2 培养实验
沉积物用直径5 cm的浅海无扰动采样器采集, 采集多管沉积物。用镊子轻轻将大型和微型生物群落去除, 再将沉积物转移到直径5.0 cm的培养管内。培养管中沉积物的深度为10 cm。开展沉积物实验时, 将藻粉和多糖分别溶于10 mL过滤后上覆水中, 然后用吸管轻轻转移到沉积物上, 再用塑料医用压舌铲轻轻搅拌表层1 cm的沉积物, 与添加物混合均匀。试验分为3组, 第一组为添加中肋骨条藻组, 该组富含蛋白, 添加量为沉积物中添加6 mg·cm–2中肋骨条藻, 简称为S+。第二组为多糖组, 添加量为沉积物中添加4 mg·cm–2多糖(Polysaccharides), 简称PS+。未添加的为对照组, 简称为C。添加量参照以往对珠江口初级生产力和颗粒有机碳沉降通量的研究结果[17,23]。在沉积物面上继续充入过滤后的底层水, 调整上覆水高度10 cm。将培养管用橡胶塞密封防止漏气。在每个培养管内中距沉积物上方约7 cm 处, 悬置1 个磁力搅拌子, 将培养管置于水浴恒温同步培养箱中。培养箱中央的电动磁力器转速为1 圈每秒, 将水浴温度调整到沉积物的现场温度后, 启动电磁搅拌器, 开始培养实验。
于第0, 3, 6, 9天测定沉积物硝化与反硝化速率和其它指标。沉积物经4800 r·min–1离心, 然后过滤上清液获得间隙水, 经0.45 µm的醋酸纤维滤膜过滤, -18℃冷冻保存。上覆水样品处理保存方式与间隙水样品相同, 经0.45 µm的醋酸纤维滤膜过滤后冷冻保存滤液。另外取少量表层沉积物样品, -80℃冷冻保存, 取部分样品用于 DNA 提取以测定沉积物S、Z 和 16S rRNA 基因丰度和碳水化合物。
1.3 指标测定
1.3.1 硝化与反硝化速率
测定采用乙炔抑制法, 参照徐继荣等对Kim方法改进后的方法进行采集样品、培养实验和分析[20]。这一方法的原理是, 一定浓度的乙炔不仅能抑制氧化亚氮还原酶的活性使反硝化过程停留在N2O 阶段, 而且能抑制NH4+被氧化为NO3-。而根据产生的N2O的量来计算出反硝化速率。而参照样和乙炔抑制样中NH4+积累量的差异就是沉积物的硝化速率。在上述测定日内, 每间隔3 h取样, 12 h共取4次。取样完毕后, 立即向沉积物柱中补充相同体积该站位的上覆海水, 以保持管内上覆水的基本理化性质和总体积不会改变。另外一支培养管去除水样后, 不再添加原底层水, 而是加入乙炔饱和的底层水样(乙炔采用CaC2现场制得), 使乙炔抑制样的水相乙炔体积分数达到10%, 未用乙炔处理的设为反硝化速率测定对照组。为了抑制沉积物内氧化亚氮还原酶的作用, 用微量注射器沿沉积物的垂直方向每隔1 cm, 透过培养管壁(预先打孔填充了硅橡胶) 从4 个方向注入200 μL 被乙炔饱和的底层水。3 h后取样测定。
1.3.2 氧化亚氮(N2O)测定方法
培养结束后, 立即取样用于测定N2O。将培养管中的水转移到25 mL 玻璃瓶中(平行取2份), 用橡胶塞密封瓶口, 瓶内不能有气泡。用顶空气相色谱法测定气相中的氧化亚氮浓度(安捷伦7890A)。方法检出限为4.5 ×10-8。然后用Weiss 的公式和常数根据温度和水的盐度计算出水相的原始浓度。
1.3.3 营养盐指标
采用AA3型营养盐自动测定仪(SEAL)分析营养盐指标, 硝酸盐(NO3-)用Cu-Cd 柱还原法, 铵盐(NH4+)用靛酚蓝法, 亚硝酸盐(NO2-)用重氮偶氮法, 磷酸盐用磷钼蓝法(PO43-), 硅酸盐用钼酸胺络合-草酸抗坏血酸还原法测定。测定方法见《海洋调查规范:海水化学要素观测》。
1.3.4 沉积物中总碳水化合物(TCHO)含量:
采用苯酚-硫酸法测定[25]。取0.5 g干重沉积物装入特氟隆封口的玻璃管中, 加入5.0 mL三氯乙酸(4.0 mol·L−1)于105 ℃水解4 h, 将降解液离心取上清液, 然后按照苯酚-硫酸法测定总碳水化合物含量, 以葡萄糖作为标准品制作标线。
为了比较添加中肋骨条藻和添加多糖组中有机质的可降解度, 根据沉积物中碳水化合物含量的时间变化评估有机质降解难易程度。为了便于与其它研究结果对比, 本研究分别采用两种常用的方法来计算[25]。一种是线性模型计算, 公式如下:
G=0–b·t (1)
另一种计算方法依据one-G指数模型, 公式如下:
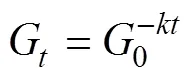
公式中是碳水化合物在时刻的浓度,G是碳水化合物在初始时刻的浓度,是总碳水化合物线性降解速率, 以每克沉积物(湿重)中每天降解总碳水化合物的含量为单位, 表示为µg glu·eq·g−1wet wt·sed·d−1,是降解常数(d-1)。
1.3.5 沉积物16S rRNA和反硝化基因S、Z绝对丰度[26]:
(1)沉积物DNA提取: 取0.5 g沉积物样品, 采用 Fast DNA SPIN KIT FOR SOIL(MPBIO)快速提取DNA试剂盒按照操作进行提取。得到的 DNA 样品-80℃保存。提取DNA浓度采用Biospec-nano分光光度计(岛津公司)于260 nm波长下检测。
(2)定量 Q-PCR 分析: 基因的丰度测定方法参照Huang等 SYBR 荧光染料定量 PCR 方法[26]。扩增引物参考表1。Q-PCR反应体系为(25 μL)为12.5 μL SYBR Premix Ex TaqTM II, 0.5 μM前向和后向引物和1μL DNA模板(TaKaRa Biotechnology, Japan), Q-PCR扩增程序参考Huang (2011)[26]。定量PCR反应的特异性采用熔解曲线、凝胶图谱进行验证。实验中所有样品均设置三个平行, 不含模板 DNA 的空白对照组也在相同条件下同时进行, 以排除任何可能的环境干扰因素。标准曲线采用梯度稀释的已知浓度标准质粒为模板扩增获得。16S rRNA基因, nirS和nosZ的Q-PCR扩增效率分别为0.932、0.854和1.011。
1.4 统计与分析
使用OriginPro 9.0进行统计和绘图, 相关性分析采用皮尔逊(Pearson)相关分析法。方差分析(ANOVA)比较差异显著性(P <0.05)。
2 研究结果
2.1 底层水和沉积物环境参数
采集站位底层水的环境参数如表2所示。底层水采集深度为距沉积层0.3 m, 溶解氧含量为4.72 mg·L-1, 无机氮中硝酸盐为主要形态。沉积物中有机碳含量为0.98 mg·g-1, 有机氮含量为0.14 mg·g-1。

表1 实时荧光定量PCR基因扩增引物
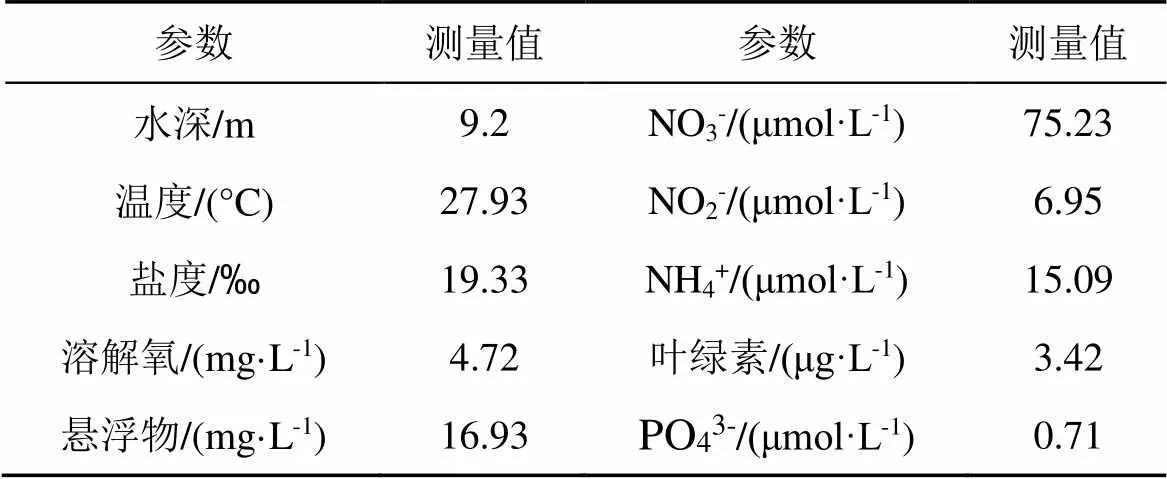
表2 采集站点的底部水体环境参数
2.2 沉积物中碳水化合物含量变化及其降解指数
图1 为沉积物中碳水化合物含量随时间变化。如图1所示, 在前3 d, 添加中肋骨条藻S+和添加多糖PS+组中, 总碳水化合物含量显著减少, 其中添加中肋骨条藻的下降程度最大, 总碳水化合物含量减少了约74.6%。而多糖组中沉积物总碳水化合物在3 d内损失21.0%。第9天S+与PS+组中总碳水化合物含量仍显著高于对照组。在整个培养实验中对照组中总碳水化合物含量变化幅度最小。表3为沉积物中碳水化和物总量的线性降解速率和降解常数。结果显示, 添加中肋骨条藻组的总碳水化合物的降解速率和降解常数最高, 降解速率和降解常数分别为300 µg glu·eq·g–1wet wt·sed·d−1和0.24 d-1, 多糖组的次之, 对照组的结果明显低于实验组(p<0.01)。由此表明, 中肋骨条藻可利用性明显大于多糖。
2.3 有机物添加对硝化与反硝化速率和表层沉积物间隙水中NH4+含量的影响
沉积物硝化速率随时间变化趋势如图2a所示。三个实验组中沉积物硝化速率都随时间的延长呈下降趋势。其中添加中肋骨条藻S+和添加多糖组PS+在第3天时, 硝化速率就出现了显著下降(p<0.01)。添加中肋骨条藻组S+硝化速率在实验初始为153.71 ± 15.27 μmol·m-2·h-1, 第3天后硝化速率降低了约50%, 为95.63 ± 7.41 μmol·m-2·h-1, 硝化速率下降程度最大。在第六天后添加多糖组和添加中肋骨条藻组的硝化速率差异不显著。到第九天, 添加有机物的两个组的硝化速率明显低于对照组。
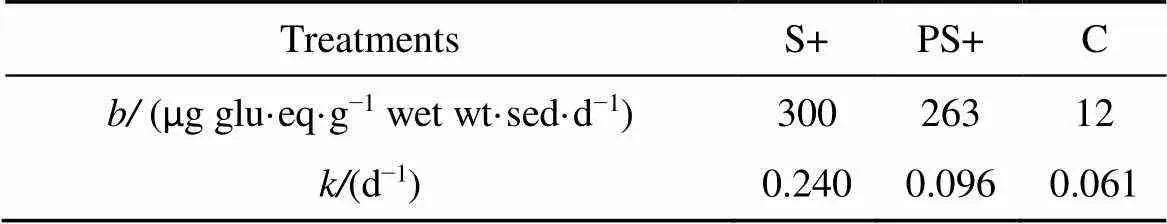
表3 不同实验组中总碳水化合物线性降解速率b与降解常数k

图1 沉积物中总碳水化合物(TCHO)含量变化
Figure 1 Concentrations of total carbohydrates (TCHO) in sediments over 9 days (S+, addition of; PS+, addition of polysaccharide; C,control)
图2b为珠江口沉积物反硝化速率对不同有机物添加的响应结果。实验初始, 沉积物的反硝化速率为10.83 μmol·m-2·h-1, 显著低于沉积物的硝化速率。反硝化的变化与硝化速率变化呈相反趋势, 添加有机物培养后, 其反硝化速率比对照组有显著升高。三个实验组中, 添加中肋骨条藻的实验组反硝化速率在第三天最高, 为40.93 ± 6.98 μmol·m-2·h-1, 比试验初始升高近4倍, 虽然从第六天后下降, 但第九天的反硝化速率仍比初始值高1倍。
图3为沉积物表层间隙水中NH4+浓度对不同有机添加物的响应。如图所示, 在S+组中的浓度显著高于PS+组和对照组(p<0.01), 三天内S+组NH4+浓度由15.09 μmol·L-1迅速增加到65.11 μmol·L-1, PS+组NH4+浓度比对照组也有显著升高。中肋骨条藻和多糖的添加能够迅速刺激微生物矿化过程的发生, 从而使得沉积物表层间隙水中NH4+浓度急剧上升, 同时表明, 添加的颗粒有机物能有效为沉积物脱氮过程提供了碳源、氮源与能量。

(S+, addition of Skeletonema costatum; PS+, addition of polysaccharide; C, control)
Figure 2 Denitrification rates and nitrification rates at different treatments

(S+, addition of Skeletonema costatum; PS+, addition of polysaccharide; C, control)
Figure 3 Concentrations of NH4+in the sediments
2.4 有机物添加对硝化、反硝化功能基因丰度的影响
本实验采用荧光实时定量PCR方法测定了沉积物中16S rRNA、反硝化功能基因S和Z的丰度。如图4所示, 培养期间在添加中肋骨条藻组S+和添加多糖组PS+的细菌16S rRNA丰度远高于对照组(p<0.01), S+组第3天时16S rRNA丰度达到峰值, 而PS组在第六天丰度最高。就S基因而言, 添加不同活性程度的有机物都极大地提高了S功能基因的丰度; 在第3天, S+组的丰度呈10倍级增长, 但不同组之间基因丰度的最高值出现的时间不同, PS+组在第6天S丰度达到峰值。同样, 添加不同活性程度的有机物对Z反硝化基因丰度也具有显著的提升作用(p<0.01), 且Z丰度的时间变化与S基因丰度的变化趋势相似。
3 讨论
在珠江口混合区外没有盐度影响的情况下, 沉积物中可利用性底物浓度是反硝化速率的主要决定性因素之一[18]。本实验采集靠近外海口处沉积物, 该位置在夏季时水体初级生产力高, 生源颗粒物含量也高于上游, 因此沉积物接收了更多的初级生产的生源颗粒物。从理论上来讲, 生源颗粒物不仅能为反硝化菌提供代谢能量, 其产生的铵盐也能为硝化作用和反硝化作用提供底物, 即硝化与反硝化的耦联作用[30]。因此生源有机颗粒物作为可利用性有机物来源, 在沉积物中对氮移除发挥了一定的作用。
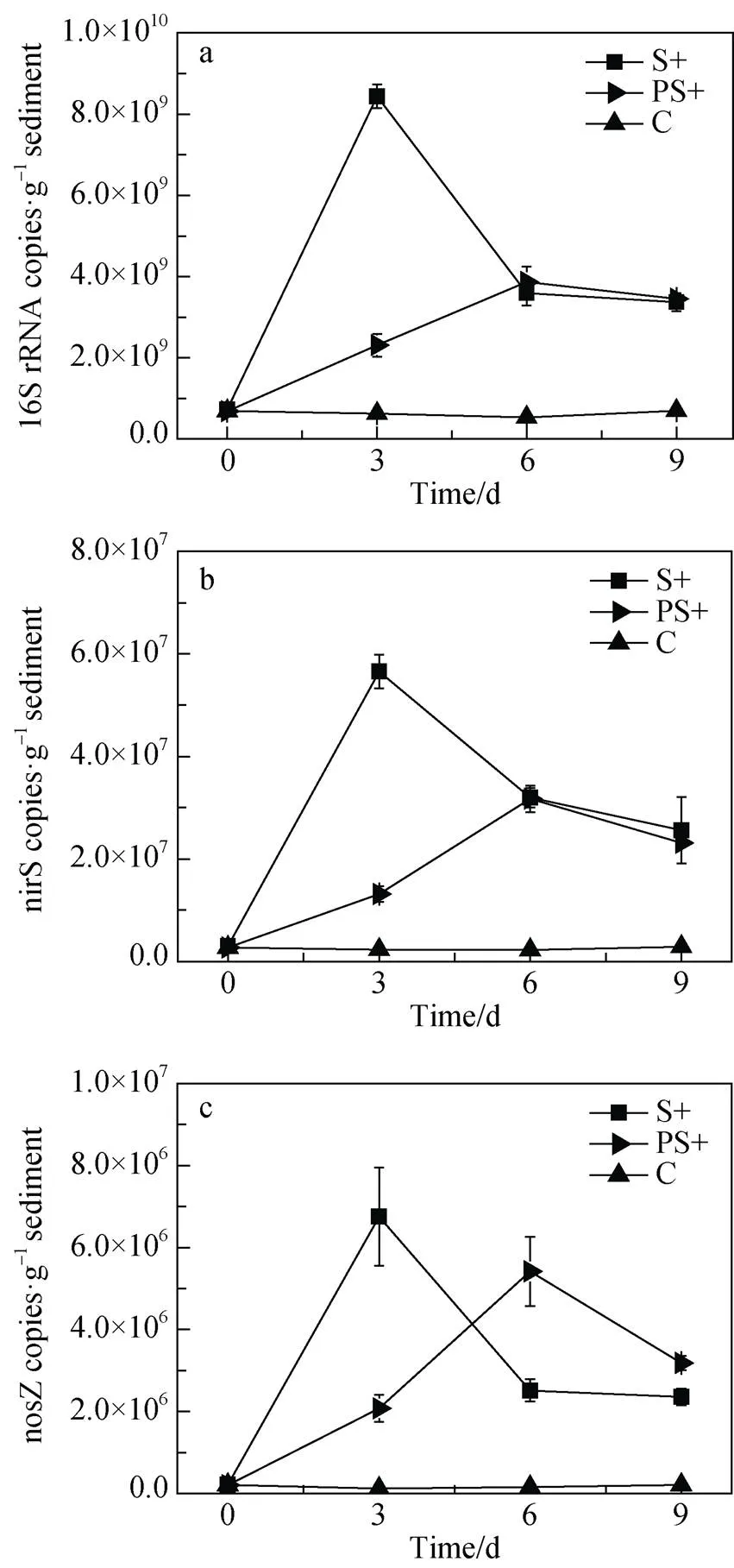
(S+, addition of Skeletonema costatum ; PS+, addition of polysaccharide; C, control)
Figure 4 Absolute quantification of 16S rRNA,S andZ in the different treatments over 9 days (gene unit, copies g-1sediment)
以往的研究报道中, 河口沉积物中氮移除的速率与有机碳含量呈正比[31–32], 因为可利用性有机碳含量是控制反硝化过程的关键因素之一。另外在大洋区域, 如反硝化和厌氧氨氧化细菌的群落结构和活性均受到海水缺氧层中有可利用有机物的调节[33-35]。通过本次培养实验, 验证了富含蛋白和多糖的生源有机颗粒物在一定程度上控制着珠江口的脱氮速率。沉积物中添加富含蛋白的中肋骨条藻和多糖后, 16S rRNA的丰度得到了极大的提高, 说明这两类有机质的添加增加了沉积物中细菌的生物量, 而且反硝化速率和反硝化功能基因S和Z丰度都有显著提高。本试验中添加中肋骨条藻使沉积物中富含蛋白质, 该组的脱氮效果显著, 在培养后三天内, 伴随总碳水化合物大量消耗, 反硝化速率升高了近4倍。表明富含蛋白质颗粒物沉降到河口底层能够显著促进活性氮的去除。
与添加中肋骨条藻试验组相比, 多糖组的总碳水化合物的降解速率和降解常数较低, 表明多糖的可利用性稍逊于富含蛋白的中肋骨条藻。多糖颗粒的周转时间取决于它们的来源和化学组成[38]。有研究表明硅藻产生的酸性多糖颗粒降解周期超过11天[37], 细菌自身能够产生比藻类惰性更强的多糖[16]。尽管如此, 在本试验中多糖降解仍为细菌提供了能量基础, 16S rRNA基因和反硝化功能基因S和Z丰度最大值出现在第六天, 表明多糖也能够促进珠江口沉积物反硝化过程。这些结果与以往报道底栖植物初级生产力丰富的河口类似, 河口沉积物在富含底栖藻类胞外多糖的情况下, 反硝化的功能基因的丰度有大幅度提高[24,38]。
除有机物可增加反硝化细菌能量之外, 有积物矿化过程中溶解氧大量消耗导致沉积物处于厌氧的环境, 也是促进反硝化的重要因素。最近大量实验表明, 浮游植物聚集体或悬浮于水体或沉降到海底, 由于颗粒粒径大, 矿化过程伴随着颗粒外层溶解氧消耗, 使颗粒物的内核呈厌氧状态, 导致反硝化过程加强, 而硝化过程为耗氧过程, 溶解氧含量降低会导致硝化速率下降[39–41]。因此本试验中在添加中肋骨条藻和多糖组中有机物矿化导致缺氧, 从而引起硝化速率降低。
在河口地带, 由于水深较浅及生源源颗粒物的粒径较大, 其在到达沉积物表层前所通过的水柱时间较短, 减少了其在水柱中的消耗, 因此该区域生源凝胶颗粒物的沉降通量不可忽视, 是底部沉积物有机物的重要来源。Tan等估算珠江口沉积物移除的氮中, 高达74%的氮来自于上层水柱中颗粒有机氮的沉降[19]。而珠江口自产蛋白颗粒是颗粒氮的重要组成部分, 本次试验结果表明添加富含蛋白的中肋骨条藻后, 反硝化速率显著提高, 而添加多糖组虽然反硝化速率低于中肋骨条藻试验组, 但仍然高于对照组。因此珠江口水体中蛋白和多糖等自源有机颗粒物沉降到底层, 将对珠江口的脱氮速率有重要贡献。
4 小结
本研究探讨了富含蛋白的中肋骨条藻培养物和多糖颗粒对珠江口沉积物硝化与反硝化速率以及相关基因丰度的影响, 研究结果表明:
(1)这两类有机物的添加能够刺激微生物矿化过程的发生, 16S rRNA基因丰度显著提高, 矿化发生同时能够为沉积物脱氮过程提供碳源与能量, 并提高反硝化速率, 同时提升反硝化过程有关的基因丰度与。但这两类有机物的矿化导致沉积中溶解氧浓度降低, 进而引起硝化速率降低。
(2)从有机质可利用性而言, 富含蛋白的中肋骨条藻培养物和多糖的生物利用性存在差异, 添加中肋骨条藻组中蛋白含量高, 其可利用性高于多糖类有机质, 并且蛋白类物质矿化过程中产生的铵盐也比多糖组高, NH4+通过硝化作用继续为反硝化过程提供硝酸盐, 因此添加中肋骨条藻组反硝化速率显著高于添加多糖组。因此自源有机颗粒物促进沉积物反硝化速率的贡献大小在一定程度上取决于其自身的可利用性。
[1] 高全洲, 沈承德, 孙彦敏, 等. 北江流域有机碳侵蚀通量的初步研究[J]. 环境科学, 2001, 22(2): 12–18.
[2] GAO Q Z, ZHANG J T, SHEN C, et al. Riverine organic carbon in the Xijiang River (South China): seasonal variation in content and flux budget[J]. Environmental Geology, 2002, 41: 826–832.
[3] 魏秀国. 珠江流域河流碳通量与流域侵蚀研究[D]. 广州: 中科院广州地球化学研究所, 2003.
[4] 蔡艳雅, 韩舞鹰. 珠江口有机碳的研究[J]. 海洋环境科学, 1990, 9(2): 8–13.
[5] 陈金斯, 李飞永, 洪华生. 珠江口海区悬浮颗粒物质研究II. 有机碳和氮的来源、分布和转移[J]. 热带海洋, 1988, 7(3): 90–98.
[6] 陈绍勇, 郑泽广, 郑建禄, 等. 珠江口悬浮颗粒有机碳与环境因子的关系[J]. 热带海洋, 1990, 9(2): 54–57.
[7] 戴仕宝, 杨世伦, 蔡爱民. 51 年来珠江流域输沙量的变化[J]. 地理学报, 2007, 62(5): 545–554.
[8] HE Biyan, DAI Minhan, ZHAI Weidong, et al. Distribution, degradation and dynamics of dissolved organic carbon and its major compound classes in the Pearl River estuary, China[J]. Marine Chemistry, 2010, 119: 52–64.
[9] 刘庆霞, 黄小平, 张霞, 等. 2010年夏季珠江口海域颗粒有机碳的分布特征及其来源[J]. 生态学报, 2012, 32(14): 4403–4412.
[10] SUN Cuici, WANG Youshao, LI Qian, et al. Distribution characteristics of transparent exopolymer particles in the Pearl River estuary, China[J]. Journal of Geophysical Research: Biogeoscience, 117, G00N17, doi: 10. 1029/2012JG 001951.
[11] WAI O W H, WANG C H, LI Y S, et al. The formation mechanisms of turbidity maximum in the Pearl River estuary, China[J]. Marine Pollution Bulletin, 2004, 48: 441–448.
[12] CISTERNAS-NOVOA C, LEE C, ENGEL A. Transparent exopolymer particles (TEP) and Coomassie stainable particles (CSP): Differences between their origin and vertical distributions in the ocean[J]. Marine Chemistry, 2015, 175: 56–71
[13] MARI X, SPPHIE B, RODOLPHE L, et al. Non-Redfield C: N ratio of transparent exopolymeric particles in the northwestern Mediterranean Sea[J]. Limnology and Oceanography, 2001, 46(7): 1831–1836.
[14] YAMADA Y, FUKUDA H, TADA Y, et al. Bacterial enhancement of gel particle coagulation in seawater[J]. Aquatic Microbial Ecology, 2016, 77: 11-22.
[15] BARREA-ALBA J, GIANESELLA S M F, MOSER G A O., et al. Bacterial and phytoplankton dynamics in a sub-tropical estuary. Hydrobiologia, 2008, 598(1): 229– 246.
[16] ROCHELLE-NEWALL E J, MARI X, PRIGAULT O. Sticking properties of transparent exopolymeric particles (TEP) during aging and biodegradation. Journal. Plankton Research, 2010, 32(10): 1433–1442.
[17] HE Biyan, DAI Minhan, HUANG W, et al. Sources and accumulation of organic carbon in the Pearl River Estuary surface sediment as indicated by elemental, stable carbon isotopic, and carbohydrate compositions[J]. Biogeosciences, 2010, 7 (10): 3343–3362.
[18] 王岩, 吴佳鹏, 关凤杰, 等. 有机物消耗对珠江口沉积物反硝化和厌氧氨氧化过程的影响[J]. 生态科学, 2018, 37(1): 27–34.
[19] TAN E, ZHOU W, JIANG X, et al. Organic matter decomposition sustains sedimentary nitrogen loss in the Pearl River Estuary, China[J]. Science of the Total Environment, 2019, 648: 508-517.
[20] 徐继荣, 王友绍, 殷建平, 等. 珠江口入海河段DIN 形态转化与硝化和反硝化作用[J]. 环境科学学报, 2005, 25(5): 686-692.
[21] ZHU G, WANG S, WANG W, et al. Hotspots of anaerobic ammonium oxidation at land freshwater interfaces[J]. Nature Geoscience, 2013, 6: 103–107.
[22] SLATER J M, CAPONE D G. Denitrification in aquifer soil and nearshore marine-sediments influenced by groundwater nitrate[J]. Applied and Environmental Microbiology, 1987, 53(6): 1292–1297.
[23] YIN Kedong, ZHANG Jianlin, QIAN Peiyuan, et al. Effect of wind events on phytoplankton blooms in the Pearl River estuary during summer[J]. Continental Shelf Research, 2004, 24: 1909–1923.
[24] MIYAJIMA T, OGAWA H, KOIKE I. Alkali-extractable polysaccharides in marine sediments: Abundance, molecular size distribution, and monosaccharide composition[J]. Geochim. Cosmochim. Acta, 2001, 65: 1455–1466.
[25] BOHORQUEZ J, MCGENITY TJ, PAPASPYROU S, et al. Different types of diatom-derived extracellular polymeric substances drive changes in heterotrophic bacterial communities from intertidal sediments. Frontiers of Microbiology, 2017, 8: 245, https: //doi. org/10. 3389/ fmicb. 2017. 00245.
[26] HUANG S, CHEN C, YANG X, et al. Distribution of typical denitrifying functional genes and diversity of theS-encoding bacterial community related to environmental characteristics of river sediments[J]. Biogeosciences, 2011, 8: 3041–3051.
[27] BRAKER G, FESEFELDT A, WITZEL K P. Development of PCR primer systems for amplification of nitrite reductase genes (K andS) to detect denitrifying bacteria in environmental samples[J]. Applied Environmental Microbiology, 1998, 64: 3769–3775.
[28] CASAMAYOR E O, PEDR´OS-ALI´O C, MUZYZER G, et al. Microheterogeneity in 16S rDNA-defined bacterial populations from a stratified planktonic environment is related to temporal changes and to ecological adaptations[J]. Applied Environmental Microbiology, 2002, 68: 1706–1714.
[29] SCALA D J, KERKHOF L J. Nitrous oxide reductase (Z) genespecific PCR primers for detection of denitrifiers and threeZ genes from marine sediments[J]. FEMS Microbiol. Lett. , 1998, 162: 61–68.
[30] CAFFREY J M, SLOTH N P, KASPAR H F, et al. Effect of organic loading on nitrification and denitrification in a marine sediment microcosm[J]. FEMS Microbiology Ecology, 1993, 12: 159–167.
[31] BABBIN A R, WARD B B. Controls on nitrogen loss processes in Chesapeake Bay sediments[J]. Environmental Science and Technology, 2013, 47: 4189–4196.
[32] PLUMMER P, TOBIAS C, CADY D. Nitrogen reduction pathways in estuarine sediments: Influences of organic carbon and sulfide[J]. Journal of Geophysical Research: Biogeosciences, 2015, 120: 1958, https: //doi. org/10. 1002/ 2015JG003057.
[33] KALVELAGE T, LAVIK G, LAM P, et al. Nitrogen cycling driven by organic matter export in the South Pacific oxygen minimum zone[J]. Nature Geoscience, 2013, 6(3): 228–234.
[34] WARD B B, DEVOL A H, RICH J J, et al. Denitrification as the dominant nitrogen loss process in the Arabian Sea[J]. Nature, 2009, 461(7260): 78–81.
[35] DALSGAARD T, THAMDRUP B, FARIAS L, et al. Anammox and denitrification in the oxygen minimum zone of the eastern South Pacific[J]. Limnology and Oceanography, 2012, 57(5): 1331–1346.
[36] PASSOW U. Transparent exopolymer particles (TEP) in aquatic environments. Progress of Oceanography, 2002, 55: 287–333.
[37] PIONTEK J, HÄNDEL N, LANGER G, et al. Effects of rising temperature on the formation and microbial degradation of marine diatom aggregates[J]. Aquatic Microbiology Ecology, 2009, 54(3): 305–318.
[38] DECLEYRE H, HEYLEN K, SABBE K, et al. A doubling of microphytobenthos biomass coincides with a tenfold increase in denitrifier and total bacterial abundances in intertidal sediments of a temperate estuary[J]. PLoS ONE, 2015, 10(5), e0126583. https: //doi. org/10. 1371/journal. pone. 0126583.
[39] KAMP A, STIEF P, BRISTOWLA, et al. Intracellular nitrate of marine diatoms as a driver of anaerobic nitrogen cycling in sinking aggregates[J]. Frontiers of Microbiology, 2016, 7, 1669, https: //doi. org/10. 3389/fmicb. 2016. 01669.
[40] STIEF P, KAMP A, THAMDRUP B, et al. Anaerobic nitrogen turnover by sinking diatom aggregates at varying ambient oxygen levels. Frontiers of Microbiology, 2016, 7, 98, https: //doi. org/10. 3389/fmicb. 2016. 00098.
[41] MARZOCCHI U, THAMDRUP B, STIEF P, et al. Effect of settled diatom-aggregates on benthic nitrogen cycling[J]. Limnology and Oceanography, 2018, 63: 431–444.
Effect of autochthonous particulate organic matter on the nitrogen removal in the Pearl River Estuary sediment
YUE Weizhong1, 2, 3, SUN Cuici2, 3, 4, *, SHI Ping2, HONG Yiguo5, HE Weihong3, 6, WANG Youshao2, 3, 4
1.China University of Chinese Academy of Sciences, Beijing 100049, China 2.State Key Laboratory of Tropical Oceanography, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China 4.Marine Biology Research Station at Daya Bay, Chinese Academy of Sciences, Shenzhen 518121, China 5. Institute of Environmental Research at Greater Bay,Guangzhou University,Guangzhou 510006, China 6. South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou, 510301, China
Microbial mediated denitrification, which depends on the organic matter loading, is the most important nitrogen removal pathway in the Pearl River Estuary. There are a lot of autochthonous organic particulate matter rich in polysaccharides and proteins in Pearl River Estuary, and how this kind of sinking organic particulate matter affects the denitrification process at the sediment-water interface is not yet clear. The effects of protein-richand polysaccharide particles on the denitrification rate and denitrification function genes in the sediments of the Pearl River Estuary were analyzed by culture experiments. The results showed that the addition of these two kinds of organic matter into the sediment could stimulate the microbial remineralization process, and the abundances of 16S rRNA,Z andS genes related to denitrification process were significantly increased, indicating that remineralization could provide carbon source and energy for nitrogen removal process and increase denitrification rate. In terms of organic matter availability, in the algal addition, higher rate of degradation of organic matter and more NH4+produced from the remineralization were observed, due to higher content of protein than the added polysaccharide group. The highest denitrification rate was observed in the sediment with the addition of, since more NH4+was converted to nitrate through nitrification and continued to provide nitrate to the denitrification process. The results showed that the deposition of autochthonous organic particles promoted the nitrogen removal process at the sediment-water interface and this promotion was positively correlated with their availability.
autochthonous particulate organic matter; particulate protein; particulate polysaccharide; denitrification; Pearl River Estuary
10.14108/j.cnki.1008-8873.2020.04.001
岳维忠, 孙翠慈, 施平, 等. 珠江口自源有机颗粒物沉降对沉积物反硝化过程的影响[J]. 生态科学, 2020, 39(4): 1–9.
YUE Weizhong, SUN Cuici, SHI Ping, et al. Effect of autochthonous particulate organic matter on the nitrogen removal in the Pearl River Estuary sediment[J]. Ecological Science, 2020 39(4): 1–9.
170.6015
A
1008-8873(2020)04-001-09
2019-04-06;
2019-04-16
广东省自然科学基金(2020A1515011137); 广东省科技计划项目名称(2016A020222018); 南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0402)。
岳维忠(1974—), 男, 山西阳泉人, 博士, 副研究员, 主要从事海洋生态学研究, E-mail: wzhyue@scsio.ac.cn
孙翠慈, 女, 河北石家庄人, 博士, 副研究员, 主要从事海洋环境与生态学研究, E-mail: scuici@scsio.ac.cn

