Toll样受体与孢子丝菌病研究进展
李盼盼 杨建勋
黑龙江省哈尔滨市南岗区哈尔滨医科大学附属第二医院,哈尔滨,150000
孢子丝菌病是一种人畜共患的慢性肉芽肿性疾病。1898年Schenck首次分离出孢子丝菌并报道了孢子丝菌病[1]。目前研究认为,孢子丝菌是一种复合体,主要包括6个菌种,分别为申克孢子丝菌(S.schenckii)、巴西孢子丝菌(S.brasiliensis)、球形孢子丝菌(S.globosa)、墨西哥孢子丝菌(S.mexicana)、卢艾里孢子丝菌(S.luriei)和白孢子丝菌(S.pallida)。孢子丝菌的多种毒力因子可以抵抗宿主免疫系统的攻击。不同菌种的孢子丝菌毒力不同,巴西孢子丝菌的毒力最强,其次是申克孢子丝菌和球形孢子丝菌[2]。天然免疫系统是宿主细胞抵御病原微生物入侵的第一道防线,宿主细胞表面的PRRs识别与结合真菌细胞表面的PAMPs能够快速激活机体的免疫反应。TLRs是一种广泛存在于巨噬细胞、树突状细胞、中性粒细胞等细胞中的PRRs,不仅能够识别细菌和病毒的病原相关分子模式,还能识别死亡或受伤细胞的损伤相关分子模式(damage-associated molecular patterns,DAMPs),是连接机体特异性免疫与非特异性免疫的桥梁。近年来研究发现TLR2和TLR4在宿主细胞抵抗孢子丝菌的免疫过程中发挥重要作用,本文就TLR2和TLR4的结构与功能、信号传导途径及其与孢子丝菌病的关系综述如下。
1 TLR2和TLR4
1.1 TLR2和TLR4的结构与功能 TLRs是一类I型跨膜蛋白,通过识别病原微生物及内源性配体激活信号传导通路,从而导致多种细胞因子、趋化因子等多种诱导因子的产生。TLRs主要由胞外富亮氨酸重复序列、跨膜结构域、细胞内Toll-白细胞介素-1受体(Toll-interleukin-1 receptor,TIR)3个结构域构成[3]。目前在人体中已经发现了11种TLR(TLR1~10,TLR14)[4],其中TLR2和TLR4与孢子丝菌病发展相关。不同的TLR识别不同的PAMPs和内源性成分。TLR2能够与TLR1或TLR6形成异源二聚体,识别革兰阳性杆菌的脂聚糖和脂蛋白、支原体脂蛋白、酵母菌酵母多糖、钩端螺旋体非典型脂多糖和热休克蛋白70等多种成分[4]。TLR4的配体有革兰阴性杆菌脂多糖(Lipopolysaccharides,LPS)、衣原体热休克蛋白60、逆转录病毒包膜蛋白等,一些内源性分子,如热休克蛋白70、肺表面活性蛋白A、纤维蛋白原、透明质酸等也可以作为TLR4的配体[4,5]。
1.2 TLR2和TLR4的信号传导通路 TLR2和4与配体结合后可激活NF-κB、p38MAPK、JNK等信号传导通路[6]。TLRs主要通过两种途径进行信号传导,分别为髓样分子88(myeloid differentiation primary-response protein 88,MyD88)依赖途径和 MyD88 非依赖途径(图1[5])。除TLR3以外,其余TLRs均通过MyD88依赖途径进行信号传导,其中,TLR4可通过上述两种途径进行信号传导。TLRs募集接头蛋白 MyD88与白细胞介素-1受体相关激酶(IL-1receptor-associated kinase,IRAK)家族分子形成复合物。复合物形成后,IRAK4磷酸化IRAK1。磷酸化的IRAK1与肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)结合,泛素化启动核因子κB(nuclear factor κB,NF-κB)、环磷腺苷效应元件结合蛋白(cAMP response element binding,CREB)和激活蛋白-1(activator protein-1,AP-1),从而引发炎症反应。MyD88非依赖途径又称TRIF途径,TLRs募集并激活干扰素β的包含TIR结构域的衔接蛋白(TIR-domain containingadaptor proteininducingIFN-beta,TRIF),利用TRAF3和TRAF6,活化干扰素调节因子(IFN regulatory factor,IRF)3和7及NF-κB,从而导致I型干扰素的表达和炎性细胞因子的产生[3,5]。
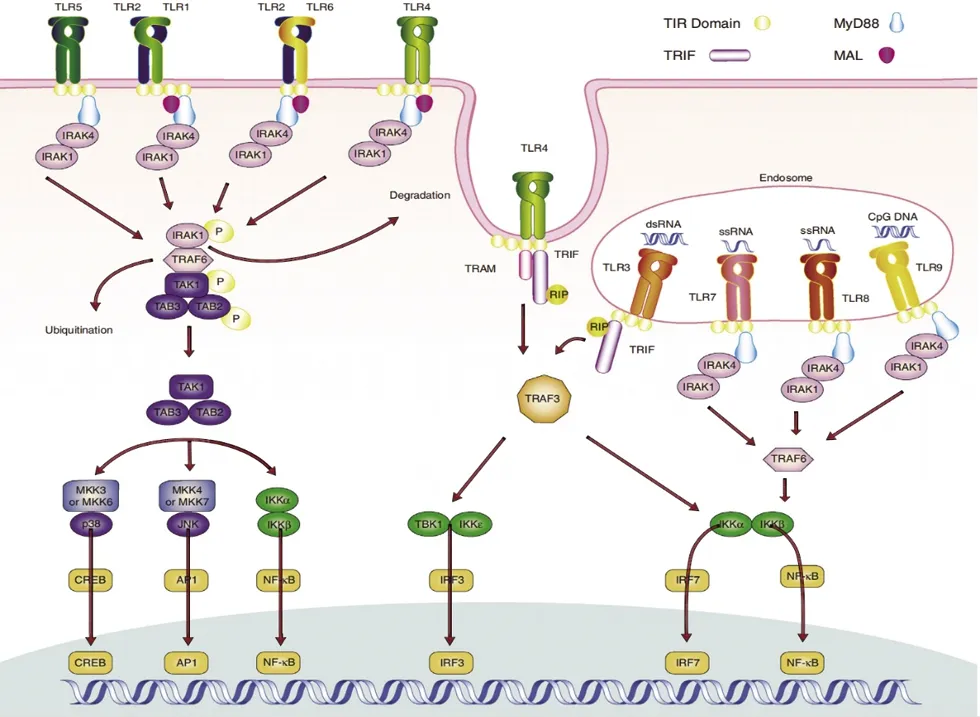
注:MyD88信号传导途径:TLRs将衔接蛋白MyD88募集到其TIR结构域,MyD88含有两个结构域,一个与TIR结构域结合,另一个称为死亡结构域募集IRAK蛋白1、2、4。IRAK蛋白将TRAF6募集至受体复合物,复合物形成后,IRAK4磷酸化IRAK1。然后,磷酸化的IRAK1和TRAF6从复合物中解离,并在质膜上与TAK1、TAB1及TAB2形成复合物,从而使三者磷酸化。随后IRAK1在质膜上降解,剩余复合物(由TRAF6、TAK1、TAB1及TAB2组成)易位至胞质溶胶,从而导致TRAF6泛素化及TAK1的活化。活化的TAK1作用于IκB激酶(IKK)复合物(由IKKα、IKKβ及IKKγ组成),激活IKK,从而使IκB磷酸化,导致IκB泛素化及蛋白体降解,随后释放NF-κB至细胞核。AK1还可以激活MKK3/6-p38信号级联反应及MKK4/7-Jun 氮-末端激酶(JNK)通路,分别导致CREB和AP-1的生成。TRIF途径:TLRs募集TRIF至TIR结构域,TLR4还可将TRAM(TRIF-adaptor molecule)募集到TIR。随后,IKKε、TBK1及TRAF3被募集到TRIF/TIR或TRAM/TRIF/TIR复合物中,TBK1磷酸化IRF3和IRF7,后者与p300及CBP(CREB结合蛋白)复合激活干扰素诱导基因表达。TRIF还可以结合TRAF6并通过激活NF-κB产生促炎细胞因子
2 TLR与孢子丝菌病
孢子丝菌具有多种毒力因子,如黏附力、热耐受力、黑色素、麦角甾醇过氧化物及真菌的双向性等[7,8],孢子丝菌可以通过这些毒力因子抵抗机体免疫系统的攻击。宿主与真菌之间的相互作用是复杂而动态的,一旦真菌侵入宿主细胞,就会激活一系列免疫应答,其中巨噬细胞和Th17反应参与了真菌的早期清除[9,10]。目前,越来越多的研究证明,TLR在机体抗孢子丝菌的免疫及抗真菌治疗中发挥重要作用。
2.1 TLR2、TLR4与孢子丝菌病 机体清除孢子丝菌主要通过中性粒细胞、巨噬细胞及树突状细胞等天然免疫细胞[11]。其中,巨噬细胞因其具有强大的吞噬杀伤和一定的抗原提呈功能,是抵抗孢子丝菌免疫的核心[11]。巨噬细胞被激活后,产生释放炎症因子、趋化因子及活性氧、氮等有毒物质(NO、H2O2等),共同抵抗病原体的入侵[12,13]。在感染早期NO和H2O2可以杀灭真菌,若产生过量,则会使获得性免疫延迟,从而有利于真菌的生长繁殖。如果免疫反应被过度激活也会产生有害影响,因此,一些特殊的细胞因子如IL-10可以抑制树突状细胞及巨噬细胞等产生炎症细胞因子,间接作用于调节性T细胞调节免疫反应[14]。研究发现,在感染前两周,IL-1β、IL-2及过氧化氢(H2O2)高表达,4~6周后降低,表明三者在感染早期控制中起作用。6周后IL-1β恢复高表达,IL-10水平持续上升至感染6周,表明二者在感染后期发挥作用[14]。巨噬细胞对真菌病原体的识别很大程度上依赖于Toll样受体。Negrini等[15]研究发现TLR2的缺失导致巨噬细胞吞噬功能显著降低,与野生小鼠相比TLR2敲除的小鼠产生细胞因子TNF-α、IL-1β、IL-12和IL-10减少。但是并不清楚TLR2具体如何识别真菌的PAMPs并诱导免疫系统产生促炎性因子。为了更好的了解TLR2在机体抗申克孢子丝菌免疫应答中的作用,Negrini等[15]进行了体外实验和体内实验。体外实验发现,与野生型小鼠相比,TLR2缺失小鼠的腹腔巨噬细胞在感染申克孢子丝菌后不能产生可检测水平的Th1细胞因子(TNF-α、IL-1β、IL-12等)和NO。在体内实验中,野生型小鼠的脾细胞较TLR2缺失的小鼠产生较多的促炎细胞因子(INF-γ、IL-6),但后者IL-17水平高于前者,仅TLR2缺失的小鼠检测到TGF-β,且TGF-β的产量与IL-17的产量呈负相关[16]。这是因为,TGF-β可以抑制Th1和Th2的分化,TGF-β的缺乏诱导Th1向Th17分化[17]。由此可见,TLR2在机体抗孢子丝菌的免疫中发挥重要作用。TLR2缺失导致免疫细胞Th1细胞因子产生减少并出现Th17极化反应,表明该受体的缺失诱导宿主免疫系统尝试使用其他免疫途径抵抗病原体。
目前已知巴西孢子丝菌与申克孢子丝菌在毒力、致病性、流行病学及被外周血单核细胞识别方面存在差异[18]。巴西孢子丝菌的毒力大于申克孢子丝菌,Rossato等[19]认为一组可能与免疫逃逸相关的蛋白与巴西孢子丝菌的高毒力有关,这些蛋白包括:细胞外壁葡聚糖酶、氨肽酶I、Mn超氧化物歧化酶、热休克70kDa蛋白1/8、3-磷酸甘油醛脱氢酶(GAPDH)、羟甲基戊二酸单酰辅酶A(HMG-CoA)裂解酶、孕酮结合蛋白、鼠李糖脂生物合成3-氧酰基-还原酶、乙酰辅酶A水解酶。为明确TLR2在机体抗巴西孢子丝菌免疫中的作用是否与申克孢子丝菌不同,Rossato等[20]做了体外实验和体内实验。体外实验表明TLR2缺失使巨噬细胞的吞噬作用降低,促炎细胞因子及NO产生减少。与申克孢子丝菌感染(细胞因子TNF-α、IL-1β、IL-12减少)不同的是,TLR2缺失会使感染巴西孢子丝菌的小鼠产生细胞因子IL-10、IL-6、TNF-α减少。同时,他们发现在感染的前14天TLR2的表达对机体抗巴西孢子丝菌至关重要,感染28天后TLR2的缺失会诱导Th17反应对抗病原体。
TLR4在机体抗孢子丝菌的免疫中发挥重要作用。TLR4可以触发细胞内级联反应,导致宿主细胞表达的吞噬受体增加,细胞吞噬作用增强[21]。研究发现,TLR4缺失的小鼠的巨噬细胞无法产生高水平的细胞因子如IL-1β、IL-12及TNF-α,并伴随NF-κB表达降低[22]。与野生型小鼠相比,TLR4缺失的小鼠产生促炎细胞因子及NO减少。在感染的前14天,TLR4缺失的小鼠促炎细胞因子IL-6、TNF-α、IL-10及 IFN-γ产生减少,导致感染部位募集中性粒细胞减少,从而导致巴西孢子丝菌酵母细胞大量繁殖,加重感染[23]。感染28天后,IL-6、IFN-γ表达增加,说明机体可能通过其他免疫途径抵抗孢子丝菌[23]。
表皮角质形成细胞可通过产生促炎细胞因子和趋化因子将中性粒细胞和巨噬细胞募集到感染部位,参与炎症反应。Li等[24]研究发现,申克孢子丝菌的分生孢子和酵母相细胞壁成分均可识别并结合表皮角质形成细胞的TLR2和TLR4受体,激活NF-κB信号通路,产生促炎性细胞因子和趋化因子(IL-6和IL-8)启动早期免疫应答。
在机体抗孢子丝菌的免疫中,TLR2和TLR4通过识别孢子丝菌细胞壁的PAMPs,增加吞噬作用和促进细胞因子的产生,但具体孢子丝菌细胞壁的哪种成分可以被TLR2和TLR4识别,其发挥免疫作用的机制是什么,有待进一步研究。
2.2 TLR2、TLR4在孢子丝菌治疗中的作用 孢子丝菌的治疗取决于临床表现、宿主免疫状态及孢子丝菌的种类等。在抗真菌药敏试验中,孢子丝菌复合物对抗真菌药的反应不同。在体外试验中,巴西孢子丝菌对伊曲康唑、泊沙康唑、特比萘芬等敏感性较强,申克孢子丝菌对两性霉素B(AmB)、泊沙康唑、特比萘芬的敏感性较强[7]。抗真菌药物可以影响TLRs的功能和免疫活性。AmB诱导小鼠腹腔巨噬细胞分泌炎性细胞因子TNF-α、IL-1β、IL-8需要TLR2的参与,敲除TLR2的小鼠巨噬细胞不能产生炎症细胞因子。AmB可促进中性粒细胞TLR2的表达,而抑制TLR4的表达,而AmB 脂质体则可以促进中性粒细胞TLR4的表达,TLR4信号与AmB脂质体刺激可协同促进小鼠中性粒细胞抗炎细胞因子的产生及阻止促炎性细胞因子的分泌[25]。唑类药物也同样具有免疫调节作用,可以作用于TLRs,但目前没有唑类药物与孢子丝菌的免疫相关研究。有研究表明,烟曲霉菌丝和伏立康唑单独应用可上调单核细胞TLR2的表达和促进 TNF-α 的分泌,两者联用则具有协同刺激作用。无论是联用还是单独刺激,TLR4的表达都没有明显变化[25]。TLRs与抗真菌药物具有协同作用,可以提高药物的抗真菌作用,进一步研究抗真菌药物作用于免疫系统的机制,可以为孢子丝菌病等真菌病提供新的治疗途径。
3 结语
综上所述,TLRs在宿主细胞抗孢子丝菌的免疫中发挥重要作用,可以增强吞噬细胞的吞噬作用和促进炎症因子的释放,具有抗炎和促炎双重作用。同时,一些抗真菌药物发挥作用也需要TLRs的参与。但是,目前对于TLRs影响宿主免疫系统的具体机制尚不清楚,需要进一步研究。

