高效藤壶赖氨酰氧化酶的体外重组表达体系构建*
刘伟治,滕潞瑶,张小康,王露露
( 中国海洋大学海洋生命学院 海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
藤壶(Balanus)是世界沿海港口和海湾的主要污损生物,分布范围涵盖了潮间带至潮下带,通过分泌粘性极强、可在水下交联聚合的胶粘物,牢固地附着在水下物体表面[1]。藤壶胶由分泌腺合成并分泌,通过导管系统输送至附着界面,6 h内聚合成不透明的胶块,其蛋白含量超过90%[2]。研究发现在藤壶的粘附胶固化过程中酶的作用十分关键,Cheung[3]等早在四十多年前就发现藤壶胶生物合成需要赖氨酰氧化酶(Lysyl oxidase,LOX)参与。LOX在哺乳动物体内可催化胶原蛋白和弹性蛋白中赖氨酸和羟赖氨酸的交联,增强蛋白稳定性[4-6]。Christopher等通过蛋白质组学分析,在藤壶胶中发现了几种一级结构由富含Gly/Ser/Thr/Ala的低复杂性结构域和富含Lys和Arg的复杂性结构域交替组成的蛋白,这与胶原蛋白和弹性蛋白序列具有相似性,且赖氨酸含量超过10%,可作为交联位点[7],推测交联可以改变粘附蛋白的物理状态和性能[8]。而且进一步研究证实在藤壶胶中存在LOX活性,且在藤壶中发现了与果蝇LOX具有同源性的蛋白序列[9-10]。但因藤壶胶极易固化,造成了LOX提取困难;所以研究人员一直希望通过基因工程实现有活性的藤壶LOX重组制备。但迄今为止,尚未有文献报道,说明LOX在原核生物中重组表达难度较大[11-12],已成为藤壶胶形成机制研究的瓶颈。
此前基于多组学技术在藤壶胶内鉴定到了与人LOX家族成员序列具相似性的蛋白[19-23],命名为BalLOX。为获得有活性的BalLOX,本研究通过对BalLOX表达序列的长度和表达载体进行筛选,首次获得了重组BalLOX的可溶性表达,为后续藤壶粘附胶组成机制的研究奠定了基础。
1 材料和方法
1.1 材料
pET-28a、pET-32a、pGEX-6p-1、pMCSG 9 表达载体质粒和感受态细胞大肠杆菌 BL21 (DE3)为本实验室保存;所有引物合成及 Sanger 测序委托生工生物工程股份有限公司; PrimeSTAR ® GXL DNA Polymerase、EcoRI和NotI内切酶、T4连接酶购买于 Takara;辣根过氧化物酶和各种生化试剂购买自BBI;3-氨基丙腈(β-BAPN,Alfar Aesar)、1,5-二氨基戊烷和各种常规化学试剂购买自国药集团化学试剂有限公司; Amplex Red(Invitrogen)。
1.2 方法
1.2.1 BalLOX氨基酸序列分析 通过SMART(Simple Modular Architecture Research Tool)对蛋白的全长氨基酸序列进行信号肽及功能结构域的预测,再通过NCBI在线BLAST(Basic Lacol Alignment Search Tool)在蛋白质数据库中寻找与BalLOX催化区域序列相似性较高的蛋白,利用BioEdit软件进行序列比对分析。
1.2.2 BalLOX重组表达载体的构建 根据BalLOX的全长基因序列,设计并合成PCR引物。分别设计只含催化区域(命名为BalLOX_CD)以及含1个/2个富含半胱氨酸的清道夫受体(Scavenger receptor cysteine-rich domain,SRCR)结构域和催化区域的亚克隆(分别命名为BalLOX_CD+1 SRCR和 BalLOX_CD+2 SRCR),引物序列如表1,5’端具有EcoRI酶切位点,3’端具有NotI酶切位点,以BalLOX的全长基因为模板,PCR扩增基因序列。将PCR扩增的DNA片段凝胶回收,分别连接至pET-28a、pET-32a、pGEX-6p-1、pMCSG9载体上,转化至大肠杆菌BL21(DE3)中,对所有重组表达载体进行测序。

表1 PCR引物列表
1.2.3 重组蛋白的表达和优化 将含目的序列的单克隆菌株以1%的接种量接种于1 L含有卡那(Kan)/氨苄霉素(Amp)的LB液体培养基中,37 ℃培养至菌体生长达到对数生长期(OD600≈0.8)。加入0.5 mmol/L IPTG诱导剂诱导,37 ℃/16 ℃继续诱导培养。培养结束后离心收集菌体,加入20 mmol/L Tris-HCl pH=8.0/500 mmol/L NaCl缓冲液重悬超声破碎菌体,离心留取上清溶液作为粗酶。
1.2.4 BalLOX_CD酶活检测 由于LOX是一种铜依赖性的胺氧化酶,铜是LOX的重要辅基,只有与铜结合酶才具有活性[15-16]。所以将BalLOX_CD粗酶于20 mmol/L Tris-HCl pH=8.0、1 mmol/L CuSO4透析外液中4 ℃下透析3 h,利用考马斯亮蓝法检测粗酶溶液中全蛋白浓度。为了排除MBP标签对酶活的影响,添加同样方法处理得到的MBP标签蛋白组和不加酶组作为空白对照。
根据Palamakumbura等描述的 Amplex red荧光法[17]检测酶活,以β-BAPN孵育后的酶作为阴性对照,检测反应前后荧光强度变化。Δ荧光强度=实验组(反应前-反应后)-β-BAPN对照组(反应前-反应后)。一个单位的胺氧化酶活性定义为在37 ℃下每分钟氧化1 μmol/L 1,5-二氨基戊烷底物的活性,底物的反应浓度由H2O2生成浓度确定[18]。根据标准曲线计算H2O2生成浓度,因此单位酶活计算公式为:单位酶活(U/mg)=H2O2生成浓度(μmol/L)/加酶量(mg)/ 反应时间(min)。
2 结果与讨论
2.1 实验结果
2.1.1 BalLOX氨基酸序列分析 BalLOX全长517个氨基酸,前18个氨基酸为信号肽序列,76~182和207~297处的氨基酸序列为两个SRCR结构域,305~517处的氨基酸序列为LOX催化结构域(见图1)。将BalLOX的催化区域氨基酸序列进行BLAST比对分析,BalLOX_CD与人LOX家族5个成员的蛋白序列催化区域有35%~42%的相似性[19-23],且与催化区域中的两个保守区域氨基酸都具有一致性(见图2),第一个区域为铜结合部位,含有四个组氨酸;第二个区域位于C 末端,含有高度保守的酪氨酸残基,为催化区域,可以与赖氨酸残基一起参与形成赖氨酰酪氨基醌( lysine tyrosyl quinone, LTQ),因此推测BalLOX_CD可能具有LOX的活性。
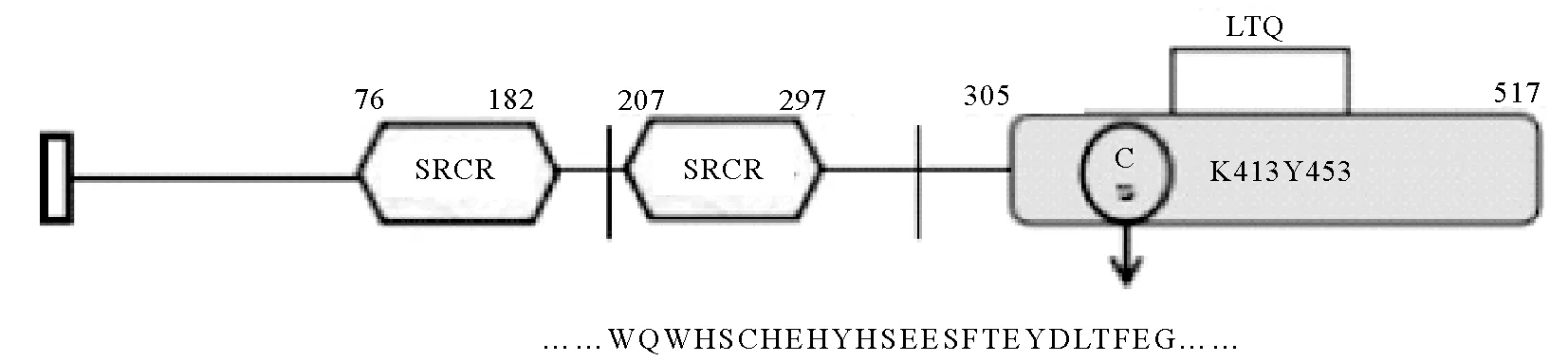
图1 BalLOX结构域示意图Fig.1 The domain of BalLOX
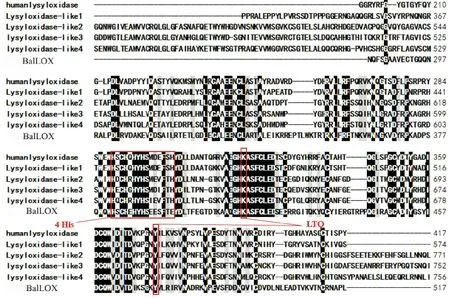
(4 His和LTQ为文中所述LOX家族成员中两个高度保守的区域。4 His and LTQ are two highly conserved Domain in the LOX family. GenBank ID:lysyl oxidase [AAB23549.1],Lysyl oxidase-like 1 [AAH68542.1],Lysyl oxidase-like 2 [AAH00594.1],lysyl oxidase-like 3 protein [AAK63205.1],lysyl oxidase-like 4 [AAL27543.1])
2.1.2 BalLOX 基因片段的克隆 考虑到SRCR结构域富含半胱氨酸(每个SRCR结构域含6个Cys),可能会发生交联降低蛋白的溶解度,因此设计了不同长度的亚克隆(分别命名为BalLOX_CD+2 SRCR、 BalLOX_CD+1 SRCR和BalLOX_CD),研究是否会对蛋白的表达产生影响。PCR扩增出3个基因片段(见图3)。
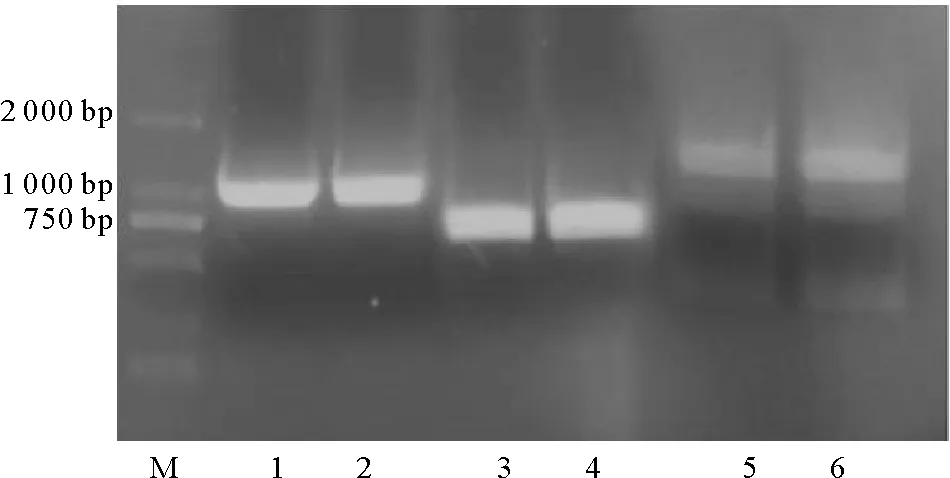
(泳道:1和2显示BalLOX_CD+1 SRCR基因片段条带;3和4显示BalLOX_CD基因片段条带;5和6显示BalLOX_CD+2 SRCR基因片段条带。Lane M: DL 2000 DNA Maker. Lane 1&2: The target bands of BalLOX_CD+1 SRCR gene fragments; Lane 3&4: The target bands of BalLOX_CD gene fragments; Lane 5&6: The target bands of BalLOX_CD+2 SRCR gene fragments.)
2.1.3 高效 BalLOX表达体系的构建和筛选
2.1.3.1 不同的重组表达标签对不同长度BalLOX 表达的影响 考虑到不同的表达标签蛋白会对重组蛋白的折叠和溶解性有重要影响。本研究选择了pET-28a、pET-32a、pGEX-6p-1、pMCSG9这4种不同系统,分别对应了4种不同的可溶性标签: His标签、Trx(硫氧还蛋白)标签、GST(谷胱甘肽S-转移酶)标签和MBP(麦芽糖结合蛋白)标签,连接至亚克隆蛋白序列的N末端,来研究不同标签对蛋白表达的影响,同时对比了不同诱导温度(37和16 ℃)对重组蛋白表达的影响(见图4)。结果发现携带SRCR结构域的两个亚克隆连接pET-32a、pGEX-6p-1、pMCSG9载体后均不能在37 ℃表达,且连接pET-28a载体后于16 ℃下诱导表达目的蛋白均出现在菌体超声破碎离心后的沉淀中(见图5),说明SRCR区对BalLOX的体外重组表达有较大影响;单独的BalLOX_CD在两个诱导温度下均能表达,考虑到本研究以获得高活性的酶为目的,因而选择BalLOX_CD进行后续研究。
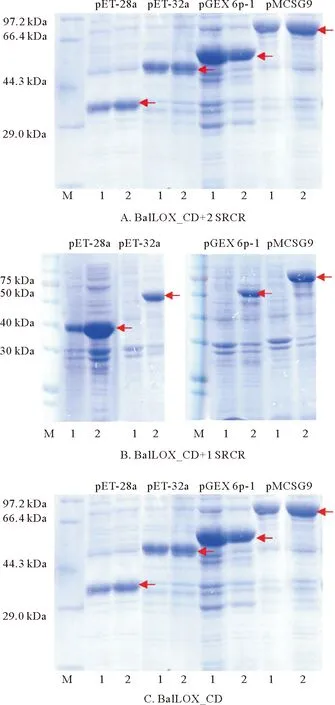
(上图中的SDS-PAGE电泳蛋白样品均为未超声裂解的全菌。泳道:M为Marker;0 为未诱导菌液;1为37 ℃下诱导;2为16 ℃下诱导。箭头处为目的蛋白条带。图A和B分别为BalLOX_CD+2 SRCR和BalLOX_CD+1 SRCR连接如图上标注的4个载体后在37和16 ℃诱导下的表达情况。连接pET-28a载体后蛋白于两个诱导温度下均表达,连接其他3个载体后仅16 ℃诱导下表达。图C为BalLOX_CD连接如图上标注的4个载体后在37 和16 ℃诱导下的表达情况。连接pET-28a、pET-32a、pGEX-6p-1、pMCSG9载体后蛋白于两个诱导温度下均能表达。The SDS-PAGE electrophoresis protein samples are whole bacterial without ultrasonication. M: Marker; 0: Uninduced bacterial solution; 1: Induction temperature is 37 ℃; 2: Induction temperature is 16 ℃. The arrows point to the band of target proteins. Figure A and B show the expressions of BalLOX_CD + 2 SRCR and BalLOX_CD + 1 SRCR with the four vectors marked on the figures were induced by 37 and 16 ℃. The proteins with pET-28a vector were expressed at two induction temperatures, and with the other three vectors were expressed only at 16 ℃. Figure C shows the expression of BalLOX_CD with the four vectors marked on the figure under the induction of 37 and 16 ℃. The proteins with pET-28a, pET-32a, pGEX-6p-1, and pMCSG9 vectors were expressed at both induction temperatures.)
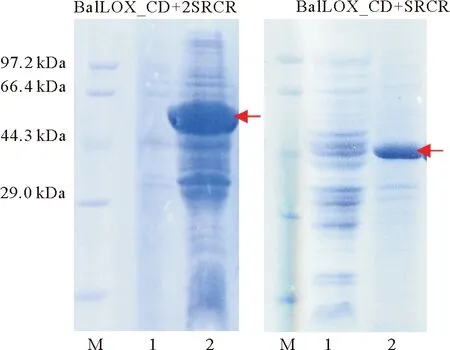
(泳道M为Marker;1为菌体超声破碎离心后上清溶液;2为离心后沉淀。箭头处为目的蛋白条带。M:Marker;1:Supernatant after ultrasonication and centrifugation of E.coli BL21; 2. Precipitate. The arrows point to the band of target proteins.)
2.1.3.2 BalLOX_CD 可溶性表达载体的筛选 考虑到通常情况下低温可以减缓菌体生长和蛋白表达及折叠速度,降低错误折叠形成包涵体的概率,从而提高外源蛋白表达的可溶性[24-26]。因此选择在诱导温度为16 ℃的条件下,筛选能够实现BalLOX_CD可溶性表达的标签。除了pMCSG9-BalLOX_CD外,其它表达系统中获得的重组蛋白均出现在菌体超声破碎离心后的沉淀中,说明其以包涵体的形式存在(见图6)。因此最终选择携带MBP标签的BalLOX_CD蛋白用于后续酶活性的检测。
2.1.4 酶活测定 BalLOX_CD在大肠杆菌中实现可溶性表达后,在含Cu2+的Tris-HCl透析外液中透析后可获得纯度较高的BalLOX_CD蛋白样品(见图7a)。向反应体系中分别加入1 μg 酶和MBP蛋白,检测反应前后荧光强度变化(见图7b)。在此测活条件下根据单位酶活计算公式计算得到MBP标签单位质量酶活为约0.018 U/mg,而携带MBP标签的BalLOX_CD的单位质量酶活为(0.119± 0.012)U/mg。
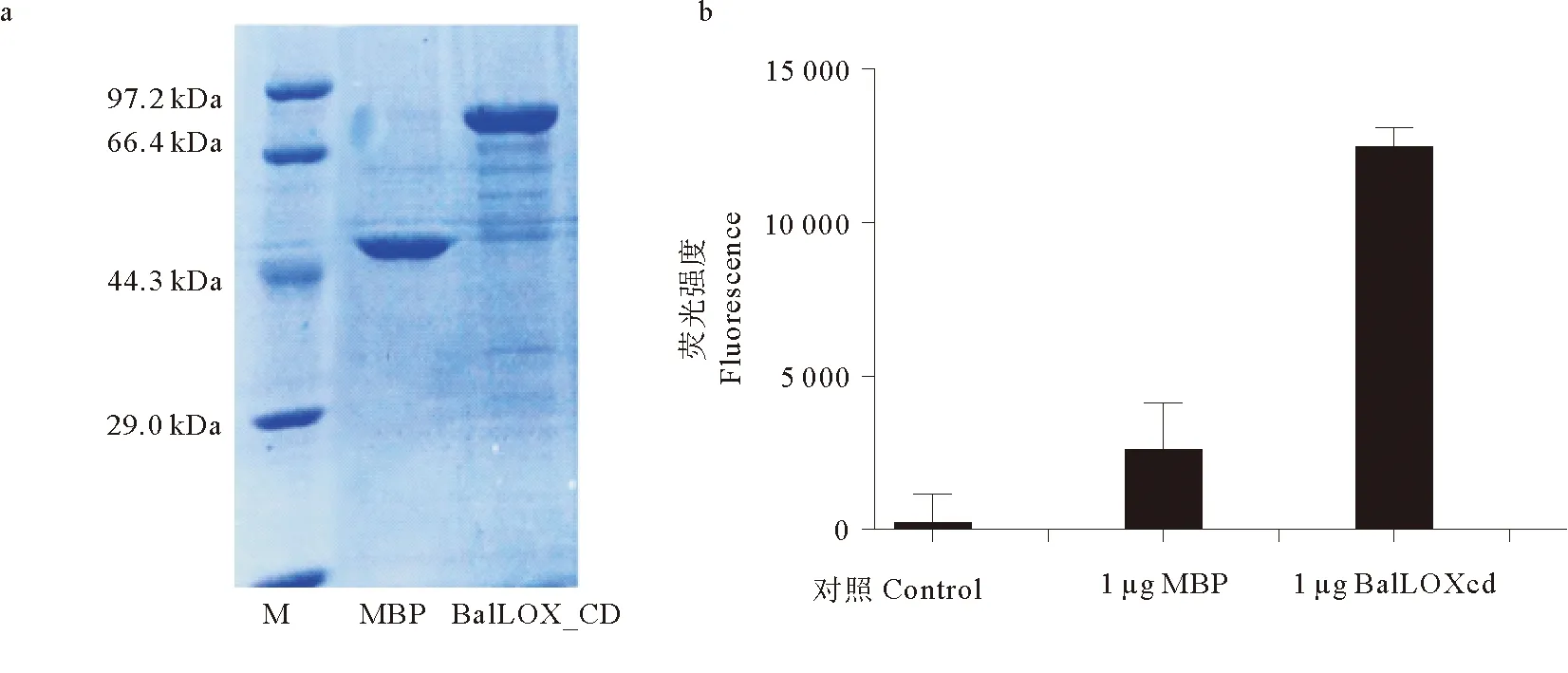
(a. 为MBP和BalLOX_CD蛋白透析后SDS-PAGE电泳图。b. 不同酶浓度下反应结束后荧光强度变化。a. The recombinant expression of MBP and BalLOX_CD. b. Changes in fluorescence intensity at the end of the reaction at different enzyme concentrations. The fluorescence intensity in the figure is the value obtained by subtracting the β-BAPN negative control.)
2.2 讨论
目前,对于藤壶水下粘附机制及藤壶胶的固化机制仍未明确。Christopher等首次通过质谱在网纹藤壶胶中鉴定到了赖氨酰氧化酶AaLOX(KY762300),还检测到醛/酮以及LOX活性的存在,推测LOX在藤壶胶中发挥的作用与在弹性蛋白中类似[9-10],因此LOX在藤壶成胶粘附过程中发挥着重要作用。但由于藤壶来源的LOX蛋白序列,与哺乳动物的LOX同源性较低,如与人成熟的LOX(从Asp 169开始)序列(GenBank Accession No. M94054)同源性为21%[14],与人成熟的LOXL(从Asp 135开始)序列(GenBank Accession No. L21186)同源性为26%[11-14],因此,LOX在藤壶中的作用机制并不能完全用在哺乳动物体内的催化机制来解释,还需要进一步研究阐明。所以迫切需要对藤壶LOX进行重组表达和活性研究,但之前文献报道提示藤壶LOX在原核表达系统中重组表达困难。文献调研发现即使是人LOX在体外表达的过程中也易发生沉淀和聚集,主要以包涵体的形式存在,需要重折叠以获得活性酶,这个过程不仅耗时且易导致蛋白质产量和酶活性的损失,因此通过体外重组表达的方式,得到具有活性的LOX具有一定难度[11-12]。本研究首次将藤壶赖氨酰氧化酶BalLOX进行了重组表达,通过基因长度,表达载体和表达条件的筛选,最终获得了可溶性表达的藤壶重组LOX催化区域亚克隆蛋白,产量能达到0.28 g/L培养基,且携带MBP标签的蛋白单位质量酶活在0.119 U/mg左右。此前Smith等在人LOX上添加Nus-A标签后同样获得了可溶性蛋白,但最终酶产量仅0.75 mg /L培养基,携带Nus-A标签后单位质量酶活性约0.11 U /mg[12]。相比之下,本研究获得的BalLOX酶活性基本相同,但酶产量提高了373倍。
综上所述,本研究首次成功表达了藤壶来源的具有催化活性的LOX,并实现了酶的高效可溶性表达,实现了藤壶LOX的体外高效重组表达,为后续藤壶胶的形成机制研究奠定了基础。

