运动训练对急性脑梗死后学习记忆能力及细胞骨架蛋白的影响*
张维文 王晓莉 张方圆 方 玲 魏 琰(衡水市人民医院神经内二科,衡水 053000)
脑梗死发病原因是由于脑内动脉阻塞引起脑局部组织缺血缺氧坏死[1]。脑梗死患者所遗留的学习记忆能力障碍将严重影响患者本人和家庭生活质量,影响身心健康。近期报道长期规律的运动训练可提高脑外伤后的学习记忆能力[2],可能与减少损伤脑组织氧化应激及神经细胞凋亡,增强海马区神经营养因子表达以及神经元突触可塑性等机制相关[3]。早期跑台训练可以通过抑制巨噬细胞/小胶质细胞活化,下调基质金属蛋白酶的表达促进脑卒中老龄大鼠神经功能恢复[4]。张青杰等[5]报道超早期和早期运动训练可减少脑皮质梗死边缘区细胞坏死凋亡,改善急性脑梗死大鼠的神经功能障碍。本实验采用大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,评价跑台训练对于脑梗死大鼠梗死体积、脑水肿程度、空间学习记忆能力以及海马区细胞骨架相关蛋白表达的影响。拟揭示早期运动训练对于脑梗死大鼠的治疗作用和其可能的作用机制,为此研究方向提供实验和理论依据。
1 材料和方法
1.1 实验动物
SPF级 雄 性 成 年Wistar大 鼠120只,8周 龄,体质量(250±50) g,由北京维通利华生物技术有限公司提供。饲养环境温度21.0℃±1.0℃,湿度40%~55%, 自由饮食。按随机数字表法分为假手术组、模型组、训练组,每组40只。每组依据2个不同时间点(14、28 d)将动物分为2个亚组,每个亚组20只动物, 其中5只动物Morris水迷宫测试后行脑梗死体积测定;脑含水量检测,免疫组织化学及免疫印迹检测各5只动物。
1.2 药品和仪器
兔抗大鼠β-tubulin和微管相关蛋白-2(microtube-associated protein-2, MAP-2)多克隆抗体购自美国Abcam公司;兔抗大鼠β-actin单克隆抗体购于北京博奥森生物有限公司;蛋白提取试剂盒购自上海碧云天生物技术公司;SABC免疫组织化学检测试剂盒购自武汉博士德生物工程有限公司;BCA试剂盒与DAB显色试剂盒购于福州迈新生物有限公司;2, 3, 5一氯化三苯基四氮唑购自美国Sigma公司。电动跑台仪(美国哥伦布仪器有限公司,Exer3/6R型);大鼠脑立体定向仪(上海江湾医疗器械厂);微量注射器(杭州科晓化工仪器设备有限公司);光学显微镜(日本Olympus公司)。
1.3 脑梗死模型制备
参照文献[6]采用线栓法制备左侧大脑中动脉闭塞模型。采用 0.8%戊巴比妥钠30 mg/kg腹腔注射麻醉大鼠,麻醉成功后将大鼠仰卧固定于台上,分离左侧颈总动脉,穿线备用;依次分离左侧颈外动脉、颈内动脉并依次结扎;动脉夹夹闭颈内动脉远心端;在颈内动脉与颈外分叉的近心端剪T型切口,将线栓轻插入颈内外动脉,当感到有阻力时,停止插线,距颈内动脉与颈外动脉分叉处约(18.5±1.5) mm,证明线栓头端已经进入大脑中动脉处,扎紧备线,消毒、缝合皮肤。大鼠麻醉清醒后出现明显右侧偏瘫体征及左侧Horner征,证实造模成功,纳入实验,无此体征动物弃去。
1.4 跑台运动训练
手术前各组大鼠均在电动跑台仪上进行适应性跑步训练3 d。运动训练组大鼠于脑梗死模型制备成功后24 h给予跑台训练,每天训练30 min。电动平板斜度为0,第1天运动速度为4 m/min,第2天增加至 8 m/min,第3天增加至12 m/min,然后保持该速度分别训练至造模后14 d或28 d。假手术组及模型组每日亦置于跑台上30 min,但不进行跑步运动。
1.5 Morris水迷宫测试
水迷宫水池直径为100 cm,高60 cm,水深42 cm,平台高度40 cm,没于水面下2 cm。调节水温至 22 ℃~ 24℃之间,保持水池周围参照物不变。(1)定位航行实验:实验前对大鼠进行适应性训练,训练时随机选择1个入水点,将大鼠面向池壁放入水中,记录大鼠寻找并爬上平台时所需时间(即逃避潜伏期),每次训练间隔为60 s;如果大鼠120 s内未找到平台,将其引至平台,潜伏期记为120 s。(2)空间搜索实验:在最后一次训练后撤除平台,在同一入水点将大鼠面向池壁放入水中,测其在120 s内跨过原平台相应位置的次数和在平台象限停留时间。
1.6 脑含水量的测定
按干湿重法测定脑组织含水量,评估大鼠脑水肿程度。快速断头完整取出脑组织,迅速称其湿重,然后放置于100℃高温干燥箱内,烘干48 h恒重后称量其干重。脑组织含水量按Elliott公式计算:脑含水量(%)=(湿重一干重)/湿重×100%。
1.7 脑梗死体积测定
用2, 3, 5-三苯基氯化四氮唑 (TTC) 染色法检测大鼠脑梗死体积,大鼠麻醉后迅速断头取脑,冠状切片每组6片(2 mm),TTC染液中室温染色30 min。使用Image J分析软件分析梗死体积百分比。依据公式:脑梗死百分比=脑梗死体积/ 脑片体积×100%。
1.8 免疫组织化学显色
石蜡切片机切片(5 μm),烤片后常规水化。用枸橼酸钠缓冲液(0.01 mo1/L)进行高压抗原热修复1.5 min。3%H2O2室温孵育15 min,以阻断内源性过氧化物酶。5%BSA封闭,室温孵育20 min,倾去血清。分别滴加相应一抗:兔抗大鼠β-tubulin和MAP-2多克隆抗体(1∶200),4℃孵育过夜。PBS冲洗,5 min×3次,滴加生物素标记二抗,37℃孵育30 min。PBS冲洗,5 min×3次,滴加辣根酶标记链霉卵蛋白素,37℃孵育10 min。DAB显色,自来水冲洗,脱水透明、封片。
1.9 免疫印迹检测
称取100 mg海马组织,加入蛋白裂解液1 mL和蛋白酶抑制剂1 μL中裂解,低温组织匀浆后静置30 min,低温离心留取上清液。用BCA 试剂盒进行蛋白定量浓度测定,10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干法电转移至PVDF膜上,PVDF膜以5%BSA封闭,分别滴加兔抗大鼠β-tubulin和MAP-2多克隆抗体(1∶500)、兔抗大鼠β-actin单克隆抗体(1∶1 000)4℃孵育过夜。次日洗膜后滴加lgG-HRP抗体(1∶5 000),室温孵育2 h。ECL化学发光液曝光,扫描并测定目标蛋白吸光度值,与内参β-actin比值后,做统计学分析。
1.10 统计学处理
所有数据采用SPSS13.0软件进行统计学分析。计量资料以x±s表示,采用单因素方差分析和t检验。
2 结果
2.1 大鼠空间学习记忆能力的改变
本实验在造模后14 d和28 d进行Morris水迷宫定位航行实验和空间搜索实验。与假手术组相比,模型组大鼠测试逃避潜伏期延长,经过平台次数与平台象限停留时间均显著减少,差异均有统计学意义(P<0.05)。与模型组相比,跑台训练组大鼠测试逃避潜伏期缩短,经过平台次数与平台象限停留时间明显延长,差异均有统计学意义(P<0.05)(表1)。
表1 各组大鼠逃避潜伏期、经过平台次数和平台象限停留时间(n=5, ±s)Tab 1 Escape latency, times of crossing the platform and residence time in platform quadrant(n=5, ±s)
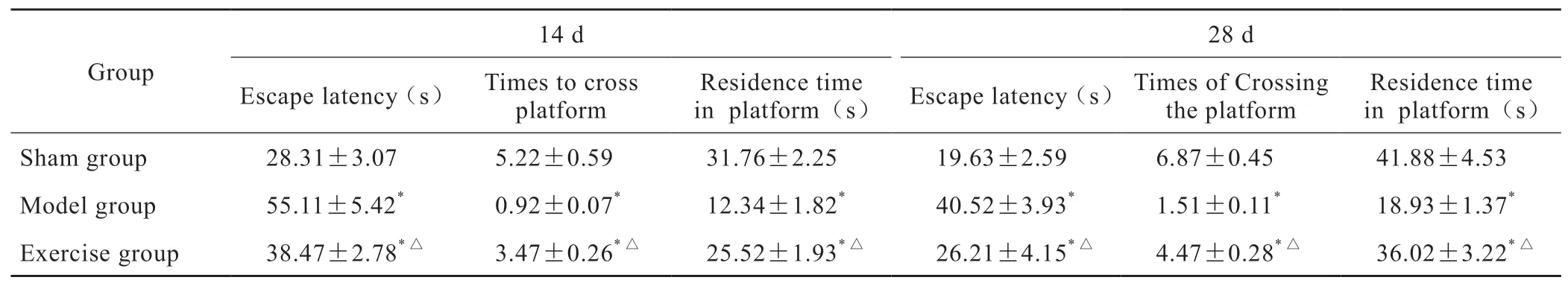
表1 各组大鼠逃避潜伏期、经过平台次数和平台象限停留时间(n=5, ±s)Tab 1 Escape latency, times of crossing the platform and residence time in platform quadrant(n=5, ±s)
*P<0.05 vs sham group; △P<0.05 vs model group
?
2.2 大鼠脑水肿程度的变化
干湿比重法检测脑组织含水量结果显示:模型组大鼠的脑组织含水量明显高于假手术组(P<0.05),且模型组14 d脑水肿程度高于28 d组。与模型组相比,跑台运动训练组大鼠的脑组织含水量明显降低(P<0.05)。这些结果表明跑台训练可减弱脑梗死大鼠的脑水肿程度(图1)。
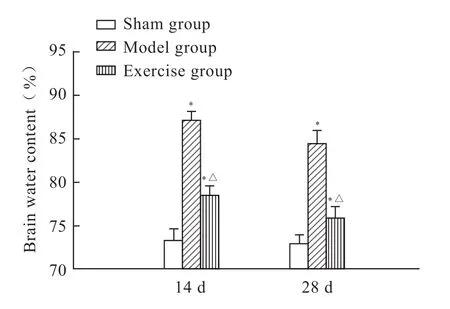
图 1 各组大鼠脑组织含水量的比较Fig 1 Comparison of brain water content of rats in each group
2.3 大鼠脑梗死体积的变化
假手术组大鼠脑组织中未见梗死灶。与假手术组相比,模型组大鼠14 d及28 d均有不同程度的梗死灶形成(P<0.05)。与模型组相比,跑台训练后大鼠脑梗死体积百分比显著降低(P<0.05)。结果表明运动训练可以缩小脑梗死体积,促进脑损伤恢复(图2)。

图 2 各组大鼠脑梗死体积Fig 2 Cerebral infarct volume of rats in each group
2.4 大鼠海马CA1区β-tubulin 的蛋白分布
β-tubulin阳性细胞质着色呈棕黄色,细胞核不着色,代表细胞骨架的完整性。假手术组大鼠海马CA1区可见较多β-tubulin阳性细胞,神经细胞胞质深棕褐色。在模型组大鼠β-tubulin阳性细胞数量减少且表达较弱。跑台训练可以增加大鼠海马CA1区β-tubulin阳性表达(图3)。
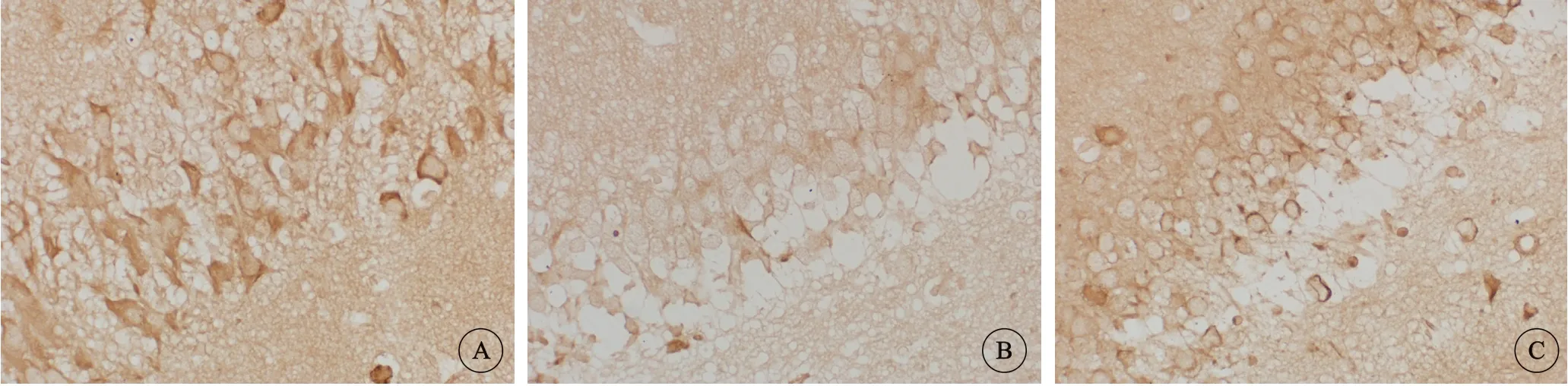
图 3 大鼠海马CA1区β-tubulin 免疫组织化学显色, ×400Fig 3 Immunostaining of β-tubulin in the hippocampal CA1 region of rats, ×400
2.5 大鼠海马组织β-tubulin与MAP-2 的蛋白表达变化
假手术组大鼠海马β-tubulin与MAP-2呈较高的蛋白表达量,维持神经元正常结构与功能。模型 组14、28 d大 鼠 海 马 组 织β-tubulin与MAP-2表达较相应时间点假手术组显著降低(P<0.05)。与相应时间点模型组相比,跑台训练组大鼠海马区β-tubulin与MAP-2表达明显升高(P<0.05),但仍低于假手术组(图4)。
3 讨论
本研究采用线栓法建立MCAO大鼠缺血模型,以评估跑台运动训练对大鼠脑梗死后的保护性疗效及相关作用机制。MCAO作为一种脑缺血的啮齿类动物模型,被广泛用于缺血性脑中风的病理机制及潜在治疗方法的基础研究[7]。急性脑梗死发生后,兴奋毒性谷氨酸信号激活、活性氧物质爆发、炎症介质大量释放等一系列复杂的分子事件,导致广泛神经元损伤和神经功能严重缺损[8]。结果表明,在众多类型神经细胞中海马CA1区锥体神经元对缺血状态最为敏感,这些神经元在学习和记忆功能中起着至关重要的作用[9]。研究显示脑缺血后的被动回避记忆障碍与锥体神经元的变性有关[10]。
本研究水迷宫检测已经证实脑梗死后大鼠存在严重的空间学习及记忆能力障碍,表现为逃避潜伏期延长,穿越平台次数及平台象限停留时间减少。接下来进一步探讨了大鼠脑梗死后早期给予跑台训练干预的疗效。多种形式的运动训练(跑台训练、网屏训练、平衡木训练和游泳训练等)已经被证实可预防、恢复或改善多种神经系统疾病,包括痴呆症、帕金森病、抑郁和睡眠困难等[11]。本实验Morris水迷宫实验结果显示:于运动训练后14 d及28 d大鼠逃避潜伏期显著缩短,穿越平台次数及平台象限停留时间增加,表明早期跑台训练可以明显改善大鼠脑梗死后的空间学习能力障碍。除此以外,在急性大鼠脑梗死模型中,也证实早期跑台训练运动训练可以减小脑梗死大鼠脑梗死体积、减轻脑水肿程度,有一定脑保护作用。
早期跑台训练对急性脑梗死大鼠学习记忆能力障碍的恢复及其脑保护性疗效已被证实,但是具体的疗效作用机制尚未完全阐明。谭来勋等[12]研究表明运动训练可增加脑梗死灶周围 3- 3- 甲戊二酰辅酶还原酶基因转录与翻译,有利于突触重塑,最终促进大鼠运动功能恢复。张逸仙等[13]报道跑台运动训练能够促进脑缺血后大鼠神经功能恢复,其机制可能与上调脑缺血周边区TGF-β/Smad3信号通路蛋白表达,进而抑制细胞凋亡有关。本研究主要关注的机制问题:跑台训练是否通过调控海马CA1区细胞骨架相关蛋白的表达修复损伤的锥体神经元,进而促进脑梗死大鼠学习记忆障碍的恢复。
神经元细胞骨架网络由肌动蛋白丝、微管和神经丝组成。这些细胞骨架聚合物在直径、亚细胞定位、机械刚度、极性、组装动力学等方面存在差异,这导致了在神经元中的独特结构和功能[14]。微管是轴突中形成一种刚性的轨道状结构,执行胞体和轴突末端之间物质传递。β-tubulin与 MAP-2是微管的重要结构蛋白。MAP-2在神经元的发育、分化、突起形成和突触可塑性等方面起着重要作用[15]。本实验结果显示脑梗死大鼠海马组织中β-tubulin 与MAP-2的蛋白表达与假手术组相比显著降低。与先前研究结果一致:β-tubulin 与MAP-2对于缺血损伤较为敏感,是脑缺血诱导神经元损伤的早期标记物[16]。神经元中的标志性MAP-2表达能反映脑梗死后海马区神经元的存活和功能,预示后期神经功能学改变。本研究结果显示给予跑台训练干预后,可以上调脑梗死大鼠海马组织中β-tubulin与MAP-2蛋白表达,促进大脑海马区损伤神经元的结构和功能恢复,进而改善大鼠的空间学习记忆能力。
综上所述,急性脑梗死后大鼠可出现空间学习记忆功能障碍,而早期跑台训练可改善脑损伤所致空间学习记忆能力障碍,及减少脑梗死体积及脑含水量。其作用机制可能与运动训练增强大鼠海马组织中细胞骨架相关蛋白β-tubulin与MAP-2表达,提高神经可塑性有关。

