人重组促红细胞生成素对大鼠创伤性颅脑损伤后神经细胞凋亡的影响及机制研究
沈 印,葛 剑,李 喆,姚 乐
创伤性颅脑损伤(traumatic brain injury ,TBI)是神经外科的常见疾病,在人类外伤性疾病的发病率中居第二位,具有很高的致死和致残率[1]。TBI病理过程包括原发性脑损伤和继发性脑损伤(secondary brain injury,SBI)[2]。
原发性脑损伤是受伤当时由直接机械损伤造成,SBI可在原发脑损伤数小时至数天后发生,包括炎症反应、细胞钙离子超载、自由基紊乱、脂质过氧化、线粒体功能障碍、细胞凋亡和弥漫性轴索损伤等[3]。原发性颅脑损伤无法干预,针对SBI,早期正确的临床干预治疗是降低TBI后病死率和致残率的关键。近来研究表明促红细胞生成素(recombinant human erythropoietin,Rh-EPO) 在TBI后具有神经保护作用。笔者观察Rh-EPO对大鼠TBI后神经细胞凋亡的影响,探讨其发挥神经保护作用的可能机制。
材料与方法
1 实验材料
1.1实验动物 健康雄性Wistar大鼠55只,鼠龄21周,体重(220±20)g,由武汉大学人民医院实验动物中心提供。SPF(Specefic pathogen Free)级饲养。 动物实验伦理学批号:SCXK桂.No2014-001。
1.2主要试剂 Rh-EPO(沈阳三生制药股份公司);二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒、兔抗鼠Bcl-2 多克隆抗体及链霉素抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)试剂盒(武汉博士德公司)。
2 方法
2.1动物分组及模型建立 将55只大鼠随机数字表法分成假手术组(5只)、 TBI组(25只)及 Rh-EPO组(25只);TBI组和Rh-EPO组按2、6、24、72、168 h时间点分为5个亚组,各5只。
将大鼠用盐酸氯胺酮(60mg/kg)腹腔注射麻醉后,其头部固定于Myneurolab脑立体定向仪上;沿中线切开头皮,暴露右顶骨,用牙科钻在冠状缝后1.5mm、中线旁2.5mm处钻孔并扩大为5mm×5mm骨窗,保持硬脑膜完整。用美国BenchmarkTM颅脑损伤撞击器撞击硬脑膜(速度4m/s,撞击面直径2mm,深度2mm,接触时间1s),致右顶叶脑挫裂伤;硬膜外置明胶海绵止血,骨蜡封闭骨窗,缝合头皮,以上均为无菌操作。假手术组除不撞击外,其他步骤同上。Rh-EPO组于TBI后立即经腹腔注射Rh-EPO 5 000IU/kg,假手术组和TBI组经腹腔注射等剂量0.9%氯化钠溶液(生理盐水)。假手术组于术后24h,模型建立后2、6、24、72、168h各组按时间点取标本,过量麻醉后迅速断头取脑组织标本。
2.2组织标本检查 处死大鼠后,取各组大鼠右顶叶相对完整脑皮层组织,用4%多聚甲醛溶液固定24~48h,石蜡包埋、切片、苏木精-伊红(hematoxylin-eosin,HE)染色。采用光显微镜观察组织学变化。
2.3免疫组织化学检测 取各组大鼠右顶叶相对完整脑皮层组织,经4%多聚甲醛溶液固定24~48h后,石蜡包埋、切片。采用SP法检测假手术组24h、TBI组、Rh-EPO组大鼠所取脑组织Bcl-2表达情况。操作按试剂盒说明进行。在光学显微镜下观察Bcl-2免疫反应的结果,并采用图像分析软件进行图像定量分析,测定各组Bcl-2蛋白阳性细胞数。Bcl-2蛋白主要分布在胞浆内,胞浆/胞膜有棕黄色物质沉积为阳性细胞。每张切片在创伤灶周围随机取5个高倍镜视野(×400)进行分析,Bcl-2用光密度(optical density,OD)值表示。
2.4流式细胞仪检测细胞凋亡率 (1)取假手术组右顶叶正常脑组织和其余两组损伤灶处新鲜脑组织约100mg,用PBS清洗,吸出PBS。用剪刀尽量剪碎脑组织,并用PBS洗1次,吸净PBS。(2)加入0.4%胰蛋白酶3.0mL,置于37 ℃水浴箱中水浴30min,其间不断摇晃。并吸净胰蛋白酶,用PBS洗1次,吸净PBS。(3)加入PBS 3.0mL,反复吹打1~2min,呈单细胞悬液,用400目筛网过滤,在1 000r/min条件下离心5min,去上清液。(4)加红细胞裂解液3mL,室温下振荡10min,在1 200r/min条件下离心10min,重复2次,去上清液。(5)加Bing buffer液190μL摇匀,加Annexin V 5μL避光染色10min,再加碘化丙啶(propidium iodide,PI)5μL,避光染色5min。应用Epics XL流式细胞仪记录氩离子激发光波长488nm处红色荧光,每个样本计数10 000个细胞,以细胞凋亡的百分率作为检测指标。
3 统计学分析
结 果
1 各组病理改变
右顶叶打击区域局部脑挫裂伤,脑组织肿胀,72h为最明显。400倍光学显微镜下,TBI组可见脑组织有明显的出血坏死灶、血管周围间隙增宽、神经细胞疏松,可见水肿、大量神经元细胞变性坏死、周围伴有炎性细胞浸润(图1c)。Rh-EPO组各亚组坏死区及周围水肿区范围较TBI组缩小,周围水肿减轻,变性坏死的神经元细胞减少;假手术组组织结构清晰,无脑组织肿胀,未见神经细胞变性坏死(图1a)。
2 各组Bcl-2水平比较
假手术组可见少量Bcl-2阳性细胞,TBI组2h后Bcl-2阳性细胞表达增多,差异有显著统计学意义(P<0.01);24h达高峰,72h出现下降。Rh-EPO组各亚组大鼠皮层可见大量Bcl-2阳性细胞表达,与TBI组比较,Rh-EPO组Bcl-2阳性细胞表达增加,差异有统计学意义(P<0.05)。见表1、图2。
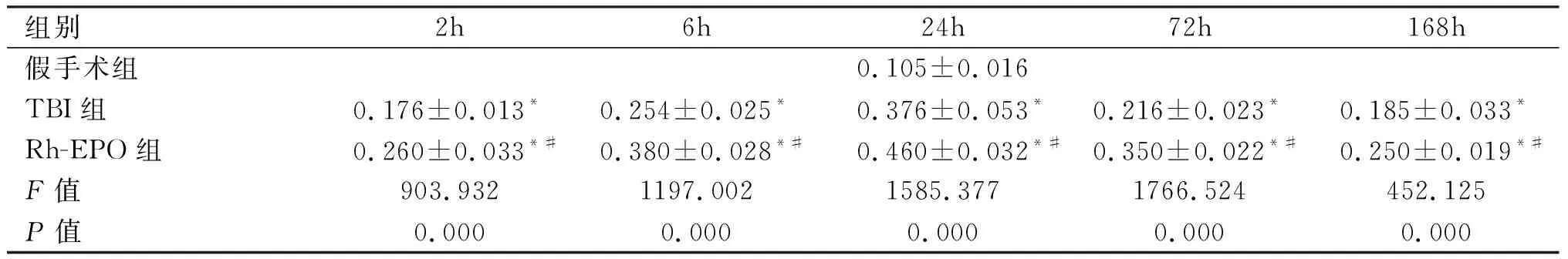
表1 各组大鼠脑组织Bcl-2免疫反应阳性神经元光密度比较
3 各组神经细胞凋亡率比较
假手术组见少量凋亡细胞,TBI组神经细胞凋亡率较假手术组明显增高(P<0.01),24h出现高峰。Rh-EPO组神经细胞凋亡率各亚组比TBI组低(P<0.05)。见表2、图3。
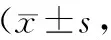
表2 各组大鼠TBI后神经细胞凋亡率比较个/HP)
讨 论
细胞凋亡是细胞接受某种信号后或受到某些因素刺激后一种主动的、由多种基因蛋白相互作用引起的细胞程序性死亡,是一个十分复杂的过程,在这一过程中Bcl-2基因家族起了重要的调控作用[4]。Bcl-2是凋亡抑制基因,可以阻止由钙离子超载、膜过氧化、自由基损伤等因素引起的神经细胞凋亡,其调控凋亡的机制可能是通过组织细胞色素C和DL-ATP从线粒体向胞质释放,引发caspase-9激活,抑制细胞凋亡[5-6]。TBI后神经细胞的死亡主要表现为坏死和凋亡两种形式。细胞凋亡是TBI后神经细胞迟发性死亡的主要机制,它加重了脑组织损伤的程度[7]。因此,抗神经细胞凋亡成为TBI救治研究的新方向。
EPO是一种糖蛋白,相对分子质量约为34 000,血浆中存在的EPO由165个氨基酸组成,主要在肾脏合成,作用于造血系统,是合成红细胞主要刺激因子。近来研究发现,EPO等造血生长因子不仅参与造血的调控,且对神经系统也具有直接保护作用[8]。EPO及其受体在神经细胞系统内有表达,EPO作为中枢神经系统内源性细胞因子,通过神经元和胶质细胞的旁分泌作用,作用于神经元EPO受体,发挥神经保护和神经营养作用[9]。Rh-EPO 是一种通过基因重组技术合成的糖蛋白,与天然EPO 有着相同氨基酸序列,生物学活性也相似。Rh-EPO也可在任何无损伤的情况下可以透过血脑屏障,通过Rh-EPO受体发挥神经保护作用。大鼠脑室周围白质损伤模型(periventricular white matterdamage,PWMD)模型中,Rh-EPO促进了脑白质区的血管新生反应[10]。在大鼠脑缺血性实验模型的研究显示,Rh-EPO 可通过抗神经细胞凋亡及活化、阻断兴奋性氨基酸神经毒性、阻止一氧化氮生成及减轻炎症反应等,改善由低氧造成的神经元损伤,发挥神经保护作用[11-12]。在大鼠高氧脑损伤模型中[13],Rh-EPO 可减少海马神经元损伤,减轻脑水肿程度。
笔者实验HE染色发现,颅脑皮层挫裂伤区及其周围水肿区可见大量凋亡的神经细胞。Rh-EPO组坏死区及周围水肿区范围较TBI组缩小,周围水肿减轻,凋亡细胞减少。Bcl-2免疫组织化学染色结果,TBI组Bcl-2表达明显较假手术组增高,而Rh-EPO组较TBI组表达增加,同时用流式细胞仪技术检测神经细胞凋亡率,Rh-EPO组神经细胞凋亡率明显低于TBI组。
笔者研究表明,Rh-EPO能通过提高Bcl-2表达,减少神经细胞凋亡,具有一定的神经保护作用。Rh-EPO作为一种新型脑保护剂,目前成为研究热点,也许在不久将来即可应用于临床治疗TBI患者。

