大豆GmGolS基因的原核表达及抗旱性分析
邱爽 何佳琦 李铭杨 翟莹

摘要:肌醇半乳糖苷合成酶(galactinol synthase,简称GolS)是棉子糖系列寡糖(raffinose family oligosaccharides,简称RFOs)生物合成途径中的关键酶,在植物应对非生物胁迫的过程中发挥着重要作用。通过逆转录(RT)-PCR从大豆叶片cDNA中扩增得到编码肌醇半乳糖苷合成酶的基因GmGolS,再将GmGolS基因构建到原核表达载体pET28上,然后将载体导入大肠杆菌Rosetta(DE3)中,对其进行异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalacto pyranoside,简称IPTG)诱导。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,简称SDS-PAGE)结果表明,在诱导时间为3 h、IPTG浓度为0.1 mmol/L的条件下,可以获得大量重组蛋白,分子量约为40 ku。对表达GmGolS蛋白的大肠杆菌进行抗旱性分析的结果显示,GmGolS基因在大肠杆菌中的过表达降低了重组菌的生活力,使其对干旱胁迫更加敏感。
关键词:大豆;肌醇半乳糖苷合成酶;原核表达;抗旱性
中图分类号:S565.101 文献标志码: A
文章编号:1002-1302(2020)14-0061-04
植物在遭受不良环境条件胁迫后,可以诱导自身合成大量渗透调节物质来增加植物细胞的渗透压,提高其抵抗胁迫的能力,从而维持其自身的代谢和生长发育。棉子糖系列寡糖(raffinose family oligosaccharides,简称RFOs)就是这些渗透调节物质的典型代表,它们是高等植物中含量仅次于蔗糖的一类可溶性糖。肌醇半乳糖苷合成酶(galactinol synthase,简称GolS)是RFOs生物合成途径中的关键酶[1]。目前已有大量关于GolS基因受逆境胁迫诱导表达的报道,且超量或异源表达该基因可以不同程度地提高转基因植物的抗逆性。拟南芥中含有7种GolS基因,其中AtGolS1、AtGolS2基因可以被干旱、高盐胁迫诱导上调表达,AtGolS3基因可以被低温胁迫诱导上调表达[2]。在AtGolS1、AtGolS2基因过表达转基因植株中,肌醇半乳糖苷、棉子糖含量均增加,使得植物对氧化胁迫的耐受能力增强[3]。小麦TaGolS3基因的表达受到外源脱落酸(abscisic acid,简称ABA)、低温、盐胁迫诱导,同时还能被ZnCl2、CuCl2诱导,通过对活性氧的调控,转基因植株能够表现出对锌胁迫的耐受性[4]。GolS基因的抑制表达则使植物对胁迫更加敏感。例如AtGolS1基因的T-DNA插入突变体植株与野生型植株相比,抗热性明显降低[5]。GolS基因表达的调控机制较为复杂,目前已经发现多种植物转录因子可以调控其表达,如HSF、DREB和WRKY等[6-8]。
大豆(Glycine max L.)是世界范围内广泛种植的经济作物之一,不仅是人类获取蛋白质和脂类的主要来源,同时也是重要的牲畜饲料。大豆中GolS基因的功能鉴定对于大豆棉子糖系列寡糖(raffinose family oligosaccharides,简称RFOs)代谢途径及大豆抗逆机制的研究都具有重要意义。但到目前为止,有关大豆中肌醇半乳糖苷合成酶的研究非常少。本研究将大豆中1个编码肌醇半乳糖苷合成酶的基因GmGolS转化大肠杆菌并进行诱导表达条件的优化与抗旱性分析,以期为该基因的功能研究打下基础。
1 材料与方法
1.1 材料与试剂
本试验于2018年10月在黑龙江省齐齐哈尔市齐齐哈尔大学植物分子育种研究室进行。大豆品种北豆9号、原核表达载体pET28及大肠杆菌DH5α菌株、Rosetta(DE3)菌株均由齐齐哈尔大学植物分子育种研究室提供。克隆载体pMD18-T、各种限制性内切酶、DNA连接酶、DNA marker DL 2000、Ex Taq、RNAiso Plus购自TaKaRa公司;低分子量蛋白marker、cDNA反转录试剂盒购自Novoprotein公司;质粒提取试剂盒和DNA凝胶回收试剂盒购自TIANGEN公司。
1.2 试验方法
1.2.1 大豆叶片总RNA的提取及cDNA反转录 使用RNAiso Plus提取0.1 g大豆叶片总RNA,具体操作参照说明书。用琼脂糖凝胶电泳和D260 nm/280 nm检测提取的RNA质量。使用cDNA反转录试剂盒合成第一链cDNA。
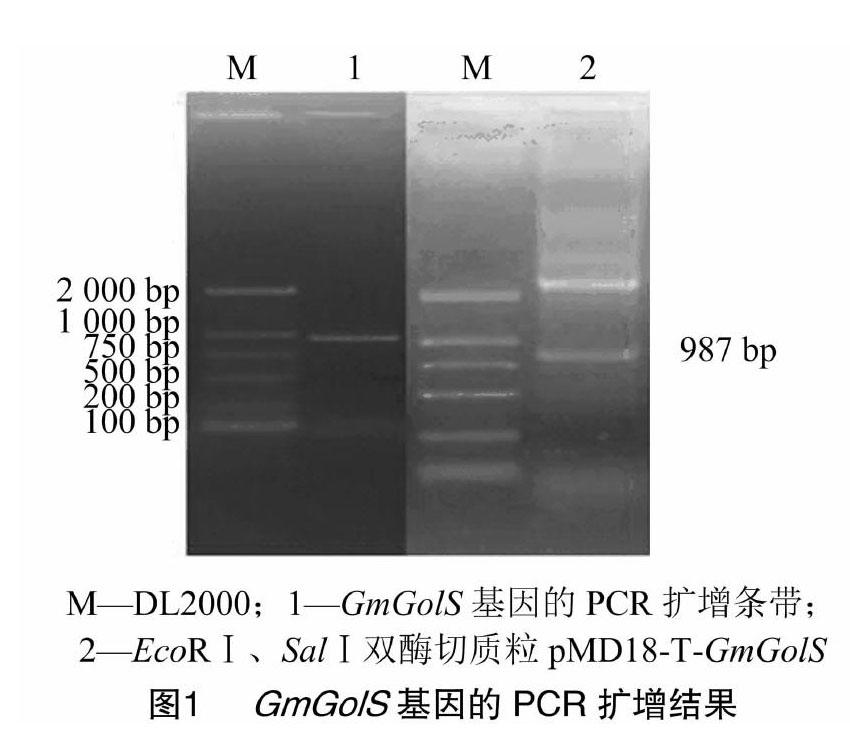
1.2.2 目的基因的扩增 在美国国家生物技术信息中心(National Center for Biotechnology Information,简称NCBI)数据库中搜索编码大豆GolS基因的序列。利用Primer 5软件,根据GmGolS基因的编码序列设计引物。上游引物序列為5′-GGAATTCATGGCTCCTAATATCACCACTG-3′,下游引物序列为5′-TGCGGTCGACTTAAGCAGCAGATGGGGC-3′,上游、下游引物序列中的下划线部分分别代表EcoRⅠ、SalⅠ 酶切位点。以合成的第一链cDNA作为模板,PCR扩增GmGolS基因(退火温度为56 ℃)。将扩增产物经琼脂糖凝胶电泳后,回收目的基因片段并连接到pMD18-T载体上,转化大肠杆菌DH5α感受态细胞,经质粒双酶切鉴定,挑取阳性克隆送至生工生物工程(上海)股份有限公司测序。
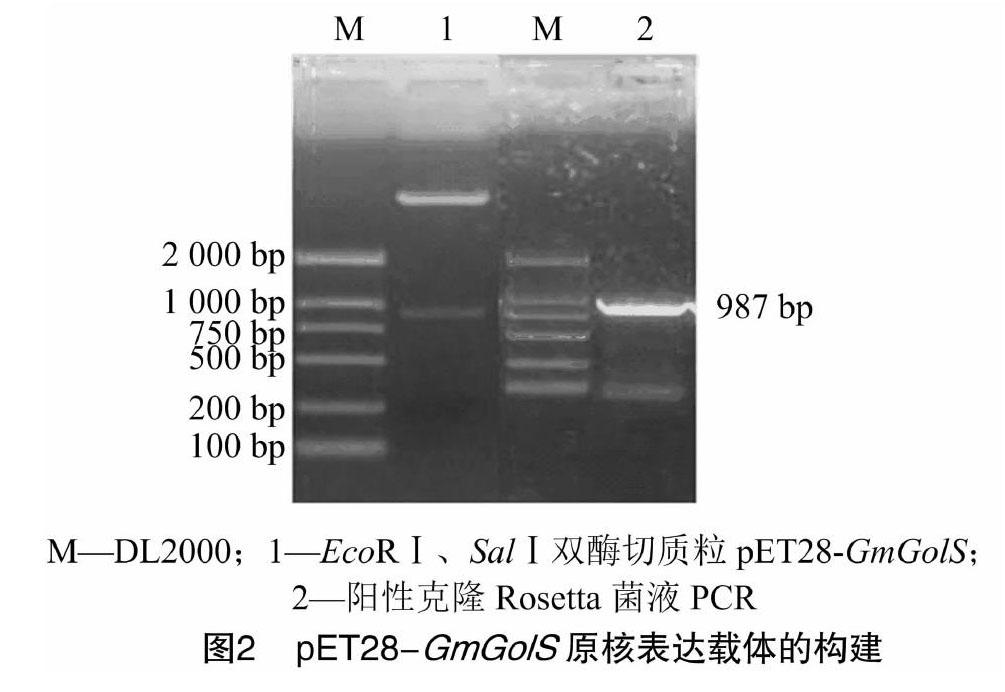
1.2.3 原核表达载体的构建 将测序正确的含有目的基因的克隆载体扩繁并提取质粒,用EcoRⅠ、SalⅠ进行双酶切,同时将载体pET28用EcoRⅠ、SalⅠ进行双酶切,经琼脂糖凝胶电泳后,回收目的片段,通过DNA连接酶将酶切片段定向连接到pET28载体上,再用该载体转化大肠杆菌Rosetta(DE3)感受态细胞,经菌落PCR和质粒双酶切鉴定后,挑取阳性克隆,保存菌种备用。
1.2.4 重组蛋白的诱导表达 挑取pET28-GmGolS阳性克隆和pET28空载体克隆至添加 50 mg/L 卡那霉素和15 mg/L氯霉素的LB液体培养基中,37 ℃振荡培养过夜。按1 ∶100的体积比转接至20 mL LB液体培养基中,37 ℃继续振荡培养至D600 nm为0.4左右时,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalacto pyranoside,简称IPTG),分别诱导培养1、2、3、4、5、6 h后,取样并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,简称SDS-PAGE),确定最佳诱导时间。使用同样的方法,分别加入终浓度为0.1、0.2、0.3 mmol/L的IPTG进行诱导培养,以确定最佳IPTG诱导浓度。
1.2.5 表达GmGolS蛋白的大肠杆菌干旱胁迫分析 将pET28-GmGolS重组大肠杆菌及含有pET28空载体的大肠杆菌按照优化后的最优条件(诱导时间为3 h、IPTG诱导浓度为0.1 mmol/L)进行诱导表达。将诱导后的菌液均稀释至同一浓度(D600 nm=0.8),各取10 μL,稀释10 000倍,取 100 μL 分别涂布到不含PEG-8000和含1% PEG-8000的固体LB培养基上(含有50 mg/L卡那霉素、15 mg/L氯霉素),于37 ℃培养12~16 h,观察并拍照。
2 结果与分析
2.1 GmGolS基因的克隆
在NCBI数据库中检索获得编码大豆GolS基因的序列GmGolS,其GenBank登录号为NM001251098。以大豆叶片cDNA为模板,扩增得到987 bp的GmGolS基因全序列(图1),经测序与原序列一致。预测结果显示,GmGolS基因编码含有328个氨基酸的蛋白质,分子量大小为38.03 ku。
2.2 GmGolS基因原核表达载体的构建
通过酶切位点将GmGolS基因构建到原核表达载体pET28上,质粒双酶切和菌液PCR结果见图2,可见GmGolS基因已成功连接至pET28载体上并获得了含有重组质粒的Rosetta(DE3)菌株。
2.3 重组蛋白的诱导表达
为了大量获得GmGolS重组蛋白,对IPTG诱导时间和诱导浓度进行优化,结果(图3)表明,3~8 泳道与对照(空载体及未诱导菌株)相比,在约 40 ku 处有目的蛋白的表达。GmGolS蛋白分子量为 38.03 ku,加上6个组氨酸标签,融合蛋白分子量约为40 ku,因此表达的重组蛋白大小与预期结果相符,但在对照中无此蛋白表达,表明GmGolS基因已经在大肠杆菌中成功表达。由图3还可以看出,IPTG诱导1 h时已出现重组蛋白,随着诱导时间的延长,重组蛋白的表达量随之增加,到3 h时达到最大值,之后差别不大。因此,在后续试验中将诱导时间设为3 h。
图4是在不同IPTG诱导浓度下重组蛋白表达的SDS-PAGE结果。可以看出,当IPTG浓度为01 mmol/L时,重组蛋白的表达量已达到最大值,并且不同浓度间的差别不大。由此可知,不同IPTG浓度在诱导蛋白表达时差异不明显,IPTG诱导浓度选择0.1 mmol/L即可。
2.4 表达GmGolS蛋白的大肠杆菌干旱胁迫分析
为了选择最佳诱导条件,设IPTG诱导浓度为0.1 mmol/L,对重组菌诱导3 h后进行抗旱性分析。如图5所示,在未添加PEG-8000的培养基上,与转化空载体pET28的大肠杆菌相比,表达GmGolS蛋白的重组大肠杆菌的生长受到明显抑制。在含有1% PEG-8000的培养基上,表达GmGolS蛋白的大肠杆菌的生长继续受到抑制,虽然含有对照空载体的大肠杆菌生长也受到了抑制,但其活性仍明顯高于表达GmGolS蛋白的大肠杆菌。由此可见,GmGolS蛋白在大肠杆菌中的过表达降低了重组菌的生活力,使其对干旱胁迫更加敏感。
3 讨论
肌醇半乳糖苷合成酶(galactinol synthase,简称GolS)催化尿嘧啶二磷酸(uridine diphosphate,简称UDP)-半乳糖和肌醇合成肌醇半乳糖苷的反应,是棉子糖代谢通路中物质合成的第一步,也是棉子糖系列寡糖(raffinose family oligosaccharides,简称RFOs)合成的限速步骤[1,9]。越来越多的研究结果表明,GolS基因在植物的抗逆反应、光合产物转运和种子发育中发挥着重要作用[10]。进一步研究GolS基因的表达与GolS酶活性、RFOs的积累及植物抗逆性的关系,能够为植物抗逆新品种的培育提供更全面的理论基础。
大肠杆菌表达系统是目前应用最为广泛的原核表达系统,融合蛋白在该系统中的表达结果可受多种因素影响,如诱导温度、诱导剂浓度、诱导时间等[11-12]。本试验将大豆肌醇半乳糖苷合成酶基因GmGolS构建到原核表达载体上并转入大肠杆菌中,经IPTG诱导及条件优化(IPTG诱导浓度和诱导时间的优化),结果显示,该基因能够在大肠杆菌中表达,融合蛋白分子量大小约为40 ku。但是本研究结果显示,IPTG诱导浓度对重组蛋白表达量的影响不大,这与前人的某些试验结果相似[13-14]。笔者也尝试对GmGolS重组蛋白进行纯化回收,但表达的重组蛋白主要以包涵体的形式存在(结果未列出)。推测出现这种情况的原因可能是温度过高等,使蛋白合成速度过快,导致蛋白质来不及进行折叠及二硫键的配对,或是由于蛋白质的非特异性结合而使重组蛋白无法达到足够的溶解度[15-16]。前人曾将木薯、沙冬青的GolS基因在大肠杆菌中进行抗性鉴定,结果表明,GolS基因过表达的大肠杆菌分别获得了耐旱性及耐寒性[17-18]。但在本试验中,GmGolS基因过表达的大肠杆菌干旱胁迫结果与范洁等的研究结果[17]不一致,推测可能由于GmGolS重组蛋白在大肠杆菌中的超量表达破坏了大肠杆菌的生理及代谢平衡,导致其对干旱胁迫更加敏感。说明由于表达系统不同,导致部分真核生物的基因不能在原核生物中进行功能鉴定。本研究结果为进一步的GmGolS蛋白理化性质及基因功能研究打下了理论基础。
4 结论
本研究采用RT-PCR方法,从大豆叶片cDNA中扩增得到编码肌醇半乳糖苷合成酶的基因GmGolS。再将GmGolS基因构建到原核表达载体pET28上,随后将该载体导入大肠杆菌Rosetta(DE3)中,对其进行IPTG诱导。在诱导时间为3 h、IPTG浓度为0.1 mmol/L的条件下,可获得大量重组蛋白,相对分子量约为40 ku。对表达GmGolS蛋白的大肠杆菌进行抗旱性分析,结果显示,GmGolS基因在大肠杆菌中的过表达降低了重组菌的生活力,使其对干旱胁迫更加敏感。
参考文献:
[1]El Sayed A I,Rafudeen M S,Golldack D. Physiological aspects of raffinose family oligosaccharides in plants:protection against abiotic stress[J]. Plant Biology,2014,16(1):1-8.
[2]Taji T,Ohsumi C,Iuchi S,et al. Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana[J]. Plant Journal,2002,29(4):417-426.
[3]Nishizawa Y A,Yabuta Y,Shigeoka S. The contribution of carbohydrates including raffinose family oligosaccharides and sugar alcohols to protection of plant cells from oxidative damage[J]. Plant Signal Behavior,2008,3(11):1016-1018.
[4]Wang Y,Liu H,Wang S,et al. Overexpression of a common wheat gene GALACTINOL SYNTHASE3 enhances tolerance to zinc in Arabidopsis and rice through the modulation of reactive oxygen species production[J]. Plant Molecular Biology Reporter,2016,34(4):794-806.
[5]Peterbauer[KG*2]T,Lahuta[KG*2]L B,Blochl A,et al. Analysis of the raffinosefamily oligosaccharide pathway in pea seeds with contrasting carbohydrate composition[J]. Plant Physiology,2001,127(4):1764-1772.
[6]Panikulangara[KG*2/3]T[KG*2/3]J,Eggers-Schumacher[KG*2/3]G,Wunderlich[KG*2]M,et[KG*2]al.
Galactinol synthase1,a novel heat shock factor target gene responsible for heat-induced synthesis of raffinose family oligosaccharides in Arabidopsis[J]. Plant Physiology,2004,136(2):3148-3158.
[7]Maruyama K,Takeda M,Kidokoro S,et al. Metabolic pathways involved in cold acclimation identified by integrated analysis of metabolites and transcripts regulated by DREB1A and DREB2A[J]. Plant Physiology,2009,150:1972-1980.
[8]Wang L,Shang H,Liu Y X,et al. A role for a cell wall localized glycine-rich protein in dehydration and rehydration of the resurrection plant Boea hygrometrica[J]. Plant Biology,2009,11(6):837-848.
[9]Liu J J,Krenz D C,Galvez A F,et al. Galactinol synthase (GolS):increased enzyme activity and levels of mRNA due to cold and desiccation[J]. Plant Science,1998,134(1):11-20.
[10]Zhou T,Zhang R,Guo S D. Molecular cloning and characterization of GhGolS[STBX]1[STBZ],a novel gene encoding galactinol synthase from cotton (Gossypium hirsutum) [J]. Plant Molecular Biology Reporter,2012,30(3):699-709.
[11]王 寧,陈 静,高 飞,等. 盐芥TsGPX3基因的克隆、亚细胞定位与原核表达[J]. 生物技术通报,2016,32(4):110-115.
[12]李秀娟. 盐藻DsRab基因的载体构建、原核表达及亚细胞定位分析[D]. 大连:大连海洋大学,2014:32-35.
[13]杨泽伟,王龙海,朱 莉,等. 高粱SbGABA-Ts基因的克隆、原核表达及纯化[J]. 生物技术通报,2015,31(5):93-99.
[14]廖小淼,何其光,刘 耀,等. 橡胶树炭疽菌CsPbs2基因的原核表达分析[J]. 分子植物育种,2019,17(7):2126-2132.
[15]常 丽,赵小英,郭 明,等. GA2ox1氧化酶基因的克隆及原核表达[J]. 西北植物学报,2010,30(6):1099-1104.
[16]许雨晨,吕 哲,陈保善,等. 稻瘟病菌Dam1基因的克隆、原核表达及纯化[J]. 基因组学与应用生物学,2016,35(9):2385-2389.
[17]范 洁,王雨晴,李瑞梅,等. 木薯中肌醇半乳糖苷合成酶基因在大肠杆菌中的表达[J]. 分子植物育种,2015,13(5):1027-1032.
[18]宋 健. 沙冬青耐寒基因AmGolS的克隆和遗传转化研究[D]. 泰安:山东农业大学,2007:44-45.
收稿日期:2019-11-06
基金项目:黑龙江省普通本科高等学校青年创新人才培养计划(编号:UNPYSCT-2017153);黑龙江省省属高等学校基本科研业务费科研项目(植物性食品加工技术特色学科专项)(编号:YSTSXK201878);黑龙江省省属高等学校基本科研业务费科研项目(编号:135209264)。
作者简介:邱 爽(1995—),男,山东济宁人,硕士,主要从事大豆分子育种研究。E-mail:qs187143@163.com。
通信作者:翟 莹,博士,副教授,主要从事大豆分子育种研究。E-mail:fairy39809079@126.com。

