利用CRISPR/Cas9系统编辑拟南芥ILR3基因及功能验证
李鹏

摘要:拟南芥转录因子ILR3(IAA-Leucine Resistant 3)在铁稳态的调节、葡萄糖异硫氰酸鹽(glucosinolate,简称GLS)的生物合成和病原体响应方面起到重要作用。为更深入探索该转录因子在植物体内的更多功能,利用YAO基因启动子驱动Cas9在拟南芥中表达,成功获得ILR3基因编辑突变体。测序结果及序列分析结果表明,在ILR3编辑拟南芥中,该基因编码区发生了碱基缺失或插入,导致蛋白ILR3保守结构域丢失。并且,这些基因编辑突变体T2代幼苗与T-DNA插入突变体ilr3-2在缺铁环境下表现出相同的性状,进一步验证ILR3转录因子在植物对铁的吸收及体内平衡的作用,也为深入研究其更多生物学功能奠定了工作基础。
关键词:拟南芥;AtILR3;YAO启动子; CRISPR/Cas9;基因编辑
中图分类号: Q784 文献标志码: A
文章编号:1002-1302(2020)14-0078-05
CRISPR/Cas9(clustered regularly interspersed short palindromic repeats /CRISPR-associated protein 9)系统已被用于基因组编辑,具有很高的准确性,并能高效完成真核基因组中基因敲除(knockout/knockin)和点突变[1],在人类细胞[2-3]、植物[4]、动物[5]、微生物[6]中均得到了很好的应用,并取得了举世瞩目的成果。YAO参与拟南芥的胚胎发生及配子发育,主要表达于分裂能力强的组织中[7];中科院遗传与发育生物学研究所谢旗研究组通过YAO基因启动子驱动Cas[STBX]9[STBZ],极大地提高CRISPR/Cas9编辑拟南芥基因组的效率[8]。
AtbHLH105/AtILR3(IAA-Leucine Resistant 3)基因属于拟南芥bHLH家族Ⅳc亚家族[9],所编码的蛋白可与其他诸多蛋白协同作用,共同参与植物铁稳态的调节[10-11]。
笔者所在课题组在长期的研究中发现,ILR3在植物生长发育过程中发挥更多的生物学功能。因此,本研究首次利用YAO基因启动子驱动的Cas9编辑拟南芥ILR3基因,所获得的基因编辑株系发生碱基插入和缺失,与T-DNA插入突变体ilr3-2在缺铁处理时具有相同的表型,与文献报道结果一致,为研究ILR3在生物体中的更多功能,奠定工作基础。
1 材料与方法
1.1 材料
本试验所用拟南芥(Arabidopsis thaliana)野生型为Col-0,突变体ilr3-2(Salk_004997C)购买自网站https://www.arabidopsis.org/,双元表达载体pYAO-Cas9-SK由中国科学院遗传与发育生物学研究所谢旗研究组馈赠,大肠杆菌(Escherichia coli) DH5α和根癌农杆菌(Agrobacterium tumefaciens) EHA105由笔者所在实验室保存。限制性内切酶BamHⅠ购自NEB(北京)公司,质粒提取和胶回收试剂盒购自天根生化科技(北京)有限公司,T载体、DNA连接试剂盒、Taq DNA聚合酶购自宝日医生物技术(北京)有限公司,其他生化试剂及引物购自生工生物工程(上海)股份有限公司。
1.2 拟南芥AtILR3编辑靶位点的确定
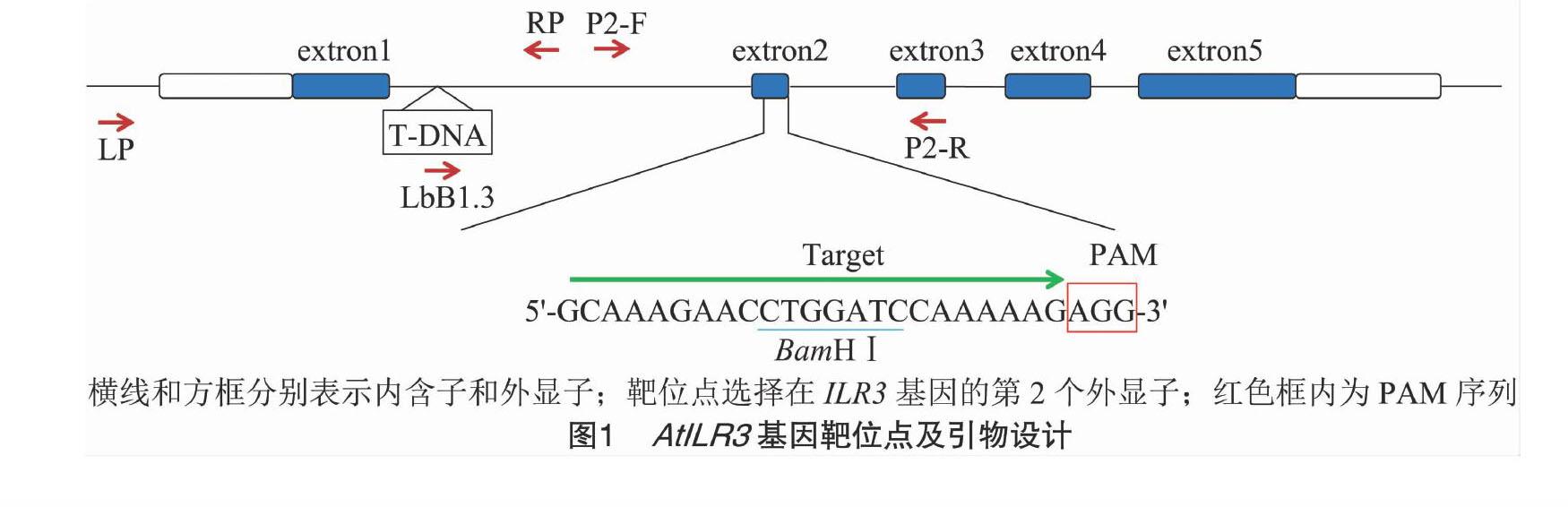
将拟南芥AtILR3基因(At5g54680)提交NCBI检索,获得其基因序列及外显子序列信息,在外显子区域寻找PAM(protospacer adjacent motif)位点为“NGG”的23 bp序列,且该序列最好带有酶切位点,并通过拟南芥bHLH家族各成员同源序列比对验证该靶位点的特异性。针对筛选到的靶位点,在序列5′端添加BsaⅠ限制性内切酶的黏性末端接头TGATT和AAAC,分别设计引物P1-F和P1-R(表1)。
1.3 gRNA的合成及与载体的连接
将10 μmol/L的P1-F和P1-R各取1 μL,加入到8 μL退火缓冲液(TE+50 mmol/L NaCl)中,混匀后在PCR仪中退火:从95 ℃缓慢降温至 16 ℃,速率为0.1 ℃/s;取1 μL退火产物,与用 BsaⅠ 酶切过的载体pYAO-Cas9-SK进行连接,体系如下:1 μL 退火产物,1 μL载体,1 μL 10×T4缓冲液,0.5 μL T4连接酶,加ddH2O至10 μL,连接条件为25 ℃反应2 h。采用热激法转化大肠杆菌DH5α感受态细胞,经筛选鉴定后测序。将测序正确质粒导入农杆菌感受态EHA105。
1.4 拟南芥遗传转化及基因编辑植株的获得
采用浸花法对拟南芥进行转化[12],收集转化后的T0代种子,干燥后,75%乙醇消毒1 min,10%次氯酸钠消毒10 min,无菌水漂洗5次,均与播种于含潮霉素25 mg/L的1/2MS表面进行抗性筛选,培养条件为22 ℃,16 h光照,8 h黑暗。
2周后,选取有潮霉素抗性的拟南芥幼苗,移栽至土壤基质中生长,同时摘取1张叶片,采用改良的CTAB法提取基因组DNA,并以此DNA为模板,以潮霉素抗性基因序列设计引物HygR-F、HygR-R(表1),进行PCR鉴定。PCR体系:在20 μL反应体系中,Taq DNA聚合酶1.0 U,dNTP各0.25 μmol/L,引物0.5 μmol/L,100 ng模板DNA。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火 30 s,72 ℃延伸1.5 min,循环30次;72 ℃延伸 10 min,4 ℃保存。1%琼脂糖凝胶电泳后检测,能完整扩增出潮霉素抗性基因的个体为转基因拟南芥阳性植株。T1、T2代拟南芥阳性植株采用相同方法鉴定。
根据基因AtILR[STBX]3[STBZ]序列,在靶位点上下游200~300 bp处设计引物P2-F、P2-R(表1、图1),以T2代转基因拟南芥阳性植株的基因组DNA为模板,再次进行PCR,反应体系与程序与上述相同,扩增产物为含靶位点的562 bp的片段。电泳后,回收目的片段,取其中一部分进行限制性内切酶处理。将未被切开的PCR片段克隆到T载体,转化至大肠杆菌中,并对插入片段进行菌落PCR,阳性克隆进行质粒提取并测序。
1.5 AtILR3编辑拟南芥的表型分析
将拟南芥野生型、ilr3-2突变体及获得的4个株系的ILR3编辑拟南芥T1代幼苗,播种于1/2MS、1/2MS-Fe和1/2MS-Fe+50 μmol/L菲洛嗪(ferrozine,Frz)培养基,2周后,拍照并统计最长根长度。
采用三引物法[13]对ilr[STBX]3-2[STBZ]突变体进行鉴定,引物LP、RP和LbB1.3位点及序列见图1和表1。
2 结果与分析
2.1 AtILR3编辑靶位点的筛选及载体构建
序列分析结果表明,AtILR3基因包5个外显子,4个内含子,编码区全长705 bp,根据CRISPR/Cas9 设计原理,选择其第2个外显子上的特异序列为编辑靶序列(图1),并且该靶位点PAM序列前6 bp包含1个BamHⅠ限制性内切酶位点(GGATCC),方便检测。
根据靶位点序列合成靶点接头引物P1-F和P1-R,退火形成靶点接头后克隆到CRISPR/Cas9 载体pYAO-Cas9-SK[8],测序后将正确质粒导入农杆菌感受态EHA105。
2.2 拟南芥基因编辑植株的获得及鉴定
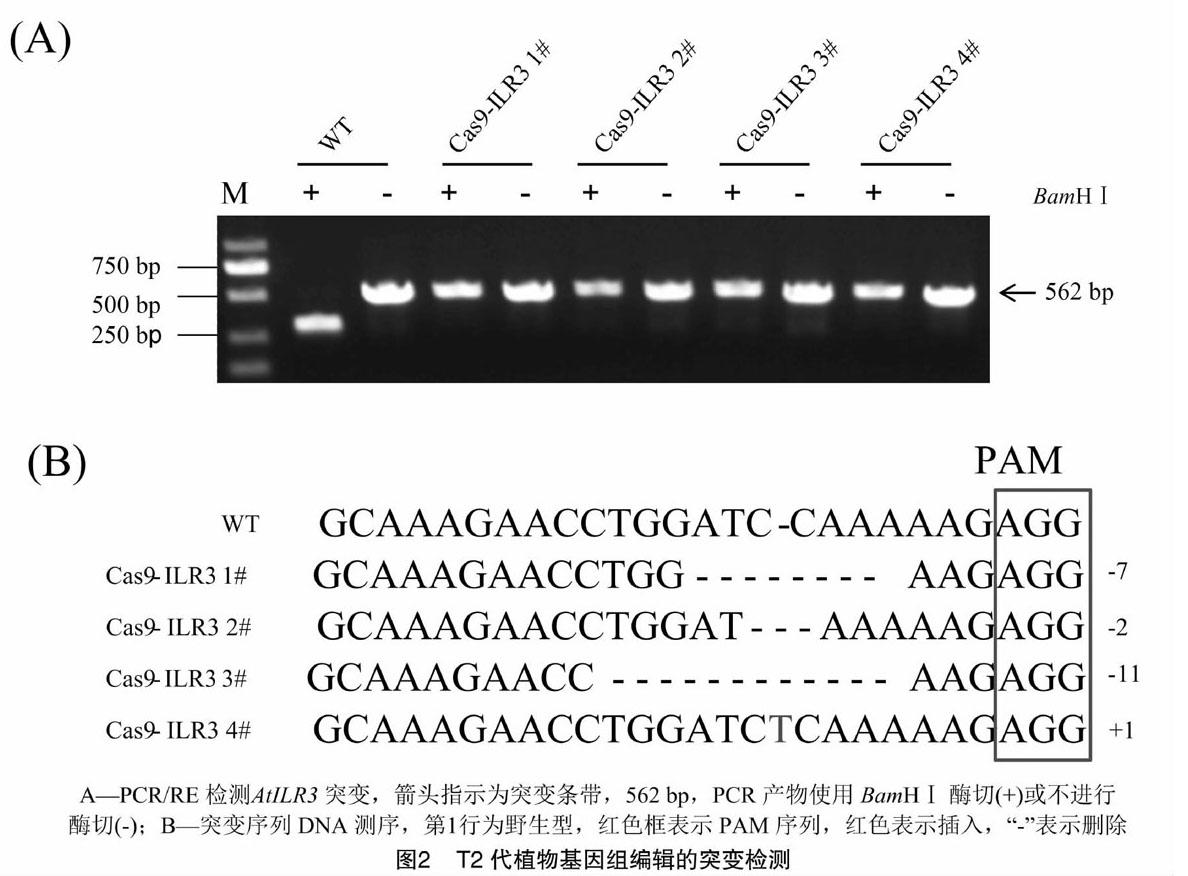
利用引物HygR-F、HygR-R做PCR鉴定得到转基因阳性苗;利用P2-F、P2-R为引物,阳性苗基因组DNA为模板,扩增出含靶位点的DNA片段;回收此片段,用BamHⅠ酶切鉴定电泳后,获得4株ILR3基因编辑拟南芥幼苗。如图2-A所示,野生型的片段被BamHⅠ识别,并完全切断为2个长度分别为276 、286 bp的片段(由于2个片段大小过于接近,电泳结果只看到1条带),而突变片段的扩增产物则无法被识别和切割。
将未消化的PCR片段克隆到T载体中,转化大肠杆菌,并将插入片段进行菌落PCR,阳性单菌落培养过夜后提取质粒进行测序。结果表明,在靶点位置发生不同类型的编辑,在PAM序列前3~7 bp分别产生了插入和缺失突变, 其中缺失突变占多数(图2-B)。
2.3 AtILR3编辑拟南芥的表型
拟南芥ILR3蛋白在铁动态平衡的调控过程中发挥着重要作用,突变体在缺铁环境中出现黄化、发育不良等表型[10-11]。将野生型、ilr[STBX]3-2[STBZ]纯合突变体及筛选得到的4个基因编辑T1代幼苗播种于1/2MS、1/2MS-Fe和1/2MS-Fe+50 μmol/L Frz培养基,2周后发现,4个基因编辑株系的幼苗与ilr3-2突变体出现相同的表型,均弱于野生型(图3-A)。数据显示,在含有铁元素的1/2 MS上,6个株系的拟南芥生长状况基本无差异;在缺铁培养基上,野生型根系明显增长,由约1.8 cm增长到约74 cm,而突变体ilr[STBX]3-2[STBZ]和4个基因编辑株系仅增长到约2.7 cm;Frz可以螯合培养基中琼脂中的微量铁元素[14],在1/2MS-Fe+50 μmol/L Frz 的培养基上,虽然ilr[STBX]3-2[STBZ]和基因编辑株系最长根长度影响不大,但侧根减少,长势更弱,而野生型影响较小(图3-B)。
为鉴定T-DNA插入突变体ilr3-2是否为纯合子,采用三引物法对10棵突变体单株和野生型进行PCR鉴定。电泳结果(图3-C)表明,可以证明所用突变体ilr3-2为纯合子,以上表型数据可信。
3 讨论
CRSPR/Cas9是一种高效且简便的基因定点编辑技术,该技术具有合成简单、周期短、操作灵活、效率高等优点,给基因工程带来技术性革命,在众多植物基因编辑中已经得到了成功应用,如拟南芥[15]、水稻[16]、玉米[17]、小麦[18]、大豆[19]、矮牵牛[20]、巨桉[21]等。将这一技术应用于拟南芥的遗传转化过程中,多采用农杆菌介导的浸花法来进行,因而囊胚是T-DNA的主要靶点[22]。35S和泛素启动子常用于驱动Cas[STBX]9[STBZ]基因在拟南芥的中表达,前者应用得更多。而已有的研究表明,CaMV 35S启动子在生殖细胞中活性极低,用CaMV 35S驱动的Cas[STBX]9[STBZ]对拟南芥基因组的编辑效率明显低于水稻,并且绝大多数T1植株只是体细胞突变,并不能遗传到T2[23-24]。YAO是一个在细胞分裂旺盛组织优先表达的基因,尤其在胚、胚囊、胚乳以及花粉中有很高的表达量[7];谢旗研究组用该基因的启动子pYAO代替35S启动子来启动Cas9的表达,提高了编辑效率并获得生殖系突变,且编辑形式更多[8]。因此,本研究也利用启动子pYAO來驱动Cas[STBX]9[STBZ]的表达,T0共获得4株基因编辑拟南芥株系。为简化突变检测过程,本研究选择在PAM上游存在BamHⅠ限制性内切酶位点的序列作为靶位点。利用 BamHⅠ 进行突变检测和测序的结果显示,4个株系中有3个为缺失突变,1个为插入突变,突变位点位于PAM上游3~7 bp处。由于本试验中只有不被BamHⅠ消化的PCR产物才会被收集鉴定,因此,存在虽然发生突变,但突变位点不在BamHⅠ内切酶位点的可能,这样的突变将不会被检测到。因此本试验所检测到的各突变类型的比例可能比真实的突变类型偏小,试验设计还有待进一步完善。
拟南芥bHLH家族Ⅳc亚家族成员bHLH34/104/105/115是铁稳态调节的主要因子,其中bLHLH105(ILR3)可与PYE[25]、BTS[25-27]、bHLH34[28]、bHLH104[10]、bHLH115[29]等蛋白协同作用,调控铁吸收、转运相关下游基因FIT、ZIF1、NAS4、FRO2/IRT1、bHLH38/39/100/101、MYB10/72[28]的表达;ILR3还和PYE共同参与植物缺铁胁迫下葡萄糖异硫氰酸盐(glucosinolate,简称GLS)积累的调控网络[11]。由此可知,ILR3基因在植物生长发育、抵御胁迫过程中发挥着重要作用。ILR3的T-DNA插入突变体ilr3-2已广泛应用在该基因功能的研究中。本研究发现,ILR3在生长发育过程中具有新的功能,所以利用CRISPR/Cas9技术对ILR3基因进行编辑。为确保突变后的基因完全失去功能,靶位点一般选择在编码区,尤其是靠近5′端或处于编码蛋白功能区之前的序列[30]。因此,本研究选择对ILR3基因第2个外显子进行编辑,共获得4个突变株系,且这些株系在缺铁情况下与 ilr[STBX]3-2[STBZ] 表现出相同的生长状态,与文献报道结果一致,进一步验证了ILR3在植物生长发育过程中及抗逆性方面所起的重要作用。
参考文献:
[1]Wu W,Yang Y,Lei H. Progress in the application of CRISPR:from gene to base editing[J]. Medicinal Research Reviews,2019,39(2):665-683.
[2]Strecker J,Jones S,Koopal B,et al. Engineering of CRISPR-Cas12b for human genome editing[J]. Nature Communications,2019,10(1):212.
[3]Li T,Zhu L,Xiao B,et al. CRISPR-Cpf1-mediated genome editing and gene regulation in human cells[J]. Biotechnology Advances,2019,37(1):21-27.
[4]Das A,Sharma N,Prasad M. CRISPR/Cas9:a novel weapon in the arsenal to combat plant diseases[J]. Frontiers in Plant Science,2018,9:2008.
[5]Chao T,Liu Z,Zhang Y,et al. Precise and rapid validation of candidate gene by allele specific knockout with CRISPR/Cas9 in wild mice[J]. Frontiers in Genetics,2019,10:124.
[6]Hidalgo-Cantabrana C,Goh Y J,Barrangou R. Characterization and repurposing of type Ⅰ and type Ⅱ CRISPR-Cas systems in bacteria[J]. Journal of Molecular Biology,2019,431(1):21-33.
[7]Li H J,Liu N Y,Shi D Q,et al. YAO is a nucleolar WD40-repeat protein critical for embryogenesis and gametogenesis in Arabidopsis[J]. BMC Plant Biology,2010,10(1):169.
[8]Yan L,Wei S,Wu Y,et al. High-efficiency genome editing in Arabidopsis using YAO promoter-driven CRISPR/Cas9 system[J]. Molecular Plant,2015,8(12):1820-1823.
[9]Rampey R A,Woodward A W,Hobbs B N,et al. An Arabidopsis basic helix-loop-helix leucine zipper protein modulates metal homeostasis and auxin conjugate responsiveness[J]. Genetics,2006,174(4):1841-1857.
[10]Zhang J,Liu B,Li M,et al. The bHLH transcription factor bHLH104 interacts with IAA-LEUCINE RESISTANT3 and modulates iron homeostasis in Arabidopsis[J]. Plant Cell,2015,27(3):787-805.
[11]Samira R,Li B,Kliebenstein D,et al. The bHLH transcription factor ILR3 modulates multiple stress responses in Arabidopsis[J]. Plant Molecular Biology,2018,97(4/5):297-309.
[12]Davis A M,Hall A,Millar A J,et al. Protocol:streamlined sub-protocols for floral-dip transformation and selection of transformants in Arabidopsis thaliana[J]. Plant Methods,2009,5:3.
[13]李 敏,楊 双,阮燕晔,等. 拟南芥T-DNA插入突变体atsuo[STBX]3[STBZ]的PCR鉴定[J]. 植物生理学通讯,2006,42(1):91-94.
[14]Berker K I,Ozyurt D,Demirata B,et al. Solid-phase extraction spectrophotometric determination of total antioxidant capacity in antioxidant-poor samples by using the ferric-ferrozine method[J]. Analytical Sciences,2017,33(6):683-689.
[15]Yu Z,Chen Q,Chen W,et al. Multigene editing via CRISPR/Cas9 guided by a single-sgRNA seed in Arabidopsis[J]. Journal of Integrative Plant Biology,2018,60(5):376-381.
[16]Toda E,Koiso N,Takebayashi A,et al. An efficient DNA- and selectable-marker-free genome-editing system using zygotes in rice[J]. Nature Plants,2019,5(4):363-368.
[17]Wang B,Zhu L,Zhao B,et al. Development of a haploid-inducer mediated genome editing system for accelerating maize breeding[J]. Molecular Plant,2019,12(4):597-602.
[18]Liang Z,Chen K,Li T,et al. Efficient DNA-free genome editing of bread wheat using CRISPR/Cas9 ribonucleoprotein complexes[J]. Nature Communications,2017,8:14261.
[19]Li C,Nguyen V,Liu J,et al. Mutagenesis of seed storage protein genes in soybean using CRISPR/Cas9[J]. BMC Research Notes,2019,12(1):176.
[20]Sun L,Williams J S,Li S,et al. S-locus F-box proteins are solely responsible for S-RNase-based self-incompatibility of Petunia pollen[J]. Plant Cell,2018,30(12):2959-2972.
[21]李莉梅,欧阳乐军,尹爱国,等. 1种大片段敲除巨桉细胞分裂素氧化酶基因的CRISPR载体构建[J]. 江苏农业科学,2018,46(12):19-22.
[22]Ye G N,Stone D,Pang S Z,et al. Arabidopsis ovule is the target for Agrobacterium in planta vacuum infiltration transformation[J]. Plant Journal,1999,19(3):249-257.
[23]Feng Z,Zhang B,Ding W,et al. Efficient genome editing in plants using a CRISPR/Cas system[J]. Cell Research,2013,23(10):1229-1232.[HJ1.9mm]
[24]Ma X,Zhang Q,Zhu Q,et al. A robust CRISPR/Cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants[J]. Molecular Plant,2015,8(8):1274-1284.
[25]Long T A,Tsukagoshi H,Busch W,et al. The bHLH transcription factor POPEYE regulates response to iron deficiency in Arabidopsis roots[J]. Plant Cell,2010,22(7):2219-2236.
[26]Selote D,Samira R,Matthiadis A,et al. Iron-binding E3 ligase mediates iron response in plants by targeting basic helix-loop-helix transcription factors[J]. Plant Physiology,2015,167(1):273-286.
[27]Hindt M N,Akmakjian G Z,Pivarski K L,et al. BRUTUS and its paralogs,BTS LIKE1 and BTS LIKE2,encode important negative regulators of the iron deficiency response in Arabidopsis thaliana[J]. Metallomics,2017,9(7):876-890.
[28]Li X,Zhang H,Ai Q,et al. Two bHLH transcription factors,bHLH34 and bHLH104,regulate iron homeostasis in Arabidopsis thaliana[J]. Plant Physiology,2016,170(4):2478-2493.
[29]Liang G,Zhang H,Li X,et al. bHLH transcription factor bHLH115 regulates iron homeostasis in Arabidopsis thaliana[J]. Journal of Experimental Botany,2017,68(7):1743-1755.
[30]孙勤富,刘东晓,林 俐,等. 甘蓝型油菜和甘蓝CRISPR/Cas9编辑效果的快速检测[J]. 中国油料作物学报,2018,40(6):737-744.
收稿日期:2019-08-01
基金项目:上海市青年科技英才扬帆计划(编号:19YF1414800)。
作者簡介:李 鹏(1983—),男,安徽濉溪人,硕士,工程师,主要从事植物抗逆性研究。E-mail:penglee98@163.com。

