旱胁迫下2个小麦RIL群体苗期性状主基因与多基因的遗传分析
马斯霜 白海波 惠建 吕雪莲 陈晓军 高颖银 李树华
摘要:以宁春4号为母本,分别与宁春27号和Drystal为父本构建的2个RIL群体为材料,苗期旱胁迫处理,用数量性状的主基因+多基因混合分析法对胚芽鞘长、株高、根长、根数、叶绿素含量、枯叶率等6个数量性状进行遗传模型分析。结果表明,株高、根数、叶绿素的最佳遗传模型为4MG-AI,4对主基因+加性多基因控制,表现为主基因-加性-上位性效应;根长的最佳模型为3MG-AI,受3对主基因+加性多基因控制,表现为主基因-加性-上位性;枯叶率的最佳遗传模型为2MG-Inhibiting,受2对抑制性主基因-加性多基因控制的;胚芽鞘长的最佳遗传模型为 2MG-Duplicate,受2对重叠性主基因-加性多基因控制。6个性状主基因遗传率在5.710 7%~58.985 5%之间,其中枯叶率、胚芽鞘长、根数遗传率比较低,说明环境对这2个性状影响比较大。
关键词:小麦;重组近交系群体;主基因+多基因遗传模型;遗传分析
中图分类号:S512.103.2 文献标志码: A
文章编号:1002-1302(2020)14-0087-07
随着世界人口数量的不断增加,生态环境的逐步恶化,小麦作为重要的粮食作物在缓解人口压力方面发挥了极为重要的作用。但由于小麦复杂的基因组结构和在育种工作中优势骨干材料的频繁使用,使得小麦的遗传背景日趋狭窄,新育成品种遗传距离较近。因此,对小麦品种进行改良,提高小麦的产量和抗逆性是当前亟需解决的问题[1-4]。小麦产量的相关性状大多是数量性状,而且极易受到外界环境的影响。调控植物数量性状的基因比较复杂,有遗传率相对比较大的主基因,在分离世代中也有分组的趋势,还有在组间界限模糊的遗传现象,因此采用主基因+多基因混合遗传分析法能够初步通过表型数据计算出控制该性状表现的主基因和多基因个数。为了提高检测效率,提出了通过永久性分离群体的数量性状进行分析,最后将表型基因定位与数量性状基因座(QTL)定位有机结合[5-9]。主基因+多基因混合遗传分析法已广泛用于水稻[10]、小麦[11]、大豆[12]、胡麻[9]等主要作物。目前,对小麦苗期性状在逆境下的遗传研究相对较少,这对小麦抗旱性育种至关重要。主基因+多基因混合遗传分析法是以表型数量性状为基础的一种遗传组成分析方法,其精确度不如QTL分子标记法,但能快速对植物表型性状的遗传规律做出初步的判断,根据遗传组成确定相应的选种策略,而且更加经济便捷。
目前,关于小麦主基因+多基因混合遗传分析的研究主要集中在小麦形态性状的分析(如株高、根长、穗下茎长[13]等),小麦生理指标的研究(如小麦雌雄育性[14-16]、碳同位素分辨率[17]、花药培养特性[18]等),产量性状的研究(如千粒质量[19]、小穗数、小花数和穗长[20]等),还有小麦的抗病性等表型都进行了主基因+多基因混合遗传分析。任丽娟等利用植物数量性状主基因+多基因混合遗传分离分析方法,对CI12633×扬麦158重组自交系群体的纹枯病抗性资料进行了抗性遗传分析[21]。张勇等运用主基因+多基因模型对N553的6家系抗赤霉病性遗传进行了分析,结果表明N553符合 E-1-0(2对主基因+多基因的加性-显性-上位性)模型[22]。张勇等运用主基因+多基因模型对 S42× 安农8455组合6家系群体对赤霉病抗性积分进行分析,结果表明在S42×安农8455组合中S42抗赤霉病性遗传符合E-1-1(2对主基因+多基因的加性-显性)模型[23]。但对小麦苗期表型性状在逆境下遗传组成的研究相对较少。目前也有很多通过QTL标记与主基因+多基因混合遗传分析法相结合的研究。王培等先通过主基因+多基因混合遗传模型分离分析法对中国春×兰考大粒的F2群体后代单株穗数进行研究,结果表明,单株穗数也跟大多数数量性状的遗传特点相似,由1对加性和部分显性主基因(A-1模型)共同控制,表型遗传组成分析结果与QTL检测分析的结果大致相同[24]。王金社等利用重组近交系(BIL)群体为研究材料构建了4个性状的遗传模型,并用QTL加以校验表型分析的准确性[25]。本研究采用主基因+多基因混合遗传分析法,以宁春4号为母本,宁春27号和Drystal分别为父本构建的2个RIL群体为研究材料,利用PEG-6000模拟旱胁迫,进行株高、根长、根数、叶绿素含量、枯叶率、胚芽鞘长等6个表型性状在逆境下的遗传分析,并分析2个群体的抗旱性,在后续育种工作中加以利用,为今后抗旱性育种奠定基础,创制材料。
1 材料与方法
1.1 试验材料
AB群体是以宁春4号为母本,宁春27号和Drystal分别为父本构建的2个RIL群体为研究材料,2个群体都采用一粒传法在银川和元谋两地连续自交7代,分别构建127、130个株系的RIL群体。本试验采用2个RIL群体和3个亲本材料进行遗传分析,亲本及各家系分小区播种在宁夏回族自治区固原市原州区,全生育期不灌水,雨养,每个材料种1个小区,种5行,行长 3 m,行距15 cm,小区面积2.7 m2,收获后测产;对2个群体材料苗期性状测定在室内进行。因本试验易受外界因素的干扰,特重复2年,试验时间为2017年3—7月,设3个重复,2018年3—7月做年度间重复,设3个重复。
1.2 试验方法
1.2.1 种子处理
将2個群体种植在固原头营基地,全生育期无灌溉,正常田间管理,及时除草和防治病虫害。取收获后2个群体(材料)的小麦种子各100粒,放入250 mL三角瓶中,先用自来水将种子上的灰尘冲洗干净,然后用70%乙醇浸泡5 min后,用去离子水冲洗掉种子上的残留乙醇,再用3% NaClO浸泡消毒30 min,去离子水冲洗3遍。
1.2.2 萌发期旱胁迫处理
将消毒过的各品种(材料)种子放入直径为9 cm铺有双层滤纸的培养皿中,每个培养皿100粒种子,均匀摆放,向培养皿中加入15 mL-0.50 MPa PEG-6000胁迫液进行胁迫处理,盖好皿盖,以不含PEG-6000的去离子水作为对照,各3次重复。将摆好种子的培养皿放入25 ℃人工气候箱中黑暗催芽,每天涮洗并更换相应的溶液以保持胁迫液浓度恒定。
1.2.3 苗期抗旱性鉴定
幼苗培养采用水培发芽纸法(图1)。取各品种(材料)100粒,按“121”节方法消毒种子后,于25 ℃人工气候箱中黑暗催芽,将种子胚向下、间隔1.8 cm均匀地摆在 20 cm×25 cm 的发芽纸上,每张发芽纸摆20粒种子,处理和对照各设3次重复,每个材料共摆5张纸,将纸小心地卷成筒状,用皮筋固定后标号。
1.2.3.1 干旱胁迫处理
将卷好的纸筒按材料分成2份,分别置于直径为15 cm,高为20 cm的PVC管中,在管中加入1 L-0.50 MPa PEG-6000的胁迫溶液进行干旱胁迫处理,另一管中加入1 L蒸馏水,于培养箱光照为1 000 lx、温度为20 ℃条件下进行培养。每天更换胁迫液和蒸馏水。
1.2.3.2 根系及苗高测定
培养10 d后,将纸筒展开,选取有代表性的幼苗10株,分别测量每个单株的株高(即从茎基部到最长叶片顶端的高度)、主根长(即从茎基部到主根根尖的长度)和根数、叶绿素含量。
1.3 数据分析
通过盖钧镒等提出的植物数量性状主基因+多基因混合遗传分析法[14-15],对3个小麦亲本材料和2个RIL群体的6个苗期性状在旱胁迫下的遗传组成进行分析。首先,利用SAS软件对数据进行变异性分析;其次利用SEA-G3DH分析软件计算各性状遗传模型的极大似然函数值(Max-likelihood-values,MLV)和阿开克信息判据(Akaikes in-formation criterion,AIC)值。通过AIC值最小值筛选法进行筛选,先确定AIC值最小的3个遗传模型为备选模型,再对这3个备选模型作适合性检验,检验结果中有5个统计量,分别是U1、U2、U3(均匀性检验)和 nW2(Smirnov检验)、Dn(Kolmogorov检验),最后在这3个备选模型中选取AIC值较小且均匀性检验达到显著水平个数最少的模型作为最优的遗传模型,确定最优遗传模型后通过最小二乘法计算出该模型的一阶、二阶遗传参数,并对主基因的表现特征加以分析,计算主基因和多基因的方差和遗传率[22]。主基因遗传率h2mg=δ2mg/δ2p×100%;多基因遗传率h2pg=δ2pg/δ2p×100%。其中,δ2p为表型方差;δ2mg为主基因方差;δ2pg为多基因方差。
2 结果与分析
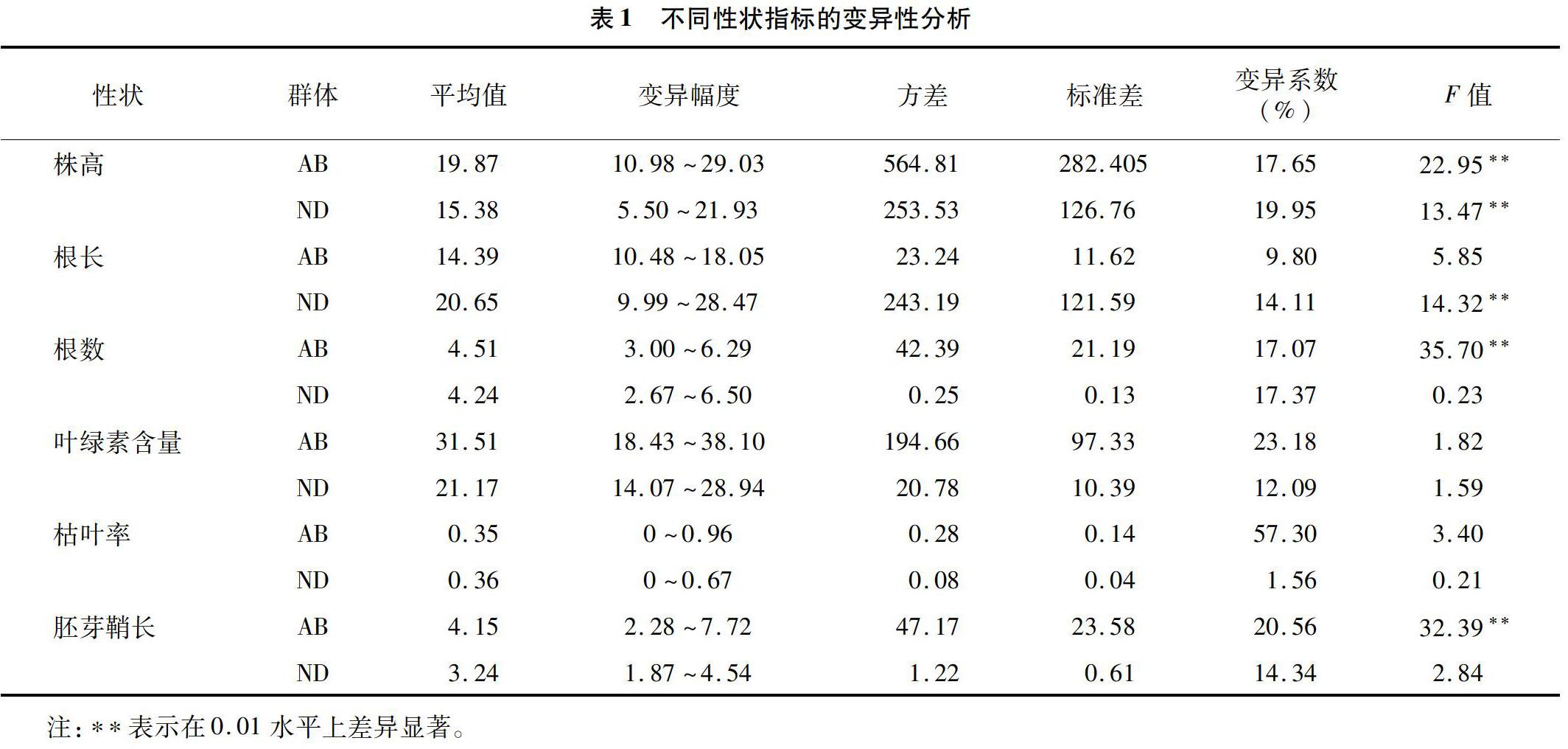
2.1 2个群体各性状的变异性分析
对2个RIL群体的株高、根长、根数、叶绿素含量、枯叶率、胚芽鞘长等6个性状的差异性分析结果(表1)表明,AB群体135份材料和ND群体130份材料间的株高均说明各群体内的各材料间的遗传差异较大,并且AB群体和ND群体的株高和根长变异幅度、方差和标准差较高,说明株高和根长的离散程度较大,差异较大。ND群体的根长达到极显著水平。AB群体的根数、胚芽鞘长也都达到极显著水平,说明AB群体具有较强的耐旱性。AB群体的叶绿素含量、枯叶率、胚芽鞘长的变异系数达到20%以上,其中枯叶率的变异系数最大,为5730%,ND群体枯叶率的变异系数最低,为156%,经PEG旱胁迫处理后,2个群体相比较,结果表明AB群体的耐旱性相对较强。
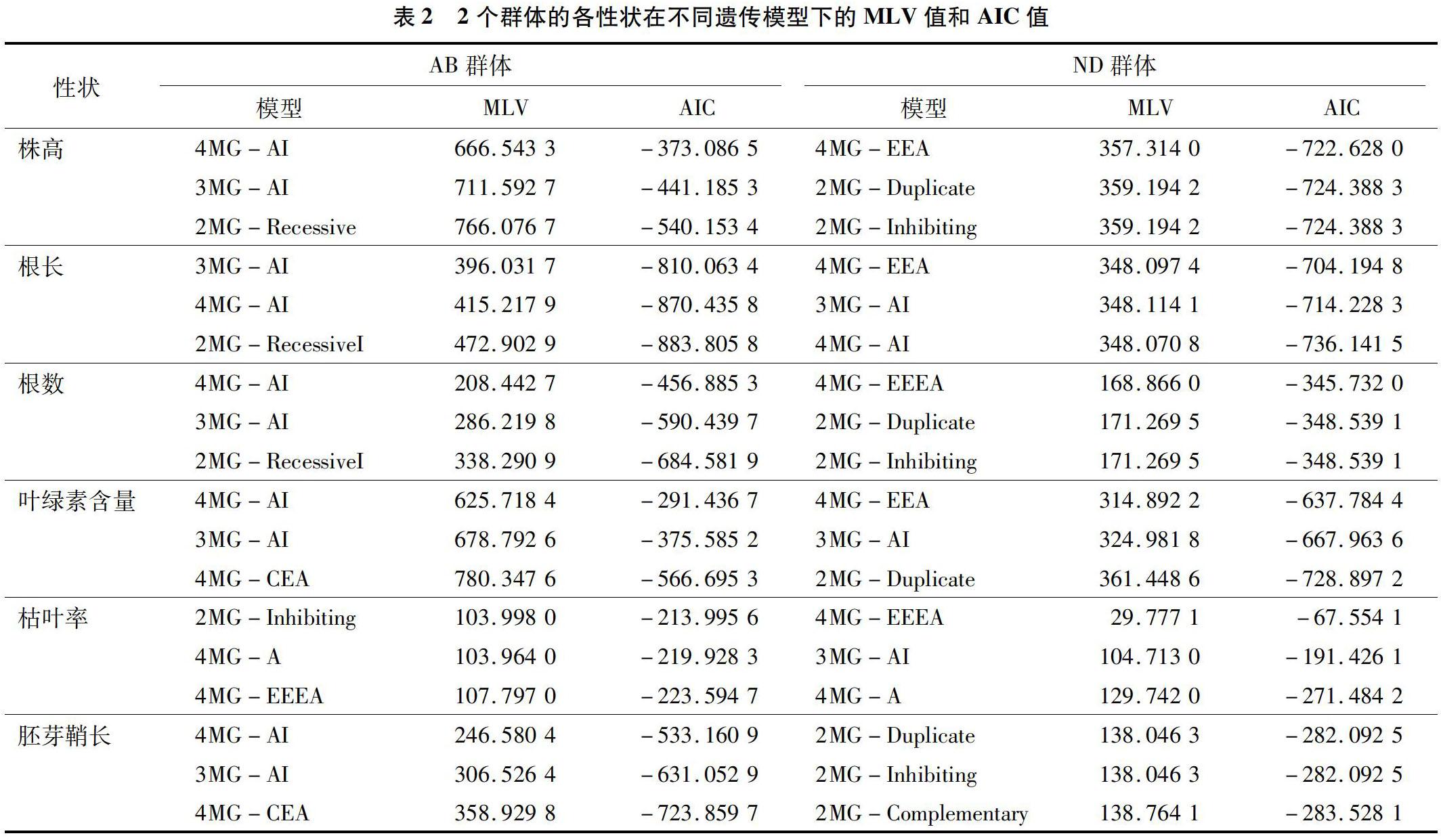
2.2 2个群体各表型性状的最优遗传模型选择及适合性检验
根据植物数量性状主基因+多基因混合遗传分析,对3个亲本材料和2个RIL群体的6个表型性状进行最佳遗传模型分析,通过使用SEA-G3DH分析软件,计算出各性状的不同模型MLV值和AIC值(表2)。通过AIC值最小为最佳遗传模型的原则,先筛选出AIC值最小的遗传模型, 再选择与该AIC
值接近的2个遗传模型作为备选模型。由表2可知,AB群体株高最小的AIC值所对应的模型为4MG-AI,与其比较接近的2个模型分别为3MG-AI和2MG-Recessive;ND群体株高最小的AIC值所对应的模型为4MG-EEA,2个备选模型为 2MG-Duplicate和2MG-Inhibiting。对2个群体的2个模型进行适应性检验(表3),包括均匀性检验(U1、U2、U3),Smirnov检验(nW2)和Kolmogorov检验(Dn),AB群体中4MG-AI遗传模型差异性检验中达到显著水平的个数最少,其他2個模型的显著水平个数相同,因此4MG-AI模型为株高的最佳模型,说明群体株高的遗传是受4对主基因控制,表现为主基因-加性-上位性效应。依次计算比较,根长的最佳模型为3MG-AI,说明群体根长的遗传是受3对主基因控制,表现为主基因-加性-上位性;根数的最佳遗传模型为4MG-AI,说明群体根数的遗传是受4对主基因控制,表现为主基因-加性-上位性效应;叶绿素含量的最佳遗传模型为4MG-AI,说明群体叶绿素含量的遗传是受4对主基因控制,表现为主基因-加性-上位性效应;枯叶率的最佳遗传模型为2MG-Inhibiting,说明群体枯叶率的遗传是受2对抑制性主基因-加性多基因控制;胚芽鞘长的最佳遗传模型为2MG-Duplicate,说明群体胚芽鞘长的遗传是受2对重叠性主基因-加性多基因控制。
2.3 遗传参数估计
通过采用最小二乘法估算6个性状最佳遗传模型的遗传参数(表4)。株高、根数、叶绿素含量3个性状受4对主基因+多基因控制,根长受3对主基因+多基因控制,而枯叶率和胚芽鞘长受2对主基因+多基因控制。在株高的遗传模型中,主基因的遗传率为51.034 4%,存在48.965 6%的环境影响,要以第1主基因的加性效应为主,可在早期选择株高较高的材料作母本;根长的主基因遗传率为55330 4%,主基因及其互作主要以正向加性效应为主,且第1主基因的加性效应值较大,可用根长较长的材料作为母本;根数的主基因遗传率为 5.710 7%,存在94.289 3%的环境影响,多基因的遗传率为99.720 0%,其遗传效应主要受环境影响,宜在高代选择;叶绿素含量主基因的遗传率为58985 5%,主要以基因的正向加性效应为主,可选择叶绿素含量较高的品种作为母本,在旱胁迫下仍能保持较强的光合能力;枯叶率主基因的遗传率为8.880 0%,多基因遗传率为0.660 0%,主要受环境的影响,2对主基因的加性效应值为负向,可在高代选择;胚芽鞘长的主基因遗传率为9.080 0%,多基因遗传率为19.400 0%,2对主基因的加性效应值为正向,受环境影响大,可选择胚芽鞘长的品种作母本,提高抗旱性。
2.4 2个群体各性状间及与产量的相关性分析
由表5和表6可以看出,ND群体中只有根长、根数和枯叶率与产量呈正相关关系,但未达到显著水平;AB群体中叶绿素含量与产量呈显著正相关关系,株高与产量呈极显著负相关关系;AB群体和ND群体中根数和根长都与产量呈正相关关系,但相关性不显著。AB群体和ND群体的株高和胚芽鞘长间为极显著正相关关系,AB群体根数与胚芽鞘长为显著正相关关系,而ND群体为极显著正相关关系。ND群体株高与根数和根长呈极显著正相关关系,而AB群体株高与根长呈显著正相关关系,与根数呈极显著正相关关系,说明根系对株高有较大的影响。
3 讨论与结论
本研究主要以宁春4号为母本分别与宁春27号和Drystal为父本构建的2个RIL群体为材料,研究胚芽鞘长、株高、根长、根数等性状在旱胁迫下的遗传分析,这些性状也大都为多基因控制的数量性状,这对今后改良作物株型及通过表型改良增加产量,或分子抗旱性育种技术提高作物产量非常重要。本研究结果表明,各性状都是受2对或2对以上的主基因控制的,株高、根数、叶绿素含量3个性状受4对主基因+多基因控制,根长受3对主基 因+ 多基因控制,而枯叶率和胚芽鞘长受2对主基因+多基因控制。从主基因的遗传率来分析,6个主基因遗传率在5.710 7%~58.985 5%之间,其中枯叶率、胚芽鞘长、根数遗传率比较低,说明环境对这2个性状影响比较大。AB群体和ND群体中根数和根长都与产量呈正相关关系,但不显著。根系越发达,抗旱性越强,根系吸收养分的能力越强,对籽粒干物质的积累具有重要意义,在今后抗旱性育种中可利用。从2个群体各性状的变异性分析可知,经PEG旱胁迫处理后,AB群体的抗旱性较强。
目前对小麦株高遗传性分析的研究比较多,对胚芽鞘长、叶绿素含量等性状的研究較少,对逆境下小麦表型性状的遗传分析也相对较少。杜希朋等对蚂蚱麦×碧玉麦杂交F2代的185个单株的株高、穗长等性状进行遗传分析,结果表明,株高是多基因控制的数量性状,受微效多基因控制,无主效基因存在,而本研究株高受4对主基因控制[26],本研究结果与之不一致。闫艳等以青麦6号和烟农24杂交形成的F2 ∶3群体为材料,在水、旱2种条件下,根长和根鲜质量均为1对加性-显性效应主基因模型,根长主基因遗传率为81%[27]。本研究根长受3对主基因+多基因控制,遗传率为 55.330 4%,本研究结果与之存在差异。蒋靓等在水培与盐胁迫处理下共检测到2个控制水稻苗期株高的主效QTL,根长在水培与盐胁迫处理下共检测到4个控制水稻根长的主效应QTL[28]。毕晓静等采用P1、P2、F1、F2、F3 5个世代联合分析方法,研究了株高等产量相关性状的遗传模型,表明产量不仅受基因的控制,同时也受到不同程度的环境影响且无主基因存在[29],本研究结果与之不一致。李法计等以构建的重组自交系群体(RIL)F7代为材料,通过数量性状主基因+多基因混合遗传模型研究了株高等农艺性状的遗传特点发现,株高受2对主基因+多基因遗传控制[14]。张坤普等研究了小麦DH群体株高等性状发现,株高受5个主基因控制,遗传率为57%[30-32]。王盈等以创制的F10代重组自交系为材料,共鉴定到3个在多个环境下稳定存在的株高相关的新QTLs[33]。李涛等利用2个重组近交系发现2个株高相关的QTLs[34]。还有研究通过表型性状与QTL标记结合共同检测表明,小麦株高的主基因数目明显少于已经定位到株高的QTL数目[35-36]。
根据以上的研究结果发现,不同的遗传性分析方法和材料所得到的结论并不相同。首先不同群体其代表性以及试验的偏差和误差也各不相同;其次,遗传分析只是通过对表型数据的分析来判断和预测性状的遗传模型以及主基因和多基因遗传率,更精确的主基因数目和遗传率仍需通过分子生物学试验来获得。此次研究通过RIL分离群体研究分析,也存在一定的局限性,也可与其他群体相结合进行研究,以获得更精确的结论。
参考文献:
[1]Li Y C,Peng J H,Liu Z Q. Heterosis and combining ability for plant height and its components in hybrid wheat with Triticum timopheevi cytoplasm[J]. Euphytica,1997,95(3):337-345.
[2]Li W,Gill B S. Genomics for cereal improvement[M]. Cereal Genomics,2004:585-684.
[3]汤继华,马西青,滕文涛,等. 利用“永久F2”群体定位玉米株高的QTL与杂种优势位点[J]. 科学通报,2006,51(24):2864-2869.
[4]李树华,张文杰,白海波,等. 春小麦穗部性状的主基因+多基因遗传分析[J]. 中国农学通报,2017,33(6):20-26.
[5]盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传,2005,27(1):130-136.
[6]Biao L U,Xue Q U,Zhang T,et al. Genetic analysis on characteristics to measure drought resistance using dongxiang wild rice(Oryza rufupogon Griff.)and its derived backcross inbred lines population at seedling stage[J]. Agricultural Sciences in China,2011,10(11):1653-1664.
[7]章元明. 植物数量遗传学的建立、发展与展望[J]. 南京农业大学学报,2012,35(5):19-24.
[8]章元明,盖钧镒,王永军. 利用P1、P2和DH或RIL群体联合分离分析的拓展[J]. 遗传,2001,23(5):467-470.
[9]侯北伟,窦秉德,章元明,等. 小麦雌性育性的主基因+多基因混合遗传分析[J]. 遗传,2006,28(12):1567-1572.
[10]王小明. 水稻长穗大粒性状的主基因+多基因遗传分析[D]. 福州:福建农林大学,2010.
[11]范绍强,武银玉,王全亮,等. 抗矮缩病小麦产量及其关键性状遗传模型分析[J]. 山西农业科学,2018,46(1):14-17,24.
[12]蔡立楠. 大豆主要农艺性状和品质性状的主基因+多基因混合遗传分析[D]. 长春:吉林农业大学,2012.
[13]王 斌,王利民,张建平,等. 胡麻RIL群体苗期抗旱性状的主基因+多基因遗传分析[J]. 干旱地区农业研究,2018,36(5):14-20.
[14]李法计,常 鑫,王宇娟,等. 小麦重组自交系群体9个重要农艺性状的遗传分析[J]. 麦类作物学报,2013,33(1):23-28.
[15]魏艳丽,王彬龙,李瑞国,等. 大穗小麦穗部性状的遗传分析[J]. 麦类作物学报,2015,35(10):1366-1371.
[16]郑建敏,蒲宗君,李式昭,等. 温敏雄性不育小麦SCT-1育性主基因+多基因遗传模型分析[J]. 华北农学报,2014,29(6):68-72.
[17]李树华,白海波,吕学莲,等. 春小麦碳同位素分辨率等性状的遗传分析[J]. 麦类作物学报,2014,34(2):181-186.
[18]王 羽,樊庆琦,张 利,等. 小麦花药培养特性的数量遗传分析[J]. 麦类作物学报,2007,27(5):755-760.
[19]杨兴圣,梁子英,李 华,等. 普通小麦籽粒性状的主基因+多基因遗传模型分析[J]. 麦类作物学报,2013,33(6):1119-1127.
[20]程 洁,周荣全,吴玉川,等. 不同水分条件下小麦穗部性状的遗传分析[J]. 华北农学报,2015,30(增刊1):146-151.
[21]任丽娟,颜 伟,陈怀谷,等. 小麦纹枯病抗性的主基因+多基因遗传分析[J]. 江苏农业学报,2010,26(6):1156-1161.
[22]张 勇,张伯桥,高德荣,等. 小麦赤霉病抗源N553的主基 因+ 多基因遗传分析[J]. 中国农学通报,2005,21(6):305-307,336.
[23]张 勇,张伯桥,高德荣,等. 小麦抗病新材料S42抗赤霉病性的主基因+多基因遗传分析[J]. 江苏农业学报,2005,21(4):272-276.
[24]王 培,李晓林,杨 林,等. 小麦单株穗数的遗传分析及基于QTL定位的最优基因型预测[J]. 麦类作物学报,2012,32(5):820-827.
[25]王金社,李海旺,赵团结,等. 重组自交家系群体4对主基因加多基因混合遗传模型分离分析方法的建立[J]. 作物学报,2010,36(2):191-201.
[26]杜希朋,闫媛媛,刘伟华,等. 蚂蚱麦×碧玉麦杂交F2代部分重要农艺性状的遗传分析[J]. 麦类作物学报,2011,31(4):624-629.
[27]闫 艳,王春华,穆 平. 水、旱条件下小麦苗期部分农艺性状的遗传分析[J]. 中国农学通报,2017,33(3):8-14.[HJ1.9mm]
[28]蒋 靓,於卫东,庄杰云,等. 水稻盐胁迫下农艺和生理性状的遗传分析(简报)[J]. 分子细胞生物学报,2008,41(4):317-322.
[29]毕晓静,史秀秀,马守才,等. 小麦农艺性状的主基因+多基因遗传分析[J]. 麦类作物学报,2013,33(4):630-634.
[30]张坤普,徐宪斌,田纪春. 小麦籽粒产量及穗部相关性状的QTL定位[J]. 作物学报,2009,35(2):270-278.
[31]Reinbergs T E. Estimation of the number of genes in double haploid populations of barley(Hordeum vulgare)[J]. Canadian Journal of Genetics and Cytology,1982,24(3):337-341.
[32]Brner A,Schumann E,Fürste A,et al. Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat (Triticum aestivum L.)[J]. Theoretical and Applied Genetics,2002,105(6/7):921-936.
[33]王 盈,赵 磊,董中东,等. 小麦株高和旗叶相关性状的QTL定位[J]. 麦类作物学报,2019,39(7):761-767.
[34]李 涛,陆 炳,李 俊,等. 2个小麦株高QTL位点验证及其对产量相关性状的效应分析[J]. 西南农业学报,2019,32(3):476-483.
[35]刘冬成. 小麦重要农艺性状的QTL定位[D]. 北京:中国农业大学,2002.
[36]刘冬成,高睦枪,关荣霞,等. 小麦株高性状的QTL分析[J]. 遗传学报,2002,29(8):706-711.
收稿日期:2019-08-01
基金项目:国家自然科学基金(编号:31660394);宁夏回族自治区农业育种专项(编号:NXNYYZ20180202)。
作者简介:马斯霜(1992—),女,宁夏同心人,硕士,研究实习员,主要从事小麦、水稻生物技術育种方面的研究。Tel:(0951)6886758;E-mail:masishuang@163.com。
通信作者:李树华,研究员,主要从事小麦、水稻生物技术育种方面的研究。Tel:(0951)6886758;E-mail:shuhua.l@163.com。

