中国美利奴羊(新疆军垦型)同期发情处理前后外周血生殖激素的变化
王晶晶 杨华 倪建宏 卢守亮 支建忠 石国庆 刘长彬 万鹏程

摘要:研究同期发情处理中国美利奴羊(新疆军垦型)的外周血生殖激素含量变化与发情时间的关系,探讨中国美利奴羊(新疆军垦型)最佳人工输精时间。分别采集经孕酮海绵栓+PMSG肌注法处理母羊在埋栓前1 d、埋栓后 7 d、埋栓后13 d(撤栓0 h)和撤栓/PMSG肌注48 h的外周血,应用ELISA方法检测外周血中雌二醇(E2)、促卵泡素(FSH)、促黄体素(LH)、孕酮(P)的质量浓度,分析试验母羊在同期发情处理前后外周血中生殖激素含量变化,统计分析生殖激素质量浓度的相关性和4个时间点的差异显著性。研究结果,对孕酮海绵栓+PMSG肌注法处理前后试验母羊外周血生殖激素的ELISA检测,与埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓0 h)相比,撤栓/PMSG肌注48 h试验羊外周血中E2、FSH、LH含量显著升高(P<0.05),P含量显著下降(P<0.05),且不同个体间不同激素含量的波动范围明显减小,达到相对一致水平,与该时间点的中国美利奴羊(新疆军垦型)集中发情现象相吻合。结果表明,孕酮阴道海绵栓+PMSG处理后的48 h是中国美利奴羊(新疆军垦型)集中发情的高峰时间,也是最佳输精时间。
关键词:中国美利奴羊(新疆军垦型);同期发情;生殖激素;ELISA;E2;FSH;LH;P
中图分类号:S826.3 文獻标志码: A
文章编号:1002-1302(2020)14-0187-05
绵羊同期发情是人为控制母羊群体同一时间发情和配种,具有便于统一饲草料配给、提高劳动生产效率和提高绵羊生殖效率的优点。生殖激素直接调控母羊发情、排卵等生殖过程,影响同期发情和人工授精的效果。绵羊属于季节性发情动物,一般是在短日照的秋季开始发情[1],其季节性发情受到下丘脑-垂体-性腺轴的调控[2],与绵羊的生殖激素有密切联系。目前,国内外对绵羊生殖激素季节性变化进行了相关报道。Suttie等研究发现,短日照可以促进绵羊孕酮(P)分泌,而长日照则明显地抑制P的分泌[3];Smith等发现,哺乳动物一般在发情前会出现一次雌二醇(E2)峰[4];Chemineau等研究发现,繁殖季节绵山羊血液中促黄体素(LH)和促卵泡素(FSH)浓度高于非繁殖季节,存在季节性变化[5];贺建宁等研究发现,季节性发情的滩羊的P、E2、LH、FSH浓度在春季、夏季、秋季、冬季4个季节变化明显[6]。中国美利奴羊(新疆军垦型)是我国培育的优质细毛羊品种,是典型的季节性发情哺乳动物,且每年产羔1次,每胎多为1羔。为探讨绵羊外周血生殖激素含量变化与发情时间的关系,筛选最佳人工输精时间。本研究分析繁殖季节中国美利奴羊(新疆军垦型)同期发情处理的不同阶段外周血中E2、FSH、LH和P含量的变化情况,以期为提高同期发情和人工授精成功率提供理论依据。
1 材料与方法
1.1 样品采集
2018年9—11月,试验动物均采自新疆紫泥泉种羊场,中国美利奴羊(新疆军垦型)母羊共计480只,平均年龄3岁,平均体质量(38.4±1.4) kg,体格健壮,膘情较好,无生殖道疾病和乳房疾病。生殖、营养、健康等方面状况良好且个体之间无明显差异。试验处理前2周对绵羊做好防疫和驱虫工作,并加强饲养管理。从中选取20只健康的全舍饲中国美利奴羊(新疆军垦型)母羊,应用孕酮海绵 栓+330 IU PMSG(孕马血清促性腺激素)进行同期发情处理,埋栓处理 13 d 后撤栓,撤栓时肌注PMSG 330 IU。自撤栓后24~72 h,每隔12 h进行1次公羊试情,记录母羊发情时间和发情数量,计算撤栓后72 h内母羊的发情率。血样采集:在埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓0 h,PMSG肌注前)、撤栓/PMSG肌注48 h,分别颈静脉采血 5 mL/只,1 000 g×10 min离心分离血清。
1.2 试验药品与主要仪器
1.2.1 主要试剂
孕酮阴道海绵栓,含35 mg氟孕酮,宁波市三生药业有限公司生产;PMSG,1 000 IU/瓶,宁波市三生药业有限公司生产;绵羊ELISA检测试剂盒FSH(RY-12131)、LH(RY-12111)、P(RY-12074)和E2(RY-12134)均购于上海润裕生物科技有限公司。
1.2.2 主要仪器
酶标仪(Thermo Fisher Scientific,Muhiskanmk3 Inc)美国生产。
1.3 生殖激素的测定
采用ELISA法测定血清中E2、FSH、LH和P的含量。按试剂盒的操作步骤测定D450 nm值,并以D450 nm值为横坐标,含量为纵坐标绘制标准曲线,计算得到回归方程。FSH的回归方程为y=67.352x2+14.563x+2.060,r2=0.994 3;LH的回归方程为y=103.440 0x2+4.297 8x+1.358 9,r2=0991 8;E2的回归方程为y=112.900 0x2+25.900 0x+2191 1,r2=0.988 1;P的回归方程为y=1 773.200x2+3 667.900x-30.839,r2=0.998 7。根据回归方程计算出E2、FSH、LH和P的含量。
1.4 统计分析
E2、FSH、LH和P的含量以(平均数±标准差)表示,使用SPSS 21.0对不同阶段外周血中E2、FSH、LH和P的含量进行方差分析和相关分析,处理0~72 h母羊的发情率进行卡方检验,并进行显著性分析。
2 结果与分析
2.1 孕酮海绵栓+PMSG同期发情处理前后的中国美利奴羊(新疆军垦型)生殖激素含量比较
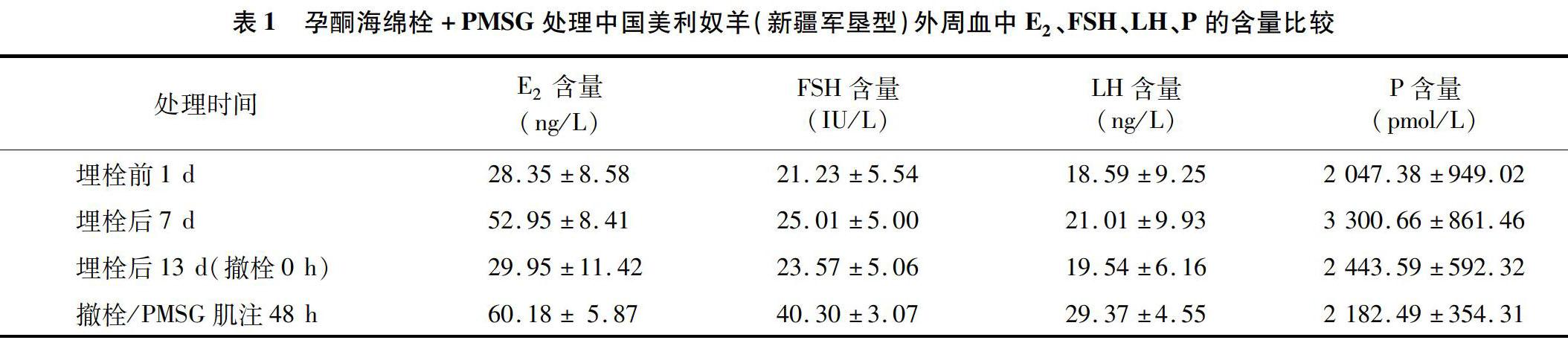
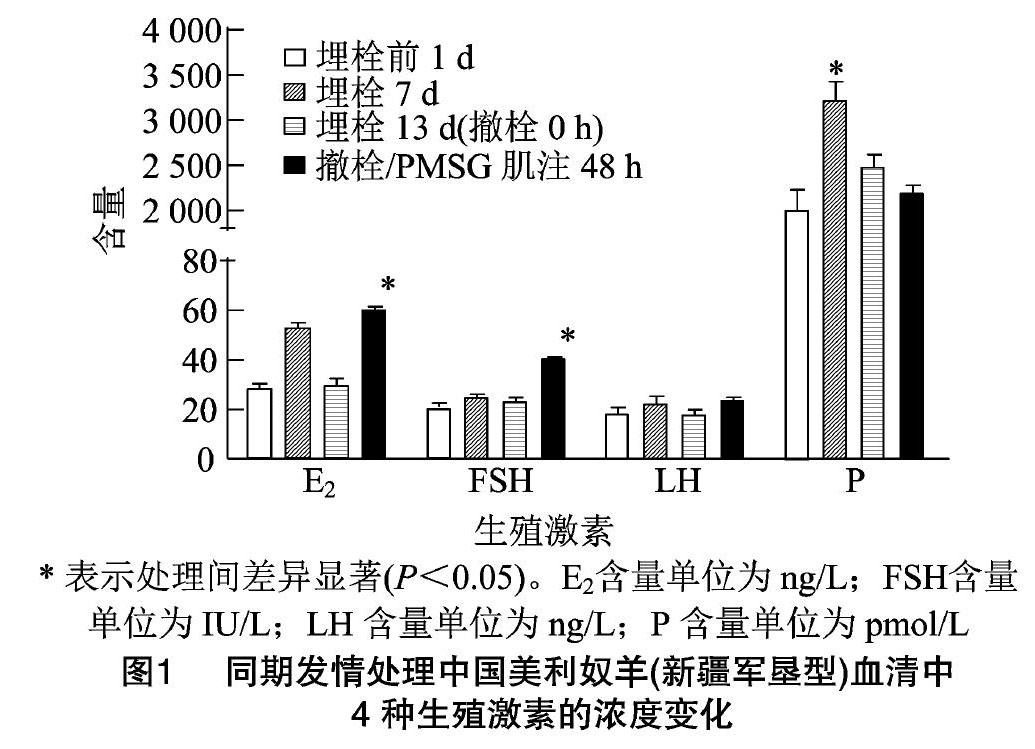
2.1.1 E2含量 试验羊外周血E2分泌水平在埋栓前1 d最低,为(28.35±8.58) ng/L,埋栓后7 d有较大幅度升高,为(52.95±8.41) ng/L,埋栓后13 d(撤栓0 h)出现回落,含量为(29.95±11.42) ng/L,撤栓/PMSG肌注48 h后升至最高点,为(60.18±5.87) ng/L(表1)。其中撤栓/PMSG肌注48 h后E2分泌水平与埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓0 h)相比差异显著(P<0.05)(图1)。
2.1.2 FSH含量 试验羊外周血FSH分泌水平在埋栓前1 d最低,为(21.23±5.54) IU/L,埋栓后 7 d 有所升高,为(25.01±5.00) IU/L,埋栓后13 d(撤栓0 h)出现回落,为(23.57±5.06) IU/L,撤栓/PMSG肌注48 h后升至最高点,为(40.30±307) IU/L(表1)。其中撤栓/PMSG肌注48 h后FSH分泌水平与埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓0 h)相比差异显著(P<0.05)(图1)。
2.1.3 LH含量 试验羊外周血LH分泌水平在埋栓前1 d最低,为(18.59±9.25) ng/L,埋栓后7 d有所升高,为(21.01±9.93) ng/L,埋栓后13 d(撤栓0 h)出现回落,为(19.54±6.16) ng/L,撤栓/PMSG肌注48 h后LH分泌水平升至最高点,为(29.37±4.55) ng/L(表1),但与埋栓前1 d、埋栓后7 d和埋栓后13 d(撤栓0 h)相比差异均不显著(P>0.05)(图1)。
2.1.4 P含量 试验羊外周血P分泌水平在埋栓前1 d最低,为(2 047.38±949.02) pmol/L,埋栓后7 d达到最高,为(3 300.66±861.46) pmol/L,埋栓后13 d(撤栓0 h)分泌水平下降,为(2 443.59±592.32) pmol/L,撤栓/PMSG肌注48 h后继续降低至(2 182.49±354.31) pmol/L(表1)。其中埋栓后7 d试验羊P分泌水平与埋栓前1 d、埋栓后 13 d、撤栓/PMSG肌注48 h相比均差异显著(P<0.05)(图1)。
从图2可以看出,在埋栓前1 d、埋栓后7 d和埋栓后13 d(撤栓0 h)激素分泌水平个体差异较大,撤栓/PMSG肌注48 h后则达到相对均一水平,均值标准差均以埋栓前1 d为最大,撤栓/PMSG肌注48 h最小,说明在经过孕酮海绵栓+PMSG处理后,试验羊的生殖激素分泌基本达到同步状态。
2.2 同期发情处理的绵羊LH含量与FSH、E2、P含量之间的相关性分析
经统计分析,孕酮海绵栓+PMSG同期发情处理后,中国美利奴羊(新疆军垦型)中外周血中E2、FSH、LH、P含量均呈极显著正相关关系(P<0.01)(表2),其中LH含量与FSH、E2、P含量之间呈中度正相关关系,FSH含量与E2、P含量呈中度正相关关系,E2含量与P含量之间呈低度正相关。
2.3 同期发情处理母羊的发情率
记录孕酮海绵栓处理的母羊在撤栓后72 h发情率,应用卡方检验进行差异显著性分析。中国美利奴羊(新疆军垦型)同期发情处理的总发情率是87.5%,撤栓后>24~48 h同期化程度最高,发情率为70.0%,显著高于0~24 h的7.5%和>48~72 h的10.0%(表3)。
3 讨论与结论
同期发情技术在绵羊繁殖过程中被广泛应用,但影响同期发情的因素很多,导致绵羊发情率存在较大的差别。海绵栓是目前绵羊同期发情中最常用的埋植栓剂,孕酮海绵栓+PMSG肌注法的同期发情处理效果要优于孕酮海绵栓+PG法,孕酮海绵栓与PMSG聯合使用的效果优于单一使用孕酮海绵栓[7]。
Scaramuzzi等检测结果表明,发情期绵羊的卵巢静脉和外周静脉血血浆E2和LH浓度在排卵时显著升高[8]。张寿等发现,青海半细毛羊的E2浓度水平在发情当日最高,而P浓度水平在发情的前1 d、发情的当天和发情后2 d均较低,发情当天的含量最低,发情后10 d浓度上升[9]。赵松华等研究发现,非繁殖季节中国美利奴羊血清中E2含量显著上升[10]。本研究中对孕酮海绵栓+PMSG肌注法处理前后试验母羊外周血生殖激素的ELISA检测,与埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓0 h)相比,撤栓/PMSG肌注48 h试验羊外周血中E2含量显著升高(P<0.05),且激素含量的波动范围明显减小,达到相对一致水平,与该时间点的集中发情现象相吻合,表明撤栓48 h前后是中国美利奴羊(新疆军垦型)发情、排卵高峰,本试验结果与孙五洋的结论[11]一致。
Karsch等研究表明,LH峰值出现前48~60 h,黄体开始急剧退化,导致血中P4浓度急剧下降,此时外周血中E2和LH浓度开始缓慢升高,促使垂体释放大量LH而引起排卵[12]。Martineza lvarez等应用不同处理方法诱导母羊发情时,LH峰出现和排卵时间无关[13]。张英杰等研究发现,全年的高繁殖力小尾寒羊血浆FSH和LH浓度均极显著高于低繁殖力和季节性发情的细毛羊[14];LH浓度水平通常在发情期呈现最高峰,FSH有相同的高峰趋势,但不如LH明显[15]。本研究中对孕酮海绵栓+PMSG肌注法处理前后试验母羊外周血生殖激素的ELISA检测,与埋栓前1 d、埋栓后7 d、埋栓后13 d(撤栓 0 h)相比,撤栓/PMSG肌注48 h试验羊外周血中FSH和LH含量显著升高(P<0.05),且激素含量的波动范围明显减小,达到相对一致水平,与该时间点的集中发情现象相吻合,说明撤栓48 h前后是中国美利奴羊(新疆军垦型)发情、排卵高峰。张振汉等测得双羔组发情日血清E2含量是单羔组的15倍,双羔组母羊在发情日血清LH含量出现峰值后迅速下降,到发情后10 d恢复到发情前1 d的水平,单羔组母羊血清LH峰值出现在发情后1 d[16]。不同动物垂体中FSH/LH的比率及其含量也相同,这与动物的发情时间、排卵时间及发情表现有关[17]。
P的主要作用是“启动”母羊的发情,促使卵巢从相对静止状态转变为活跃状态,从而使母羊正常发情和排卵[18]。Carlson等报道,由于与黄体分泌P相叠加,在母羊血浆中P浓度高于植栓后3 d[19]。Theodosiadou等研究结果表明,高剂量P进行诱导发情处理时,会扰乱羊本身体内激素浓度,导致了较低的妊娠率[20]。Karagiannidis等报道,MPA阴道栓植入阴道后1 d,奶中的P浓度水平上升,然后降到一个稳定的水平直到在撤栓后24 h,P水平降到基础水平[21]。Campbell等报道,植栓的0~1 d P4浓度水平上升,2~3 d P水平下降,9~10 d至撤栓,P维持基础浓度水平[22]。Lazar等报道,血清中P浓度在撤栓后3 h下降[23]。张海容等证明,在乏情期外周血中P浓度保持较低的水平,在15 d有1个波动周期,在发情后24 h E2浓度上升,P浓度下降[24]。侯衍猛等证明,在发情期和间情期血浆内的FSH和LH浓度均呈脉冲式分泌,E2和P为波动式分泌,P在间情期一直维持较高浓度水平[25]。谢炳坤等研究发现,哺乳动物在发情前后有1个较低的P浓度水平,其变化有利于母畜进入下一个发情周期[26]。王金富等对中国美利奴军垦型细毛羊发情周期血清中P浓度进行了检测,结果表明,发情后 1 d P含量显著高于0 d[27]。
本研究对孕酮海绵栓+PMSG肌注法处理前后试验母羊外周血生殖激素的ELISA检测,与埋栓前 1 d、埋栓后7 d、埋栓后13 d(撤栓0 h)相比,撤栓/PMSG肌注48 h试验羊外周血中P含量显著下降,且激素含量的波动范围明显减小,达到相对一致水平,与该时间点的集中发情现象相吻合,说明撤栓48 h前后是中国美利奴羊(新疆军垦型)发情、排卵高峰,P含量在撤栓48 h显著下降,与E2、FSH、LH浓度变化不同,这可能与中国美利奴羊(新疆军垦型)发情配种后妊娠有关。
参考文献:
[1]Ortavant R,Pelletier J,Ravault J P,et al. Photoperiod:main proximal and distal factor of the circannual cycle of reproduction in farm mammals[J]. Oxford Reviews of Reproductive Biology,1985,7(4):305-345.
[2]Greives T J,Mason A O,Scotti M,et al. Environmental control of kisspeptin:implications for seasonal reproduction[J]. Endocrinology,2007,148(3):1158-1166.
[3]Suttie J M,Gluckman P D,Butler J H,et al. Insulin-like growth factor 1(IGF -1)antler - stimulating hormone[J]. Endocrinology,1985,116(2):846-848.
[4]Smith J F,Fairclough R J,Payne E,et al. Plasma hormone levels in the cow:Ⅰ. Changes in progesterone and oestrogen during the normal oestrous cycle[J]. New Zealand Journal of Agricultural Research,1975,18(2):123-129.
[5]Chemineau P,Gauthier D,Poirier J C,et al. Plasma levels of LH,FSH,prolactin,oestradiol -17β and progesterone during natural and induced oestrus in the dairy goat[J]. Theriogenology,1982,17(3):313-323.
[6]賀建宁,王金鑫,狄 冉,等. 常年发情和季节性发情绵羊在不同季节生殖激素变化规律[J]. 畜牧兽医学报,2013,44(10):1547-1553.
[7]权 凯,魏红芳. 羊同期发情技术研究进展[J]. 中国草食动物科学,2015,35(1):54-55.
[8]Scaramuzzi R J,Caldwell B V,Moor R M. Radioimmunoassay of LH and estrogen during the estrous cycle of the ewe[J]. Biology of Reproduction,1970,3(1):110-119.
[9]张 寿,王应安,张勤文,等. 青海半细毛羊发情周期不同时期外周血浆中17β-雌二醇和孕酮含量测定[J]. 中国兽医科技,1999,29(2):31-32.
[10]赵松华,李洪涛,张文祥,等. 非繁殖季节中国美利奴羊血清E2、P4、FSH、LH激素变化规律研究[J]. 黑龙江畜牧兽医,2012(11):49-51.
[11]孙五洋,张英杰,刘月琴. 不同激素处理绵羊同期发情效果初步研究[J]. 中国草食动物科学,2012(增刊1):438-439.
[12]Karsch F J,Moenter S M,Caraty A.The nuroendocrine singnal for ovulation[J]. Anim Repord Sci,1992,28(1/2/3/4):329-341.
[13]Martineza lvarez L,Hernandezceron J,Gonzalezpadilla E,et al. Serum LH peak and ovulation following synchronized estrus in goats[J]. Small Ruminant Research,2007,69:124-128.
[14]张英杰,刘月琴,储明星. 小尾寒羊高繁殖力和常年发情内分泌机理的研究[J]. 畜牧兽医学报,2001,32(6):510-516.
[15]Baird D T. Pulsatile secretion of LH and ovarian estradiol during the follicular phase of the sheep estrous cycle[J]. Biol Reprod,1978,18(3):359-364.
[16]张振汉,魏智清. 产双羔母滩羊生殖周期中血清几种性激素含量的分析研究[J]. 甘肃畜牧兽医,1999,3:16-17.
[17]田占伟,赵宗胜,林 杉,等. 乏情期新疆哈萨克绵羊血清中P4、E2、FSH和LH生殖激素变化规律分析[J]. 石河子大学学报(自然科学版),2015,33(5):553-557.
[18]Govindan S,Ahmand S N,Vedicherl A B,et al. Association of progesterone receptor gene polymorphism (PROGINS) with endometriosis,unterine fibroids and breast cancer[J]. Cancer Biomark,2007,3(2):73-78.
[19]Carlson K M,Pohl H A,Marcek J M,et al. Evaluation of progesterone controlled internal drug release dispensers for synchronization of estrus in sheep[J]. Animal Reproduction Science,1989,18(1/2/3):205-218.
[20]Theodosiadou P,Goulas T H . Kouskoura oestrogen and progesterone concentrations in plasma and oviductal tissue of ewes exhibiting a natural or induced estrus[J]. Animal Reproduction Science,2004,80:59-67.
[21]Karagiannidis A K. Excretion of MPA in the milk of lactating ewes treated for synchronization of estrus[J]. Theriogenology,1995,43(3):605-613.
[22]Campbell[KG*2/3]J[KG*2/3]W,Mc[KG*2/3]Donald[KG*2/3]M[KG*2/3]F,Wickham[KG*2/3]G A. Hormonal and
ovarian responses in romney ewe hoggets after synchronisation and superovulation treatment[J]. Proceedings of the New Zealand Society of Animal Production,1994,54:239-242.
[23]Lazar L,Lenard J. Concentrations of 17beta-estradiol and progesterone in the follicular fluid and blood serum after induction of oestrus in ewes[J]. Slovensky Veterinarsky Casopis,1996,21(5):272-275.
[24]張海容,张 勇,张海涛. 甘肃高山细毛母羊血浆中雌二醇和孕酮的含量变化[J]. 甘肃农业大学学报,2005,40(2):138-141.
[25]侯衍猛,曹洪防,徐云华,等. 莱芜黑山羊发情周期中FSH、LH、E2和P4的分泌规律[J]. 中国兽医学报,2006,26(3):340-343.
[26]谢炳坤,覃兆鲜,公方强,等. 沼泽型水牛发情期血清生殖激素的变化规律研究[J]. 中国畜牧杂志,2008,44(5):18-21.
[27]王金富,冷青文,邓湘泉. 中国美利奴军垦型细毛羊正常发情周期内血清孕酮含量的变化[J]. 四川畜牧兽医,2000(11):22-25.
收稿日期:2019-07-22
基金项目:国家重点研发计划(编号:2017YFD0501904);国家绒毛用羊产业技术体系(编号:CARS-40-07);省部共建绵羊遗传改良与健康养殖国家重点实验室项目(编号:SKLSGIHP2016A01、SKLSGIHP2017A02);新疆生产建设兵团科技攻关与成果转化计划(编号:2016AC027);新疆生产建设兵团重大科技项目(编号:2017AA006)。
作者简介:王晶晶(1995—),女,河南沈丘人,硕士研究生,主要从事动物遗传育种与繁殖研究。E-mail:2318525314@qq.com。
通信作者:万鹏程,博士,研究员,主要从事绵羊繁育与家畜胚胎生物技术研究,E-mail:pengcheng.wan@gmail.com;刘长彬,博士,研究员,主要从事绵羊繁育与家畜胚胎生物技术研究,E-mail:xlchangbin@163.com。

