添加中草药与草分枝杆菌对凡纳滨对虾育苗效果的影响
彭张明 黄明 康健南 刘志刚 蒲桂川

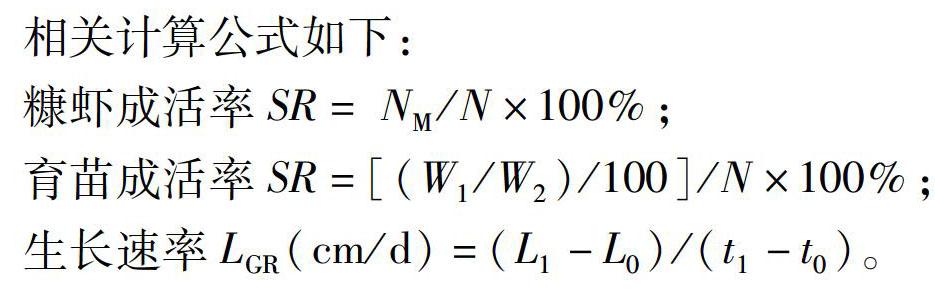
摘要:为探究添加不同浓度中草药(芪参散)与草分枝杆菌对凡纳滨对虾(Litopenaeus vannamei)育苗、虾苗标粗与养殖效果的影响,在室内养殖桶内采用相同方法开展2次育苗试验,并跟踪2次育苗试验虾苗低盐耐受性、标粗与养殖的表现。结果显示,凡纳滨对虾苗生长性状上的差异具统计学意义,D组(2.0%芪参散)和G组(1.0%草分枝杆菌)的育苗效果最佳。虾苗低盐耐受性的表现差异具统计学意义,C组(添加1.0%芪参散)、D组、F组(0.5%草分枝杆菌)和G组的虾苗存活率相比其余组差异显著,此外该4组虾苗标粗成活率、养殖生长速度、养殖成活率及成功率都优于其他组虾苗。在育苗过程中添加一定比例的中草药(芪参散)与草分枝杆菌可提高凡纳滨对虾的育苗效果,对培育高健康优质虾苗、提升标粗与养成效果具有重要意义。
关键词:凡纳滨对虾;中草药(芪参散);草分枝杆菌(Mycobacterium plei Sq-1)菌粉;育苗效果;影响
中图分类号: S966.12+9 文献标志码: A
文章编号:1002-1302(2020)14-0192-06
凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾(Penaeus vannamei),俗稱白对虾或白虾,于1988年从美国引进国内,并在1992年突破了育苗关,在全国各地推广养殖[1]。进入21世纪,对虾养殖业已由片面追求生长速度向高质量、稳定生产转型,优质苗种培育已经引起了政府、企业、养殖户的高度重视,人们对于优质苗种的需求及认知达到了前所未有的高度。优质、健康的苗种是对虾养殖成功的前提和基础,关于凡纳滨对虾室内、室外水泥池育苗试验,工厂化育苗、生态育苗及仿生态育苗的摸索,有益微生物在对虾育苗中的应用等已有大量的研究,并取得了丰厚的成果[2-6]。
中草药对水产动物的生长性能、免疫功能有显著提高,在水产养殖行业有着广泛的应用,不但可以解决化学药品、抗生素等耐药性和药物残留等制约食品安全的问题,而且有利于推动健康养殖的发展[7-9]。微生态制剂是对养殖动物本身或环境有益的微生物及其相关产物[10],已经被广泛应用于医药、食品及饲料添加剂[11]以及污水处理等方面,可以促进水产动物健康生长、预防疾病,同时还具有无毒副作用等优点[12-13]。草分枝杆菌(Mycobacterium plei Sq-1)属于抗酸分枝杆菌属,非结核分枝杆菌快速增长的物种,大量研究证实其能提高机体免疫力[14-15]。在凡纳滨对虾育苗过程添加中草药及草分枝杆菌菌粉尚未有系统研究报道,本研究利用公司独立的种苗研究机构,采用玻璃钢养殖桶进行育苗试验,添加一种复合中草药(芪参散)与草分枝杆菌菌粉在饵料中,旨在探究2种添加物对凡纳滨对虾育苗效果的影响,并对虾苗的生长性状、抗逆能力做一个初步探究,同时还对本次试验培育的虾苗养殖性能做一个跟踪,为中草药和草分枝杆菌微生态制剂在对虾育苗产业中的推广应用提供理论依据,也为培育高健康优质凡纳滨对虾虾苗提供一定的实践依据。
1 材料与方法
1.1 材料
1.1.1 无节幼体 2次育苗试验所用的无节幼体来源于公司种虾场培育的同一批进口SPF凡纳滨对虾亲虾的F1代SPF无节幼体,经公司独立的检测机构检测后,幼体各项检测指标均合格,符合出场标准。
1.1.2 2种添加物 复合中草药(芪参散)与草分枝杆菌菌粉皆来自于湖南圣雅凯生物科技有限公司所生产的产品,芪参散为灰白色或灰黄色的粉末,其处方为黄芪300 g、人参200 g及甘草200 g,经粉碎、过筛、混匀后得到;草分枝杆菌菌粉来自草分枝杆菌(Mycobacterium plei Sq-1)在蔗糖无机盐培养液内首先产生胞壁酰二肽(MDP)、草分枝杆菌多糖(MPS)、CGP免疫调节序列等构形物,其次是黄酮、胡萝卜素、维生素酶多种微量元素,发酵液离心收集菌体,在108~112 ℃烘干、收干,得到一种草分枝杆菌Sq-1的菌体。
1.2 方法
1.2.1 育苗准备工作 2018年8月16日对室内玻璃钢养殖桶、各项育苗工具以及整个车间清洗消毒,安装好气管、气石,投幼体前一天准备好比重为1.020经公司十重水处理流程过后的海水放入室内蓄水池中,调整海水总碱度140~160,pH值8.0~84,投入10 mg/L EDTA-2Na,充分打均匀后,停气沉淀24 h,温度为海水自然温度31~32 ℃。
1.2.2 转水及幼体投放 8月7日上午开始第1次育苗试验,首先从蓄水池中过棉花棒转水到育苗桶(1 m3)中,水位70 cm,进好21个桶的水后,检测余氯为0,下午开始投放幼体,放幼体前投入1.0 ~1.5 mg/L的维生素C到各育苗桶中,总量 250万尾无节幼体,均分投放在21个桶内,密度约11.9万尾/桶,同时,取放幼体前的水样涂弧菌板检测得到黄弧菌、绿弧菌数量为0。
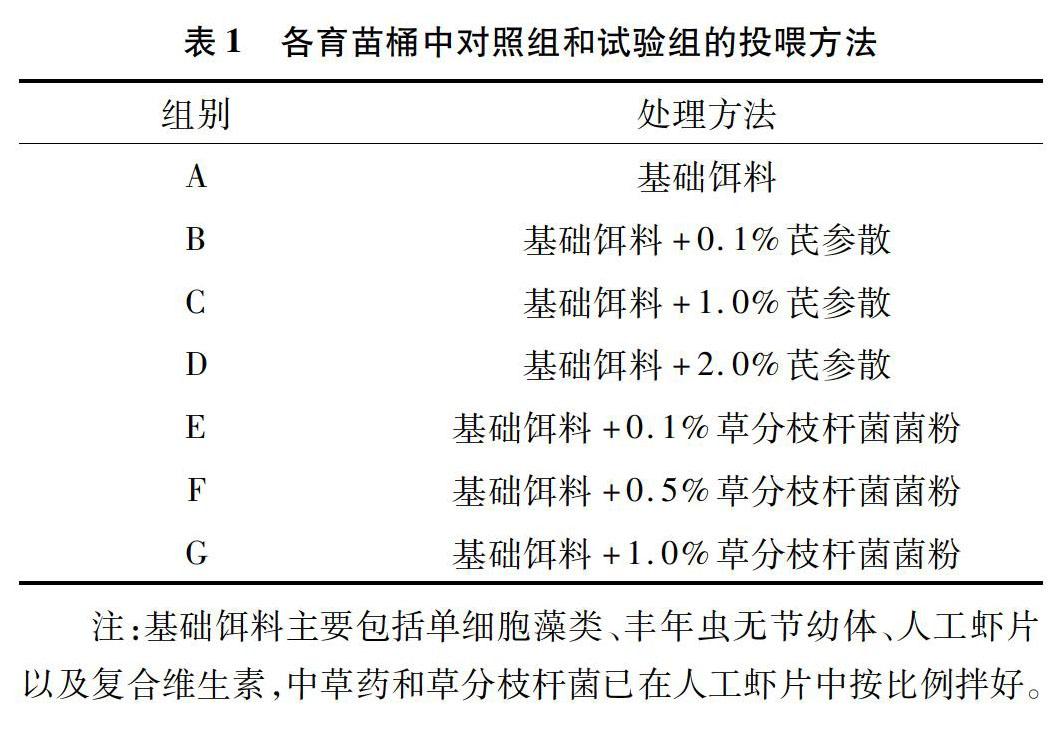
1.2.3 试验设计 将21个育苗桶分成7个组,1个对照组和6个试验组,每个组设置3个重复组,编号为A、B、C、D、E、F和G,按照表1处理方法进行投喂,其中在基础饵料中添加芪参散及草分枝杆菌菌粉的频次为4次/d,另外,每个育苗桶中放置1个500 W的自动恒温棒,根据虾苗不同发育阶段设置所需温度。
1.2.4 日常投喂 虾苗日常投喂按照表1的方法,虾苗发育各时期的具体投喂详细情况见表2。
1.2.5 日常加换水 幼体发育到Z2后期开始加水,每天2~5 cm淡水和3~5 cm海水,虾苗发育到PL1开始排水,每天排水20 cm,到PL4后,每天排水30 cm,海水和淡水对半加,排水后加入1.0 ~15 mg/L的维生素C,降低虾苗的应激,每次加完水后,投入5~8 mg/L的NaHCO3,稳定水质。
1.2.6 育苗试验 第1次育苗试验的育苗周期为2018年8月7—30日,总计24 d,虾苗发育阶段为PL16;第2次育苗试验的育苗周期为2018年9月9日至10月2日,总计24 d,虾苗发育阶段为PL16,育苗试验保持统一的操作方法,无节幼体为同一批次亲虾所生产,2次育苗试验的各环节操作、环境均保持一致,主要目的是做一个重复性验证。
1.2.7 育苗生长指标测定 糠虾成活率测定方法:用1 L的采水器分别在桶的4个角落的上层和底层以及桶的中心取9个点,统计1 L水中糠虾幼体数量的平均值,重复3次,计算出育苗桶中糠虾幼体的数量(NM)。育苗成活率测定方法:在试验结束时,分别将每个桶中的虾苗收集在捞网中,称取质量(W1,精确至0.001 g),再从其中随机取100 ind虾苗,称取其质量(W2),计算每个育苗桶内虾苗存活总数。虾苗全长测定:测量对虾的额剑尖端至对虾尾节末端的长度,要将对虾尽量伸直,然后测量,在PL3、PL8及PL16阶段分别随机取各组50 ind虾苗进行全长测量。
相关计算公式如下:
糠虾成活率SR= NM/N×100%;
育苗成活率SR=[(W1/W2)/100]/N×100%;
生长速率LGR(cm/d)=(L1-L0)/(t1-t0)。
其中N为无节幼体数量,L0和L1为前一次取样的虾苗全长和后一次取样时的全长,t0和t1分别为前一次采样时间和后一次采样时的时间。
1.2.8 低盐耐受性检测 随机取各组育苗桶内PL16阶段虾苗100 ind,放入淡水中30 min,然后将虾苗全部转移到原海水(盐度32‰)中30 min,最后统计虾苗的存活率。
1.2.9 无特定病原携带检测 利用公司引进的荧光定量PCR及巢式PCR等检测手段对各组虾苗进行AHPND(急性肝胰腺坏死病)及EHP(蝦肝肠胞虫)等病原携带检测,检测合格后进行标粗及养殖效果的跟踪。
1.2.10 标粗成活率及养殖效果表现 标粗及养成过程不再投喂芪参散和草分枝杆菌,分别将各组的虾苗集中后转移到遂溪草潭镇养殖基地编号A~G的7个水泥池中进行正常标粗,跟踪各组虾苗的标粗成活率;当虾苗全长规格达到2.5 cm时,进行分池,开展水泥池工厂化养殖,并对各组虾苗养殖效果进行定性跟踪。
1.2.11 数据分析 采用SPSS 19.0分析软件对试验数据进行单因素方差分析(ANOVA),并使用Duncan法进行多重比较,检验处理间的差异显著性水平设为0.05;试验数据采用平均值±标准差表示。
2 结果与分析
2.1 中草药与草分枝杆菌对凡纳滨对虾育苗过程生长性状的影响
由表3、图1可知,通过2次试验数据的分析,D、G两组在虾苗全长、生长速率、糠虾成活率及育苗成活率相比其他组别均表现出差异显著(P<005),而B、C、E及F 4组相比对照组则表现生长性状差异不显著(P>0.05)。
2.2 中草药与草分枝杆菌对凡纳滨对虾虾苗低盐耐受性的影响
由图2可知,C、D、F和G 4组虾苗的存活率相比其余3组存在显著差异(P<0.05),但4组内没有显著差异(P> 0.05),其中存活率最高的是第2次试验中的G组,达到94.5%;B、E组的存活率相比对照组没有显著差异(P>0.05),其中存活率最低的是第1次试验中的对照组,仅为54.3%。
2.3 2次凡纳滨对虾育苗试验虾苗标粗效果与养殖效果的跟踪
通过对2次育苗试验虾苗后续的7 d标粗效果及60 d养殖效果的定性跟踪,由表4中的基本情况
可知,C、D、F和G组虾苗表现最为显著,其标粗成活率、养殖生长速度、养殖成活率及成功率都得到了肯定。这一方面是因为室内水泥池工厂化养殖的先天条件,另外一方面也是因为苗种质量的保障。
3 讨论与结论
3.1 中草药与草分枝杆菌对凡纳滨对虾育苗过程生长性状的影响
中草药中含有维生素、氨基酸、多糖类等营养物质和一些未知的诱食因子,可以增强养殖动物的食欲,促进水产动物机体代谢和消化酶的分泌,提高饵料利用率,从而加速水产动物生长发育。在对虾养殖过程中,通过添加黄芪、板蓝根、甘草、白术、黄芩及大黄等常见中草药的水提取物、制剂及复合制剂到饵料中,可有效促进凡纳滨对虾及斑节对虾(Penaeus monodon)的生长速度、个体增重率、饵料系数和成活率等[16-18]。本研究通过2次重复育苗试验,在凡纳滨对虾育苗过程中添加3种浓度复合中草药(芪参散),虾苗生长速率及成活率均优于对照组,其中以2.0%的添加量效果最佳,生长速率分别达到0.061、0.062 cm/d,育苗成活率分别达到79.3%和70.3%,结果表明添加中草药在凡纳滨对虾育苗过程中可达到促进生长、提升成活率的效果。其原因可能是复方中草药中的某些成分,如黄芪多糖、甘草多糖、黄酮类化合物和葡萄糖氨基酸等已被证实有促生长作用[19]。
微生态制剂被广泛用于水产养殖中,在对虾生长的不同阶段使用芽胞杆菌(bacillus)、乳酸菌(lactic acid bacteria,LAB)以及酵母培养物(Yeast Culture)等具有促进消化、提高虾苗的体质量和存活率以及降低饵料系数的作用[20-22]。育苗阶段,光合细菌(photosynthetic bacteria,PSB)可提高虾苗的成活率、促进变态发育[23]。草分枝杆菌菌体组成成分复杂,其中包括糖类、脂肪、蛋白质、钙、磷、维生素和微量元素等50多种活性成分[24],本试验添加的草分枝杆菌是经灭活制成的菌粉,适口性佳,虾苗可以摄食到多种活性物质,如胞壁酰二肽(MDP)对生长发育和成活率都有促进作用[25],试验得到以1.0%的添加量育苗效果表现最优秀,育苗成活率达到80.0%和73.5%,因此草分枝杆菌也具有微生态制剂的效果,可作为养殖动物的饵料被其直接利用,从而促进养殖动物的生长以及提高养殖动物的消化机能和对饲料的利用率[26-27],进而推测其可作为凡纳滨对虾养殖过程中一种新的微生态制剂。
3.2 中草药与草分枝杆菌对凡纳滨对虾虾苗低盐耐受性、标粗效果与养殖效果的影响
动物抗逆能力是指自身对外界不良因素、环境抵抗的能力,包括抵抗化学性、物理性、生物性等逆境的能力,而低盐耐受性是检验动物抗逆能力强弱重要的方面。在对虾育苗期和养成期,添加一定量的中草药、微生态制剂以及复合中草药益生菌制剂能有效促进凡纳滨对虾抗逆能力的研究已有大量报道[8,12,16]。本育苗试验结果显示,添加1%和2%的中草药(芪参散)的虾苗对在盐度突变后的存活率达到85%以上,而添加0.1%的中草药和对照组没有促进作用,芪参散中含有黄芪多糖、甘草多糖、黄酮类以及生物碱等成分,能够提高凡納滨对虾非特异性免疫相关机能及免疫因子活性[28-29],有效调节机体功能,提高对虾机体免疫,从而改善机体内环境,提高了虾苗的低盐耐受性,因此,建议育苗过程中可添加1%或2%的中草药(芪参散),以提高虾苗的抗逆能力。
2次育苗试验中,添加0.5%和1.0%的草分枝杆菌菌粉相比对照组可以显著提高虾苗盐度突变的存活率,添加0.1%的草分枝杆菌菌粉则没有提升作用,草分枝杆菌菌粉能提高虾苗的抗逆能力可能与其本身所含的MDP、MPS等多种活性物质以及在蔗糖无机盐培养基上发酵后产生的胡萝卜素、黄酮等物质有关,例如MDP可提高机体免疫功力及抗应激能力[25],从而提高机体防御能力。在育苗过程中通过添加草分枝杆菌让虾苗摄食,与添加芽孢杆菌、乳酸杆菌及复合益生菌等活菌类微生态制剂增强凡纳滨对虾机体的免疫力和抗应激能力的机制不尽相同[30],但菌体作为饵料被摄食,也可提高虾苗的抗逆能力。
虾苗质量的优劣直接影响标粗与养殖的成活率,而虾苗的低盐耐受性是体现其抗逆能力的重要的方面,直接影响其成活率,本试验通过2次虾苗标粗与养殖效果的定性跟踪,从侧面很好地说明了这一点。育苗过程的虾苗质量监控至关重要,通过添加中草药(芪参散)与草分枝杆菌的2次育苗试验及标粗、养殖效果的定性跟踪,发现二者之间存在较大关联性,可能原因是芪参散与草分枝杆菌中的某些活性物质让虾苗从小摄食后,完善和巩固了虾苗机体的免疫力、抗病力、抗应激能力等,达到扶正固本的作用,不但提高了育苗的效果,而且对标粗、养殖意义重大。至于2种添加物各自发挥作用的具体机制则有待进一步研究,以及二者配伍后在凡纳滨对虾育苗、养殖中的应用也需要进一步探究。
本研究发现凡纳滨对虾育苗过程中定期添加一定量的中草药(芪参散)和草分枝杆菌能够提高虾苗的成活率及个体生长速度,以添加2.0%芪参散或1.0%草分枝杆菌效果显著;同时可增强虾苗的低盐耐受性能力,以添加1%、2%芪参散或05%、1%草分枝杆菌效果明显。因此,在凡纳滨对虾实际育苗过程中添加中草药(芪参散)和草分枝杆菌,对培育高健康优质虾苗具有重要意义。
参考文献:
[1]张伟权. 世界重要养殖品种——南美白对虾生物学简介[J]. 海洋科学,1990,14(3):69-73.
[2]梁华芳. 南美白对虾室外育苗的初步试验[J]. 水产科学,2003,22(2):27-29.
[3]骆大鹏,何玉贵,杨明秋,等. 凡纳滨对虾室内生态育苗技术[J]. 现代农业科技,2015(10):256-257.
[4]王玉佩,肖培弘,孔玉敏,等. 臭氧在南美白对虾工厂化育苗生产中的应用[J]. 渔业现代化,2006(1):23-24.
[5]林更铭,杨清良,许章程. 对虾无公害生态育苗[J]. 海洋科学,2007,31(10):11-14.
[6]许章程. 益生菌在水产育苗中的应用研究[J]. 应用海洋学学报,2006,25(2):279-284.
[7]陈辉辉,涂晨凌,唐 杨,等. 复方中草药对凡纳滨对虾生长、消化酶和免疫因子活性及抗WSSV的影响[J]. 水产学报,2017,41(11):1766-1778.
[8]周歧存,罗从彦,韩兆红. 复合中草药制剂对凡纳滨对虾生长及抗病力的影响[J]. 饲料研究,2006(9):53-56.
[9]李 政,王国良,金 珊,等. 31种常见抗菌中药对DPPH自由基清除作用的分析[J]. 渔业科学进展,2005,26(1):38-40.
[10]Kesarcodi-Watson A,Kaspar H,Lategan M J,et al.Probiotics in aquaculture:the need,principles and mechanisms of action and screening processes[J]. Aquaculture,2008,274(1):1-14.
[11]Francesca G,Diana D G,Loredana B,et al.The role of protective and probiotic cultures in food and feedand their impact in food safety[J]. Trends in Food Science and Technology,2011,22(1):58-66.
[12]Farzanfar A. The use of probiotics in shrimp aquaculture[J]. Pathogens & Disease,2010,48(2):149-158.
[13]Verschuere L,Rombaut G,Sorgeloos P,et al.Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology & Molecular Biology Reviews,2000,64(4):655-671.

