内生菌定殖水稻对稻田土壤中毒死蜱降解的影响
詹红林 葛静 程江峰 余向阳

摘要:研究了1株具有毒死蜱降解活性的巨大芽孢杆菌(Bacillus megaterium)DGB定殖水稻后对水稻及种植土壤中毒死蜱降解的影响。在低浓度和高浓度毒死蜱处理的土壤中,接菌水稻生物量相比对照分别增加了22.1%和173%;在试验前期接菌水稻中毒死蜱残留量要显著高于对照组,后期差异逐渐减小。与对照相比,接菌水稻种植的低与高2个处理土壤中毒死蜱残留分别减少了27.6%和43.9%,半衰期分别由11 d和10.8 d降至9.6 d和8.1 d。结果表明,该内生菌定殖水稻能够显著促进土壤中毒死蜱的降解,同时对水稻生长也有一定的增益。
关键词:内生菌;毒死蜱;水稻;土壤;生物修复;农药残留
中图分类号: X592 文献标志码: A
文章编号:1002-1302(2020)14-0278-05
毒死蜱(chlopyrifos)是一种广谱性有机磷类杀虫剂。自20世纪60年代以来,毒死蜱广泛用于农业和城市害虫的防治 [1]。2014年对浙江省绍兴市部分蔬菜基地及农贸市场各类蔬菜进行抽检的结果中毒死蜱的农残超标率达到77.8%,其中以青菜、芹菜等叶菜类蔬菜为主[2]。2016年对江西省内16个龙牙百合基地鲜百合进行抽检,其中毒死蜱的检出率为10%[3]。已有研究表明,毒死蜱能够在多种动植物体内富集[4],对人的神经系统和脑发育也有着潜在危害[5-6],毒死蜱还与癌症的发生有关,长期接触可能会增加患肺癌的概率[7-8]。毒死蜱在农田土壤及水体中的残留会对地表水和地下水造成污染。稻田系统又是作物系统中比较特殊的一类,稻田农药更容易通过径流、渗滤等途径进入到水体环境中,因此,修复农田环境中的农药残留对整个生态环境都有非常重要的意义。
生物修复是一种利用微生物降解污染物的修复手段,是一种可靠、经济有效的环境污染治理方法。不同微生物间的合作甚至能够将污染物完全降解,目前,已经有利用微生物修复有机磷农药污染的土壤和水环境的研究[9]。有些微生物在对污染物进行解毒的同时对植物的生长也能起到一定的促进作用[10-11]。关于毒死蜱降解菌的研究较多,人们从环境中已陆续分离出多株具有降解毒死蜱能力的微生物,如希瓦氏菌属BT05[12]、肠杆菌属菌株B-14[13]、苍白杆菌属JAS2[14] 等。Maya等从土壤中分离获得不同菌属的7株毒死蜱降解菌,它们对毒死蜱的降解能力强弱依次为假单胞菌、农杆菌、杆菌[15]。Lakshmi将4株不同属的毒死蜱降解菌(荧光假单胞菌属、羊布鲁氏杆菌、枯草芽孢杆菌、铜绿假单胞菌)分别接种到50 mg/kg毒死蜱污染的土壤中,30 d后毒死蜱的去除率达到85%~92%,而对照土壤中毒死蜱的去除率仅为34%[16]。赵倩等将1株邻单胞菌属降解菌DLL-1接种到含15 mg/kg甲基对硫磷的竹林土壤中,10 d后甲基对硫磷的去除率达到98.8%[17]。但是,在实际应用中由于土壤微生物种群结构的差异经常出现接入的降解菌存活率低、降解活性弱等问题。Li等在修复50 mg/kg毒死蜱污染土壤時发现在接种粪产碱菌属毒死蜱降解菌DSP3的同时种植甘蓝,土壤中毒死蜱在12 d后完全降解,而未种植植物的土壤中毒死蜱12 d的去除率仅为22%[18]。但是对内生降解菌-作物协作治理农田环境中农药残留的研究还较少。
本研究通过室内盆栽试验,向土壤中添加不同浓度的毒死蜱,测定内生菌定殖水稻后对水稻生物量、植株毒死蜱残留和土壤毒死蜱残留的改变,探究内生降解菌与水稻协作对稻田土壤中毒死蜱污染降解的影响。进而分析内生降解菌定殖水稻辅助治理稻田系统中毒死蜱残留的可行性,以期为环境中农药污染物的原位修复提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试植株与土壤 土壤采自江苏省农业科学院实验田,日本晴水稻种子来自江苏省农业科学院粮食作物研究所。供试菌株为课题组前期从水稻内分离出的1株具有毒死蜱降解特性的内生菌DGB,经鉴定为巨大芽孢杆菌属。
1.1.2 主要试剂 97%毒死蜱原药(南京红太阳股份有限公司);99.9%毒死蜱标准品(上海安谱实验科技股份有限公司);色谱纯正己烷(德国Merck公司);分析纯乙腈(德国Merck公司)。
1.1.3 主要仪器 Agilent HP6890气相色谱(美国安捷伦公司);WH-3微型漩涡混合仪(上海沪西分析仪器厂有限公司);Centrifuge 5804R型离心机(EPPENDORF公司);JJ223BC 型电子天平(常熟市双杰测试仪器厂);IKA型组织匀浆机(德国IKA仪器设备有限公司);
1.2 试验设计
土壤于阴凉处晾干后过10目筛,加入一定量毒死蜱混匀后分别获得含2、20 mg/kg毒死蜱的土壤;将生长状况相近的3叶1心水稻幼苗随机分成2组,接菌水稻组置于无菌生理盐水配制的菌悬液中过夜培养,对照组用等量无菌生理盐水处理。接菌水稻与对照水稻均单独移栽至低浓度及高浓度毒死蜱污染的土壤中生长,分别于0、1、3、7、15、30 d测定各处理水稻生物量、水稻植株及土壤中毒死蜱浓度,另测定未种植水稻的毒死蜱污染土壤中毒死蜱残留变化。每个处理重复3次。所有试验于2019年完成于江苏省农业科学院农产品质量安全与营养研究所。
1.3 试验方法
1.3.1 试验水稻种植 水稻种子用3%次氯酸钠溶液浸泡5 min,灭菌去离子水洗涤3~5次,75%乙醇浸泡5 min,灭菌去离子水洗涤3~5次。消毒种子30 ℃避光催芽,出芽状况相近的水稻种子转移至水培系统继续培养,生长至3叶1心开始试验。
1.3.2 样品中毒死蜱的提取分析 水稻植株:水稻植株整株剪碎加入10 mL乙腈后匀浆机打碎,加入1.0 g氯化钠,涡旋振荡1 min,5 000 r/min离心 5 min,取2 mL上清液加入50 mg GCB、100 mg无水硫酸镁和30 mg PSA,涡旋振荡2 min,5 000 r/min离心5 min,取1 mL上清液氮气吹干,加入1 mL色谱级正己烷,过0.22 μm有机系滤膜,待进样。
土壤:称取5.0 g土壤加入10 mL乙腈,涡旋振荡 2 min,加入2.0 g氯化钠,涡旋振荡2 min,5 000 r/min 离心5 min,取2 mL上清液加入100 mg无水硫酸镁和50 mg PSA,涡旋振荡2 min,5 000 r/min 离心 5 min,取1 mL上清液氮气吹干,加入1 mL色谱级正己烷,过0.22 μm有机系滤膜,待进样。
气相色谱检测条件:HP-1701毛细管柱(30 m×250 μm×0.25 μm);ECD检测器温度320 ℃;进样口温度280 ℃;柱温150 ℃,保持1 min,以 15 ℃/min 的速度升至270 ℃,保持5 min;进样量,1 μL;载气为N2,流速1 mL/min。该方法下毒死蜱在仪器上的保留时间为8.81 min,在水稻植株样品中的回收率为106.78%,RSD为6.39%;在土壤样品中的回收率为95.26%,RSD为4.83%。
2 结果与分析
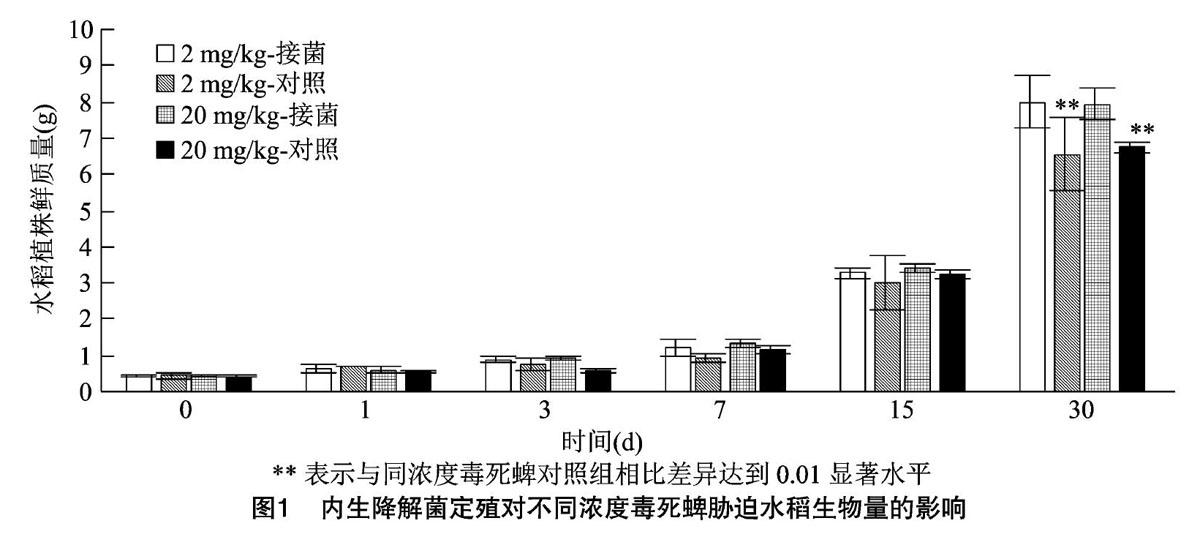
2.1 内生菌定殖对水稻生物量的影响
接菌与对照水稻在2 mg/kg与20 mg/kg毒死蜱污染的土壤中生长1个月,随着时间变化各处理水稻生物量的变化如图1所示。在2 mg/kg毒死蜱污染土壤处理中接菌水稻在7 d时水稻生物量略高于对照处理水稻,到30 d时接菌水稻生物量达到对照组水稻生物量的1.22倍;20 mg/kg污染土壤中对照组水稻在前3 d生物量变化不明显,到30 d时接菌水稻与对照组水稻生物量也出现较大差距,接菌水稻生物量为对照组的1.17倍。不同浓度毒死蜱污染对水稻生物量变化影响不明显。
2.2 内生菌定殖对水稻植株毒死蜱残留的影响
2 mg/kg毒死蜱污染土壤中接菌水稻与对照水稻毒死蜱含量变化见图2。水稻植株内毒死蜱含量在开始處理1 d时内急剧上升,接菌水稻毒死蜱含量达到了对照组水稻的1.56倍,从7 d时开始2个处理水稻毒死蜱含量差异显著减小,到15 d时由132倍减至1.13倍,并于30 d时接菌水稻毒死蜱含量与对照水稻基本保持一致。20 mg/kg污染土壤中水稻植株内毒死蜱含量变化与2 mg/kg污染土壤相似,1、3、7、15、30 d时样品中接菌水稻毒死蜱含量分别为对照组的1.40、1.43、1.53、1.33、1.30倍,在7 d时2个处理水稻毒死蜱含量差异最大,随后差异开始逐渐减小。
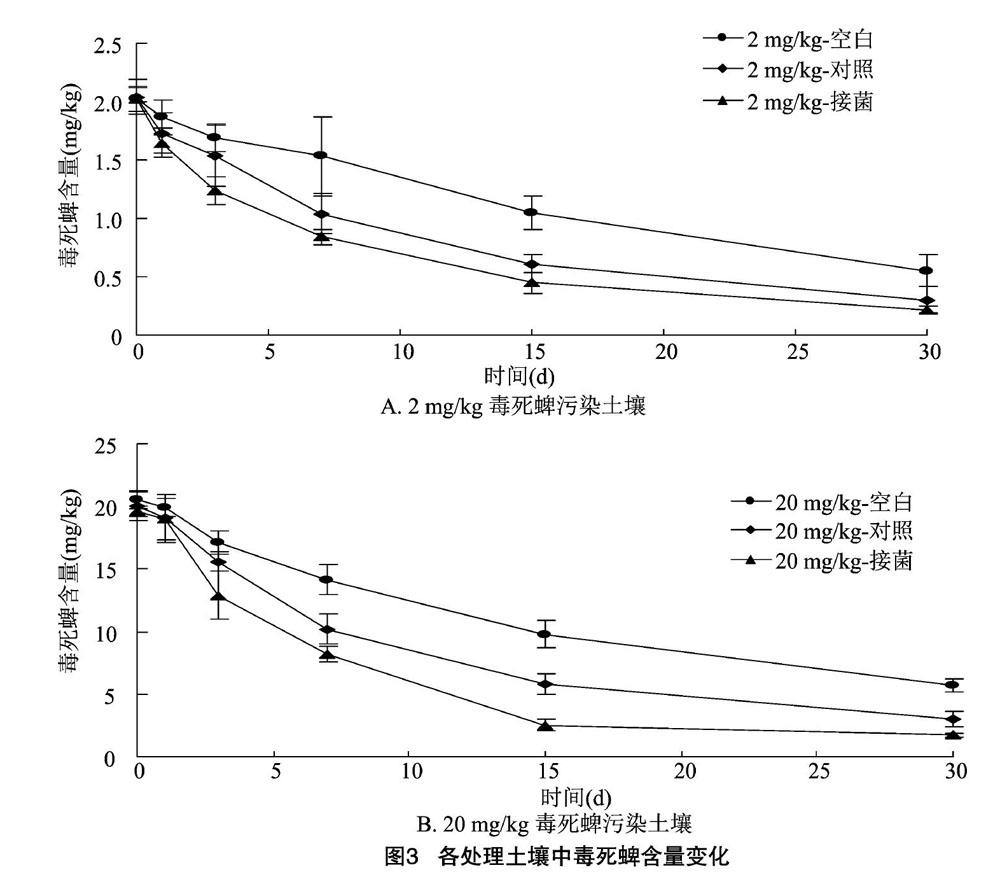
2.3 内生菌定殖水稻对土壤毒死蜱残留的影响
土壤中毒死蜱含量变化以未种植水稻的土壤为空白组,种植未接菌水稻的土壤为对照组,种植接菌水稻的土壤毒死蜱含量变化见图3。30 d时 2 mg/kg 毒死蜱污染处理对照组与接菌水稻组土壤中毒死蜱残留量分别为空白组的54.92%和3978%;20 mg/kg 毒死蜱处理的结果较为相似,对照组与接菌水稻组土壤中毒死蜱残留量分别为空白组的5286%和29.83%。
各处理土壤中毒死蜱降解动态、相关系数和半衰期见表1。2 mg/kg毒死蜱处理空白组、对照水稻组、接菌水稻组土壤中毒死蜱半衰期分别为16.12、11.00、9.63 d;20 mg/kg毒死蜱处理各组土壤中毒死蜱半衰期分别为16.12、10.83、8.06 d。可见,2 mg/kg 及20 mg/kg毒死蜱污染的土壤中种植水稻能够对毒死蜱的降解起到明显的促进作用,内生菌定殖水稻则能够进一步加速土壤中毒死蜱降解速率。
3 讨论与结论
利用内生菌与农作物协作修复农田环境中的农药污染已成为近年来的研究热点[19],这可能成为农药污染修复及保障农产品安全的一条有效途径。本试验通过降解菌定殖,探究微生物与水稻协作对土壤中毒死蜱修复的作用。结果表明,接菌后有利于种植于毒死蜱污染土壤中水稻生物量的增加,对水稻植株内毒死蜱含量检测结果表明,接菌后水稻植株内毒死蜱的含量在前期要远高于对照,但到后期差异迅速减小。由此可知,内生菌定殖只会在短时间内增加水稻内的毒死蜱浓度。
低与高浓度毒死蜱处理土壤中种植水稻后对土壤中毒死蜱的去除均有一定的促进作用,当水稻接菌后这种促进得到进一步强化。相似的,黄春萍等[20]发现施用具有毒死蜱降解活性的芽孢杆菌MZS1可同时促进大芥菜与土壤中毒死蜱的降解,且对大芥菜有一定的促生作用。但直接喷施菌液受到环境中多种因素的影响,效果不是十分稳定,降解菌定殖作物则可以极大地避免这些影响。
于毒死蜱污染土壤,结果表明接菌后对受到毒死蜱胁迫的水稻有着显著的促生作用,且极大地加快了土壤中毒死蜱的降解速率,而接菌水稻植株内毒死蜱含量的上升也仅发生在短时间内。接菌后水稻可以在正常生长的同时加速降解土壤中的农药残留,因此,内生菌与农作物协作修复农田环境中农药污染问题是可行的。为了更好地利用内生菌与作物协作修复土壤中有机物污染,仍需进一步研究植物与内生菌间的相互作用机制。
参考文献:
[1]张志勇,余向阳,王冬兰,等. 小青菜对土壤中毒死蜱吸收移动特征研究[J]. 土壤学报,2011,48(5):1029-1034.
[2]周建昌,马秋玲,卢春霞,等. 蔬菜中毒死蜱农药残留现状和禁用后监管的探讨 [J]. 浙江农业科学,2016,57(12):2101-2102.
[3]阳 丽,廖 健,魏敏芝,等. 江西省龙牙百合农药残留现状分析 [J]. 生物灾害科学,2017,40(1):26-29.
[4]陈舜华,钟创光,赵小奎. 几种淡水动植物对14C-毒死蜱的吸收、分布和消长的研究 [J]. 核农学报,1998(5):31-37.
[5]王道泽,宋 亮,洪文英,等. 毒死蜱在设施青菜上的残留动态及安全使用技术 [J]. 浙江农业学报,2011,23(2):344-348.
[6]Oliver G R,Bolles H G,Shurdut B A. Chlorpyrifos:probabilistic assessment of exposure and risk [J]. Neurotoxicology,2000,21(1/2):203-208.
[7]Alavanja M C R,Dosemeci M,Samanic C,et al. Pesticides and lung cancer risk in the agricultural health study cohort [J]. American Journal of Epidemiology,2004,160(9):876-885.
[8]Greenburg D L,Rusiecki J,Koutros S,et al. Cancer incidence among pesticide applicators exposed to captan in the agricultural health study[J]. Cancer Causes & Control,2008,19(10):1401-1407.
[9]Singh B K,Walker A . Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews,2010,30(3):428-471.
[10]Bano N,Musarrat J . Characterization of a novel carbofuran degrading Pseudomonas sp. with collateral biocontrol and plant growth promoting potential[J]. FEMS Microbiology Letters,2004,231 (1):13-17.
[11]Zhou G C,Wang Y,Ma Y et al. The metabolism of neonicotinoid insecticide thiamethoxam by soil enrichment cultures,and the bacterial diversity and plant growth‐promoting properties of the cultured isolates [J]. Journal of Environmental Science and Health,Part B,2014,49(6):381-390.
[12]Govarthanan M,Ameen F,Kamala-Kannan S,et al. Rapid biodegradation of chlorpyrifos by plant growth-promoting psychrophilic Shewanella sp. BT05:an eco-friendly approach to clean up pesticide-contaminated environment [J]. Chemosphere,2020,247:125948.
[13]Singh B,Walker A,Morgan J A W,et al. Biodegradation of chlorpyrifos by enterobacter strain B-14 and its use in bioremediation of contaminated soils [J]. Applied and environmental microbiology,2004,70(8):4855-4863.
[14]Abraham J,Silambarasan S. Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol using a novel bacterium Ochrobactrum sp. JAS2:a proposal of its metabolic pathway[J]. Pesticide Biochemistry & Physiology,2016,126:13-21.
[15]Maya K,Singh R S,Upadhyay S N,et al. Kinetic analysis reveals bacterial efficacy for biodegradation of chlorpyrifos and its hydrolyzing metabolite TCP[J]. Process Biochemistry,2011,46(11):2130-2136.
[16]Lakshmi C V,Kumar M,Khanna S. Biotransformation of chlorpyrifos and bioremediation of contaminated soil [J]. International Biodeterioration and Biodegradation,2008,62(2):204-209.
[17]赵 倩,陈双林,叶雪均,等. 竹林土壤中甲基对硫磷降解菌的降解效果及其与土壤物理特性的关系 [J]. 环境工程学报,2009,3(7):1325-1328.
[18]Li Y,Zhao Y H,Zhang B X,et al. Isolation and characterization of a chlorpyrifos and 3,5,6-trichloro-2-pyridinol degrading bacterium [J]. FEMS Microbiology Letters,2005,251(1):67-73.
[19]Newman L A,Reynolds C M. Bacteria and phytoremediation:new uses for endophytic bacteria in plants [J]. Trends in Biotechnology,2005,23(1):6-9.
[20]黄春萍,李 江,李艳琳,等. 生物降解菌MZS1对大芥菜及土壤中毒死蜱的降解效果 [J]. 贵州农业科学,2016,44(4):66-70.
收稿日期:2020-04-28
基金项目:国家自然科学基金面上项目(编号:31872002)。
作者简介:詹红林(1994—),男,江西九江人,硕士研究生,主要从事微生物、植物與环境污染物研究。E-mail:1426417856@qq.com。
通信作者:余向阳,博士,研究员,主要从事农产品质量安全与营养品质评价研究,E-mail:yuxy@jaas.ac.cn;程江峰,博士,副教授,主要从事食品生物技术与食品安全研究,E-mail:chengjiangfeng@qust.edu.cn。

