两种杜鹃花切花开放和衰老进程中活性氧代谢的变化
郑 芳,耿兴敏,何丽斯,苏家乐
(1.南京林业大学 风景园林学院,江苏 南京 210037;2. 江苏省农业科学院 休闲农业研究所,江苏 南京 210014)
已有研究表明,植物受到逆境胁迫[1]、缺乏营养[2]以及在衰老进程中[3]均会导致体内活性氧的积累,从而对植物细胞产生毒害作用。然而,被控制在适当水平的活性氧可以发挥信号传导的作用,进而调控植物生长发育,有利于植物对逆境的适应[4-5]。活性氧的过量积累会诱导植物产生应激反应,从而增强抗氧化防御能力来减轻对植物的过氧化损伤。抗氧化防御体系包括酶促和非酶促系统,其中酶促系统包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)和谷胱甘肽还原酶(Glutathione reductase,GR)等, 非酶抗氧化物主要包括抗坏血酸(Ascorbate,AsA)和谷胱甘肽(Glutathione,GSH)以及黄酮类等物质,APX和GR在AsA-GSH循环中发挥着重要作用[6-7]。
很多花瓣衰老与活性氧水平的升高密切相关,而活性氧的产生也伴随着抗氧化防御能力的增强[8]。活性氧代谢以及抗氧化反应在不同的切花中存在不同的变化,切花菊(Chrysanthemumcv. Maghi)衰老过程中O2.-产生速率和H2O2含量上升,同时伴随着膜脂过氧化加剧[9]。对郁金香(Tulipa.gesnerianaL. cv. Ile de France)切花的研究发现H2O2含量呈现双峰变化,切花衰老与H2O2第二峰值的出现有关,当H2O2含量的第二个峰值出现时APX和CAT活性下降,花瓣中DNA降解酶活性上升,导致花瓣衰老[10]。在对鸢尾(IrisversicolorL.)花衰老的研究中也发现CAT、APX等抗氧化酶的降低与衰老密切相关[11]。唐菖蒲花瓣衰老过程中各个抗氧化酶的变化呈现不同模式,推测APX活性下降导致H2O2积累,而积累的H2O2可以发挥信号作用,诱导SOD基因表达以及SOD酶活性提高[12]。这些研究表明,活性氧清除系统在切花开放和衰老进程中起着重要作用。
切花的瓶插寿命影响着切花的商业价值,因此花瓣衰老过程中的生理代谢、生化反应、分子生物学和花瓣的衰老类型等受到广泛关注[13]。杜鹃花属(RhododendronL.)植物花色艳丽、花型繁多,杜鹃切花具有花期长、观赏价值高等特点。目前关于杜鹃切花衰老过程中活性氧清除系统的研究尚未见报道。本研究以‘红珊瑚’杜鹃(R.hybridum‘Hong Shanhu’)和锦绣杜鹃(R.pulchrum)两个杜鹃品种为试验材料,研究杜鹃切花不同开放状态下活性氧代谢以及抗氧化清除系统的变化,以期为杜鹃切花的采后保鲜提供理论依据。
1 材料与方法
1.1 试验材料和取样方法
‘红珊瑚’(R.hybridum‘Hong Shanhu’)和锦绣杜鹃(R.pulchrum)分别取自常州裕华杜鹃种植有限公司和南京林业大学校园。选取健壮、无病虫害、营养状况一致的花枝于花蕾期剪取后用蘸水脱脂棉包裹,并于4小时之内运至南京林业大学风景园林学院实验室,放入超纯水中进行瓶插。在瓶插过程中,分别在5个开放状态取样。各个状态的取样至少选取3朵以上的花,将花瓣剪碎混匀,放置-80℃用于后期实验,每个指标测定进行3次重复。

图1 两种杜鹃花开放和衰老过程中的取样状态
1.2 指标测定
采用硫代巴比妥酸法测定丙二醛(MDA)含量[14]。超氧阴离子(O2.-)含量测定采用羟胺氧化法[15]。H2O2测定采用碘化钾法测定[16]。SOD、POD和CAT活性分别采用氮蓝四唑(NBT)法、愈创木酚法和紫外吸收法来测定[17]。APX采用紫外吸收法,通过测定AsA的减少量来测定[18];GR活性测定采用紫外吸收法[19];AsA采用Fe3+还原法[20]测定;GSH采用酶还原法测定[21]。
1.3 数据分析
试验过程中的数据处理、方差分析等均运用 Excel 2007和 SPSS 23.0软件完成,偏相关性分析采用SPSS 23.0软件完成。
2 试验结果
2.1 活性氧和膜脂过氧化的变化
由图2可以看出,在‘红珊瑚’切花中O2.-产生速率的变化趋势为先下降后上升再下降的趋势,分别在状态Ⅰ和状态Ⅳ出现较高值;锦绣杜鹃切花O2.-产生速率在开放和衰老过程中呈波状变化,状态Ⅴ达到最高值。‘红珊瑚’切花O2.-产生速率除在状态Ⅴ之外总体显著高于锦绣杜鹃切花。
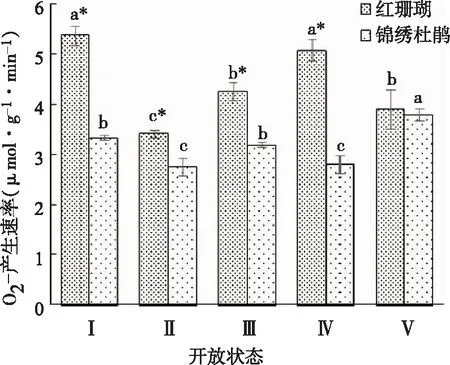
图2 两种杜鹃切花不同开放状态下O2.-产生速率的变化
由图3中可以看出,在‘红珊瑚’切花中H2O2含量变呈先上升后下降再上升的趋势,在状态Ⅱ和状态Ⅲ时H2O2含量显著高于其他状态。锦绣杜鹃切花H2O2含量变化呈先下降后上升的趋势,在状态Ⅴ时有所下降,但与状态Ⅳ相比无显著性差异(P< 0.05)。‘红珊瑚’切花H2O2含量在状态Ⅰ和状态Ⅳ时显著低于锦绣杜鹃,在状态Ⅱ、Ⅲ时显著高于锦绣杜鹃切花。

图3 两种杜鹃切花不同开放状态下H2O2含量的变化
由图4可以看出,‘红珊瑚’切花MDA含量呈先下降后上升的变化趋势,在状态Ⅰ时含量较高,从状态Ⅱ之后随着切花的开放和衰老MDA含量上升。锦绣杜鹃切花开放和衰老过程中MDA含量变化幅度较小,并且MDA含量显著低于‘红珊瑚’切花。

图4 两种杜鹃切花不同开放状态下MDA含量的变化
2.2 抗氧化酶和抗氧化物质的变化
由图5可以看出,‘红珊瑚’切花SOD活性在前3个状态稍有下降,在状态Ⅳ时升高并且维持到状态Ⅴ。锦绣杜鹃切花SOD活性呈先下降后上升再下降的趋势,与‘红珊瑚’切花变化趋势不相同。并且在锦绣杜鹃切花中SOD活性显著高于‘红珊瑚’切花。

图5 两种杜鹃切花不同开放状态下SOD活性的变化
如图6所示,‘红珊瑚’切花POD活性呈波状变化,锦绣杜鹃切花POD活性在状态Ⅱ时下降,之后无显著变化。‘红珊瑚’切花POD活性在状态Ⅰ和状态Ⅳ时显著低于锦绣杜鹃切花,其他状态下POD活性无差异。
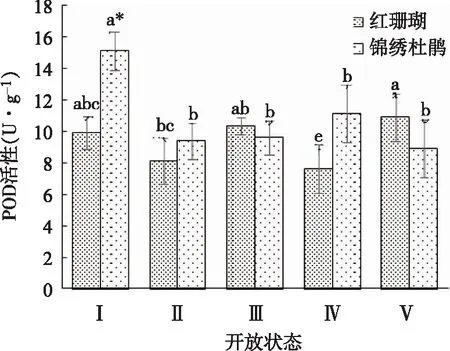
图6 两种杜鹃切花不同开放状态下POD活性的变化
由图7可以看出,‘红珊瑚’切花CAT活性呈先上升后下降的趋势,在状态Ⅱ和状态Ⅲ时达到最高值,之后下降。锦绣杜鹃切花CAT活性也基本呈先上升后下降的趋势,虽然在状态Ⅱ时有所下降,但不显著。‘红珊瑚’切花除在状态Ⅱ时CAT活性与锦绣杜鹃差异不显著之外,其他状态CAT活性均显著低于锦绣杜鹃。
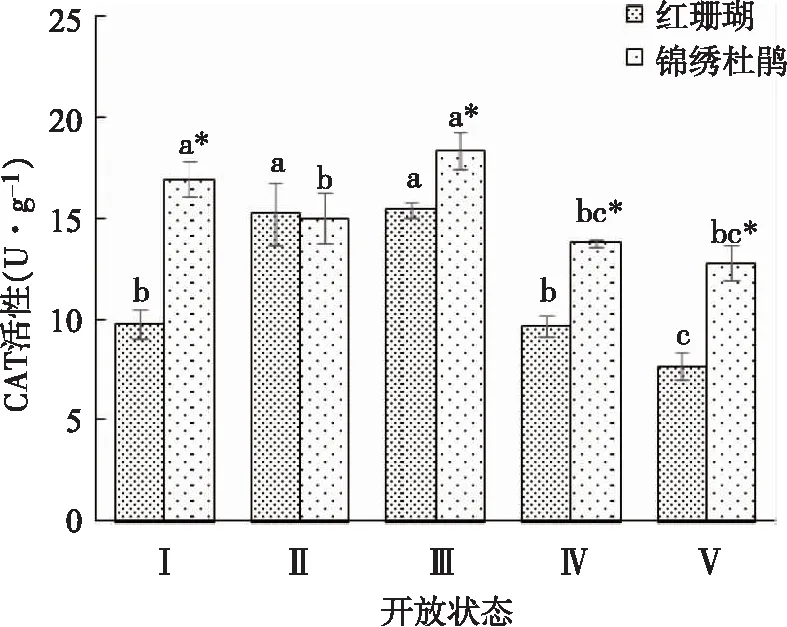
图7 两种杜鹃切花不同开放状态下CAT活性的变化
如图8所示,APX活性变化在‘红珊瑚’切花中总体呈上升趋势,但在状态Ⅱ、Ⅲ和Ⅳ时变化不显著。锦绣杜鹃切花APX活性呈先上升后下降再上升的趋势,在状态Ⅱ时上升到最高值,状态Ⅳ时下降到最低。
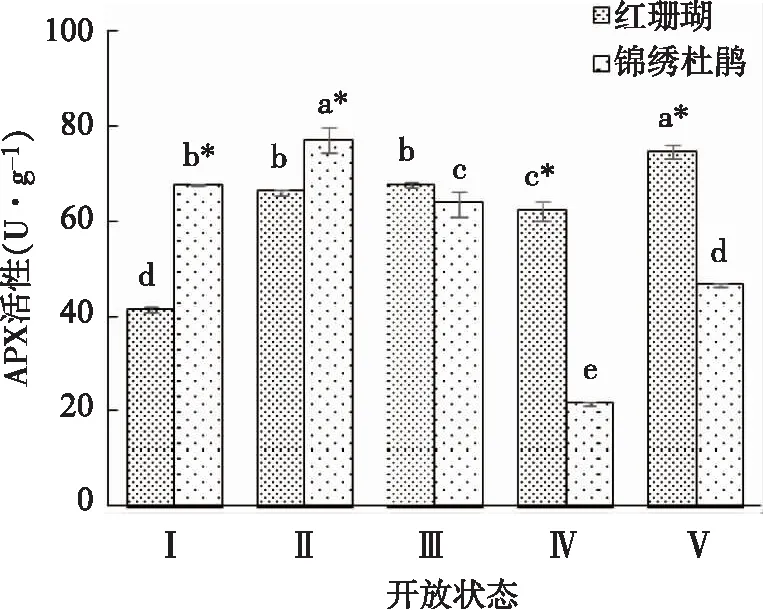
图8 两种杜鹃切花不同开放状态下APX活性的变化
如图9所示,‘红珊瑚’切花GR活性呈先上升后下降再上升的变化趋势,在状态Ⅲ和状态Ⅴ时达到最高值。锦绣杜鹃切花GR活性变化与‘红珊瑚’切花不同,呈先下降后上升再下降的趋势,在状态Ⅰ和状态Ⅲ活性最高。
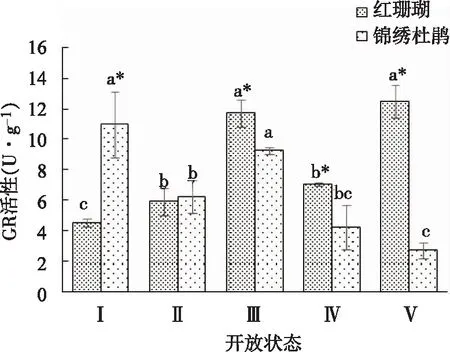
图9 两种杜鹃切花不同开放状态下GR活性的变化
如图10所示,‘红珊瑚’切花AsA含量变化呈现先下降后上升的趋势,在状态Ⅱ时降到最低值,锦绣杜鹃切花AsA含量变化趋势与‘红珊瑚’切花相似,在状态Ⅲ时将到最低值,‘红珊瑚’切花AsA 含量显著高于锦绣杜鹃。

图10 两种杜鹃切花不同开放状态下AsA含量的变化
如图11所示,‘红珊瑚’和锦绣杜鹃切花GSH含量变化均呈先下降后上升的趋势,在状态Ⅲ时下降到最低值。‘红珊瑚’切花GSH含量整体高于锦绣杜鹃切花。
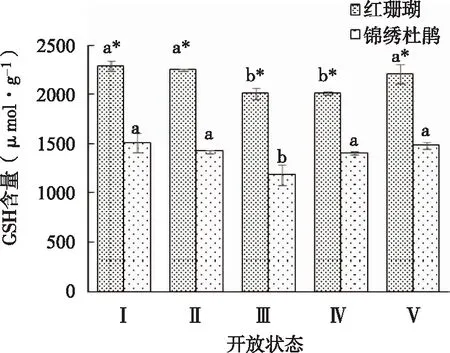
图11 两种杜鹃切花不同开放状态下GSH含量的变化
2.3 相关性分析
从表1中可以看出在‘红珊瑚’切花中,开放状态与SOD、APX和Gr呈正相关,并且达到极显著水平(P< 0.01);O2.-与H2O2和APX呈负相关,分别达到显著(P< 0.05)和极显著水平(P< 0.01),O2.-与MDA呈正相关,并且达到显著水平;MDA与CAT和AsA分别呈负相关和正相关,并且均达到极显著水平(P< 0.01);SOD与CAT和AsA分别呈负相关和正相关,并且均达到极显著水平(P< 0.01);CAT与AsA呈负相关且达到极显著水平(P< 0.01);APX与Gr呈正相关,并且达到极显著水平(P< 0.01)。从表2中可以看出在锦绣杜鹃切花中,开放状态除与AsA呈正相关且达到极显著水平(P< 0.01)之外,与其他指标均呈负相关,并达到显著或极显著水平;H2O2与SOD和POD呈正相关,并达到极显著水平;MDA与APX呈正相关,并且达到极显著水平(P< 0.01);SOD与POD、CAT和Gr呈正相关,与AsA呈负相关,均达到显著水平(P< 0.05);CAT与APX、Gr和AsA均呈正相关,与APX达到显著相关水平(P< 0.05),与Gr和AsA达到极显著相关水平(P< 0.01);APX与Gr和AsA分别呈正相关和负相关,并且均达到显著水平(P< 0.05);Gr与AsA呈负相关且达到极显著水平(P< 0.01)。
3 讨论
衰老、营养缺乏和机械损伤[3,2,22]均会导致活性氧的产生,两种杜鹃花切花在状态Ⅰ时O2.-具有较高水平,可能是因为采切伤口所产生的应激反应,刘亚杰[23]在对香雪兰的研究中也有类似报道。红珊瑚切花在衰老时O2.-产生速率出现下降的情况,与牡丹‘赵粉’相似[24],锦绣杜鹃切花O2.-产生速率变化与郑翠萍等[25]对香石竹切花的研究相似,在衰老之前变化起伏,衰老时上升。‘红珊瑚’切花H2O2含量在花朵开放时达到较高值,这与香雪兰[23]和桂花[30]等大多数切花并不相同。锦绣杜鹃切花H2O2含量变化出现两个峰值,这与郁金香[10]和牡丹切花[26]类似,H2O2含量的第二峰值出现可能与其作为信号分子诱发的衰老有关[12]。两种杜鹃花离体状态下活性氧的变化不相同,说明杜鹃切花活性氧的代谢存在种间差异,这在牡丹切花中也有类似报道[26]。
MDA是反应膜脂过氧化的重要指标[27],‘红珊瑚’切花MDA含量显著高于锦绣杜鹃切花,这与‘红珊瑚’切花O2.-水平较高有关,O2.-作为一种自由基在细胞内积累时会导致膜脂过氧化、膜结构的损坏及MDA含量的增加[28]。本研究中‘红珊瑚’切花MDA含量在状态Ⅰ时较高,随后又下降,这可能是切花采后水分胁迫导致的MDA含量升高[29]。大多数切花衰老过程中MDA含量成倍增加,切花的衰老与MDA的上升联系紧密[30,23],而在本研究中两种杜鹃切花衰老时MDA含量未出现大幅度的上升,说明此时花瓣膜结构相对稳定,并未产生严重的膜结构损伤。从相关性分析中也可以看出两种杜鹃切花从开放到衰老过程中的不同状态与MDA和O2.-的相关性未达到显著水平,这进一步说明了杜鹃切花的衰老与活性氧和膜脂过氧化关联不紧密。

表1 ‘红珊瑚’切花各指标之间相关性分析
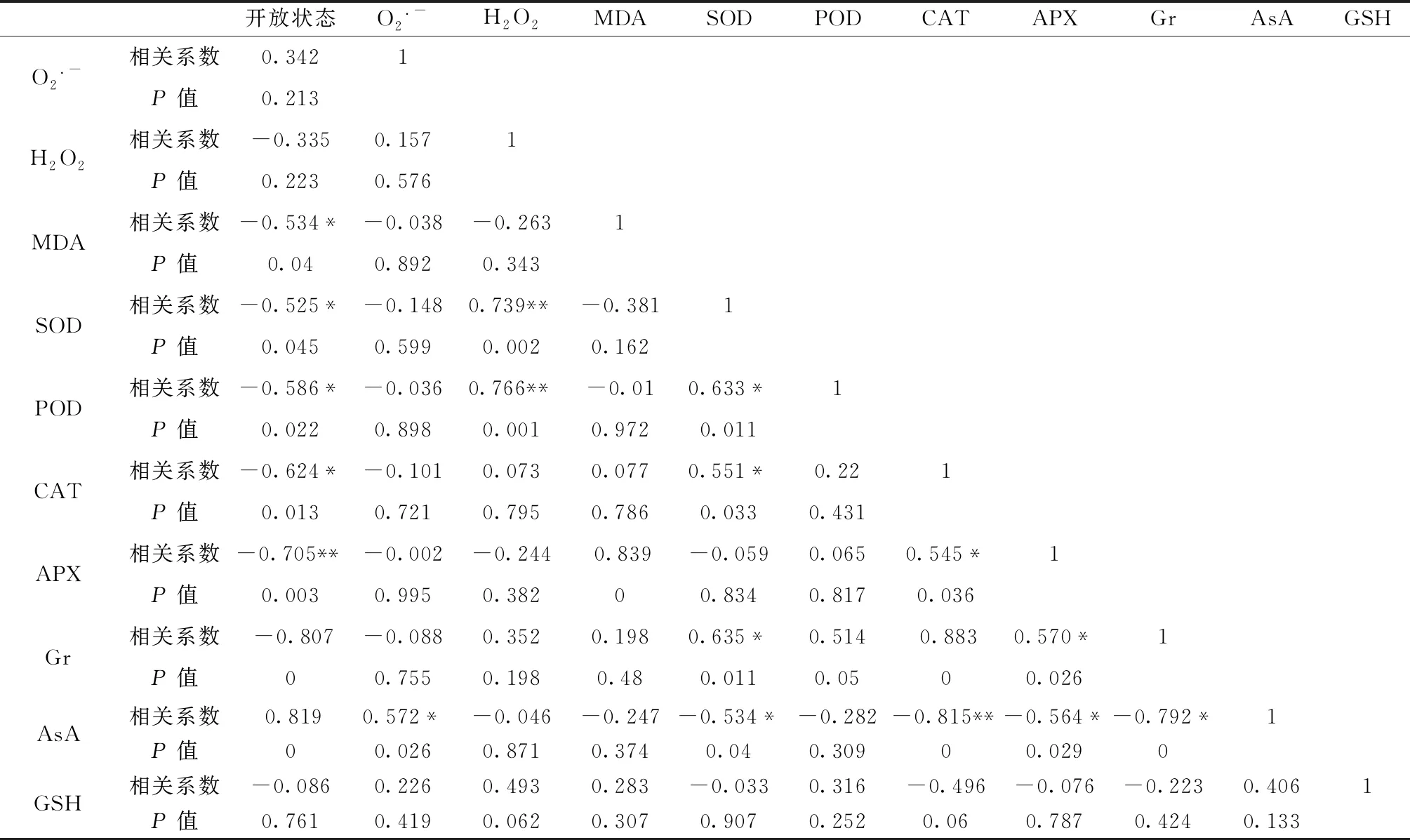
表2 锦绣杜鹃切花各指标之间相关性分析
活性氧清除酶在花瓣衰老过程中具有重要作用。在‘红珊瑚’切花衰老时SOD活性上升,有效清除了O2.-,这与剑兰切花衰老过程中SOD活性的变化相似[12]。锦绣杜鹃切花在状态Ⅰ时SOD活性较高,这可能与此时花瓣具有较高O2.-水平有关。之后SOD活性的变化趋势又与大多数切花相似,随着花瓣开放活性增加,随后衰老时下降[11] [26]。CAT活性在两种杜鹃切花中均呈先上升后下降的变化,切花衰老与CAT活性下降密切相关[11] [31]。而POD活性在两种杜鹃切花中均呈起伏变化,在衰老过程中活性差异也不显著,说明POD在杜鹃切花开放和衰老过程中并未发挥重要作用。在杜鹃切花中SOD和CAT在衰老过程中发挥的作用要高于POD。此外,从两种切花CAT和SOD活性可以看出锦绣杜鹃切花抗氧化能力要强于‘红珊瑚’切花。
AsA-GSH循环在清除活性氧中发挥重要作用[32],本研究中两种杜鹃切花开放和衰老过程中AsA含量变化均呈先下降后上升的趋势,与周媛[30]对桂花的研究结果相似。AsA和GSH除了与GR和APX共同发挥清除活性氧的作用之外,还能单独发挥清除活性氧的作用[33]。本研究中AsA和GSH含量变化随杜鹃切花衰老而上升,说明衰老时这两种物质发挥了作用。‘红珊瑚’切花APX在衰老时仍具有较高活性,可能与AsA的保护作用有关[34]。在衰老过程中锦绣杜鹃GR和APX活性下降而‘红珊瑚’切花中这两种酶仍有上升趋势,说明‘红珊瑚’切花此时的抗氧化能力要强于锦绣杜鹃。从AsA-GSH循环中可以看出‘红珊瑚’切花抗氧化能力要强于锦绣杜鹃切花。
相关性分析结果表明,在‘红珊瑚’和锦绣杜鹃切花中SOD和CAT呈正相关,说明这两种酶在两种杜鹃切花中发挥的作用相一致。而POD在锦绣杜鹃切花中也表现出与CAT具有相关性,说明抗氧化酶在两种切花中的作用具有差异性。‘红珊瑚’切花中抗氧化酶SOD和CAT与AsA均呈负相关,而锦绣杜鹃切花中SOD和CAT活性与AsA-GSH循环中的相关指标表现出正相关,说明两种杜鹃切花中抗氧化酶促系统和非酶系统具有不同的协调作用机制。

