1株二氯喹啉酸降解菌的分离、鉴定及降解特性研究
贺亚斐, 张来星, 曹子敬, 吴坤, 张继冉, 徐淑霞
(河南农业大学生命科学学院,河南 郑州 450002)
二氯喹啉酸(quinclorac)是德国巴斯夫股份公司开发的激素型喹啉羧酸类除草剂,对稗草治理作用明显,在中国稻田中应用广泛[1]。二氯喹啉酸在土壤中残留期长,难以自然降解,并且人们对其降解特性认识不足。大量施用二氯喹啉酸,会导致其在土壤和水体中大量残留,对中国农业生产造成严重的危害[2]。周小会等[3]研究发现,二氯喹啉酸残留在土壤中会对烟草根际土壤微生物数量产生明显影响。此外,土壤中残留的二氯喹啉酸会使烟草叶片发生畸形,叶面萎缩卷曲出现线状,阻碍烟叶生长[4]。二氯喹啉酸降解受到光照和土壤理化性质的影响,但是目前常用的方法包括物理吸附、光化学降解、化学水解和深耕翻土等并不能从根本上解决二氯喹啉酸在土壤中残留的问题[5]。微生物在土壤中的代谢能够改善土壤环境,促进土壤中二氯喹啉酸的降解,而二氯喹啉酸在土壤中的降解主要依靠微生物[6-7]。目前研究人员已经发现了一些二氯喹啉酸的降解菌,包括仓白杆菌属(Ochrobactrumsp.)的菌株LS[8]、产碱菌属(Alcaligenes)的菌株J3[9]、分枝杆菌属(Mycobacteriumsp)的菌株F4[10]、博德特氏菌属(Bordetella)的菌株HN36[11]、节杆属菌株(Arthrobactersp.)的解菌MC-10[12]、链霉菌属(Streptomycesp.)菌株AH-B[13]、嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)的菌株J03[14]等。这些菌种对二氯喹啉酸都有良好降解效果,但是关于微生物降解二氯喹啉酸机制方面的研究较少。本研究从长期生产二氯喹啉酸的河南某农药厂污泥中分离出1株二氯喹啉酸降解菌,命名为WK1,对其进行形态学观察以及生理生化鉴定,探索了菌株降解二氯喹啉酸的降解特性,并初步分析了二氯喹啉酸胁迫对菌体蛋白表达的影响,以期为二氯喹啉降在菌体内降解机制的研究提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 材料 土样采自河南省某农药厂土壤,采用5点取样法取样后带回,自然风干后去除杂物过筛(18目)。
1.1.2 仪器与试剂 SDD-26A 型高效液相色谱仪(日本岛津公司);DH-500A型电热恒温培养箱(上海申贤恒温设备厂);BS-IIFA型立式恒温摇床(常州市开元实验仪器有限公司);KIKRO-22R高速冷冻离心机(德国Hettick 公司);超净工作台(上海泸净有限公司);Axio光学显微镜(欧波有限公司)。二氯喹啉酸标准品(德国Dr.Ehrenstorfer公司,99.9%纯度);DNA提取试剂盒(北京天根生化科技有限公司);琼脂糖凝胶DNA回收试剂盒(TIANGEN公司)。其余试剂购自天津市科密欧化学试剂有限公司,分析纯。
1.1.3 培养基 无机盐培养基:K2HPO41.0 g·L-1、NaH2PO41.0 g·L-1、NH4NO3g·L-1、CaCl2·H2O 0.02 g·L-1、FeCl3·3H2O g·L-1、 MgSO4·7H2O 0.2 g·L-1;
LB培养基:NaCl 10.0 g·L-1、胰蛋白胨10.0 g·L-1、酵母浸粉5.0 g·L-1。
1.2 二氯喹啉酸降解菌分离与纯化
配制无机盐培养基,加入二氯喹啉酸,使质量浓度为100 mg·L-1。将1 g土壤样本添加于99 mL配置过的无机盐液体培养基内,放置在37 ℃,180 r·min-1的恒温摇床培养箱中7 d,然后取1 mL培养液转接于二氯喹啉酸质量浓度为200 mg·L-1的无机盐培养基内培养,持续7 d后,再取1 mL培养液转接于二氯喹啉酸质量浓度为500 mg·L-1的无机盐培养基内继续培养7 d,稀释接种在无机盐固体培养基上,37 ℃培养3 d后挑取单菌落,连续培养10代后,平板划线得到单菌落菌株。
1.3 菌株的鉴定
1.3.1 菌株的形态观察和生理生化鉴定 将菌株接种于固体LB培养基内,于35 ℃培养48 h,观察菌落形态。生理生化鉴定试验参照文献[15]。
1.3.2 菌株16S rRNA序列分析及系统发育树的构建 将培养好的菌株通过试剂盒提取细菌总DNA。以细菌总DNA做模板,进行PCR扩增,引物为细菌通用引物 (上游引物5′-AGAGTTTGATCCTGGCTCAG-3′/下游引物5′-TACCTTGTTACGACTT-3′)。扩增反应体系: DNA (80 ng·μL-1) 0.5 μL,Taq酶0.25 μL,dNTP(10 mmol·L-1) 1 μL,引物 (10 μmol·L-1)1 μL,10×Buffer 2.5 μL,补蒸馏水至50 μL。反应条件: 94 ℃ 10 min, 94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1.5 min,30个循环,最后72 ℃延伸10 min测序结果进行NCBI(https://blast.ncbi.nlm.nih.gov)比对,并构建16S rRNA系统发育树。
1.4 菌悬液的制备
在LB培养基中接种菌株WK1,在37 ℃、180 r·min-1的恒温摇床上培养至对数期,在离心机上5 000 r·min-1离心10 min收集菌体,以无菌水冲洗2次,重悬于培养基(OD600=1.0),用于测定。
1.5 降解菌降解二氯喹啉酸的性能测定
二氯喹啉酸测定参考胡杨等[16]的HPLC方法。配置二氯喹啉酸质量浓度为100 mg·L-1的无机培养基,以质量分数5%接种量接入菌株WK1(OD600=1.0),180 r·min-1恒温35 ℃培养,每12 h取样,测定OD600和二氯喹啉酸质量浓度。
1.6 降解条件对降解菌降解二氯喹啉酸的影响
1.6.1 接种量对降解菌降解二氯喹啉酸的影响 分别以质量分数2%、5%、8%和10%的接种量接种到二氯喹啉酸质量浓度为100 mg·L-1、pH值为7的无机盐培养基中,在180 r·min-1恒温37 ℃培养5 d,测定二氯喹啉酸的质量浓度。
1.6.2 二氯喹啉酸初始浓度对降解效果的影响 分别配置二氯喹啉酸质量浓度为50、100、150、200、250、300 mg·L-1的无机盐培养基,pH值为7,以质量分数5%的接种量在180 r·min-1恒温37 ℃培养5 d,测定二氯喹啉酸的质量浓度。
1.6.3 温度对降解效果的影响 以质量分数5%的接种量接种到100 mg·L-1、pH值为7的二氯喹啉酸无机盐培养基中,分别在25、30、35、40、45 ℃下,180 r·min-1恒温培养5 d,测定二氯喹啉酸的质量浓度。
1.6.4 pH值对降解二氯喹啉酸的影响 分别配置pH值为 4、5、6、7、8、9的100 mg·L-1二氯喹啉酸无机盐培养基,并以质量浓度为5%的接种量接种,在180 r·min-1恒温35 ℃培养5 d,测定二氯喹啉酸的质量浓度。
1.7 降解菌降解二氯喹啉酸的正交试验
在单因素试验的基础上,选取pH值(7、8、9)(A)、接种量质量分数(4%、5%、6%)(B)、二氯喹啉酸的初始质量浓度(90、100、110 mg·L-1)(C)和温度(30、35、40 ℃)(D)为因素,设计4因素3水平菌株降解二氯喹啉酸的正交试验,如表1所示。

表1 二氯喹啉酸降解正交试验设计Table 1 Orthogonal design of experiment of degradation of quinclorac
1.8 二氯喹啉酸胁迫对降解菌胞内外蛋白的影响
菌液的制备:配置二氯喹啉酸质量浓度为100 mg·L-1无机盐培养基作为处理组,葡萄糖质量浓度为100 mg·L-1无机盐培养基为对照组。以质量分数为5%的接种量接种降解菌,在180 r·min-1恒温35 ℃培养5 d。将培养结束的菌液以5 000 r·min-1离心20 min,收集菌体和上清液,用无菌水洗涤2次,重悬于离心管中备用(OD600=2.5)。
降解菌胞内外的蛋白提取:蛋白提取参考余功明等[17]TCA丙酮沉淀法。将提取过后的蛋白进行SDS-PADE电泳试验。电泳步骤按《蛋白质电泳实验技术》[18]所述方法进行,浓缩胶质量浓度5%,分离胶质量浓度12%,电泳结束后用考马斯亮兰R-250染色1 h,然后脱色,分析蛋白质的表达以及相对分子质量的大小。
2 结果与分析
2.1 二氯喹啉酸降解菌形态特征及生理生化特性
通过富集筛选的方法,得到 1株二氯喹啉酸降解菌,命名WK1。在培养基上培养2 d后,菌落边缘整齐,白色,光滑,接种环易挑起,易拉成丝,革兰氏染色阴性。能够水解淀粉,葡萄糖产酸,硝酸盐还原测试阳性,吲哚和甲基红试验为阴性。

图1 菌株WK1在LB培养基中菌落形态Fig.1 Colony morphology of strain WK1 in LB medium
2.2 菌株WK1系统发育鉴定
通过NCBI网站(http://www.ncbi.nlm.nih.gov)核酸序列比对,菌株WK1的16S rDNA序列和克雷伯氏菌(Klebsiella)DSM 30104菌株(GenBank Accession No.NR 11471.1)的相似度为99.9%。在系统发育树上聚类于同1个分支。基于基因序列和系统进化分析,将菌株WK1鉴定为克雷伯氏菌(Klebsiella)。
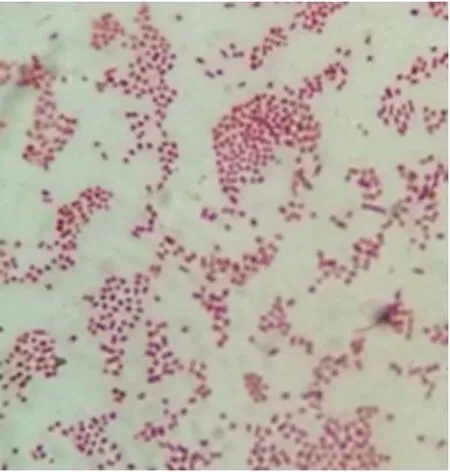
图2 菌株WK1革兰氏染色图 (×100)Fig.2 Gram staining figure of strain WK1(×100)
2.3 菌株WK1的生长曲线和对二氯喹啉酸的降解曲线
从图4可以看出,菌株WK1可以将二氯喹啉酸作为唯一碳源生长。菌株接种到培养基中,前期由于菌株处于延迟期,数量较低,二氯喹啉酸的质量浓度变化不大。当进入对数期之后,细菌数量增多,代谢旺盛,质量浓度下降快。当细菌处于稳定期后,二氯喹啉酸的质量浓度不再发生明显变化时,二氯喹啉酸降解率达到40.9%。
2.4 菌株WK1降解二氯喹啉酸影响因素分析
2.4.1 接种量对菌株WK1降解二氯喹啉酸的影响 从图5可以看出,二氯喹啉酸的降解率随着接种量的增加而增加。当接种量在质量分数为2%时,菌株经过5 d培养还处于对数期,细菌数量较少,
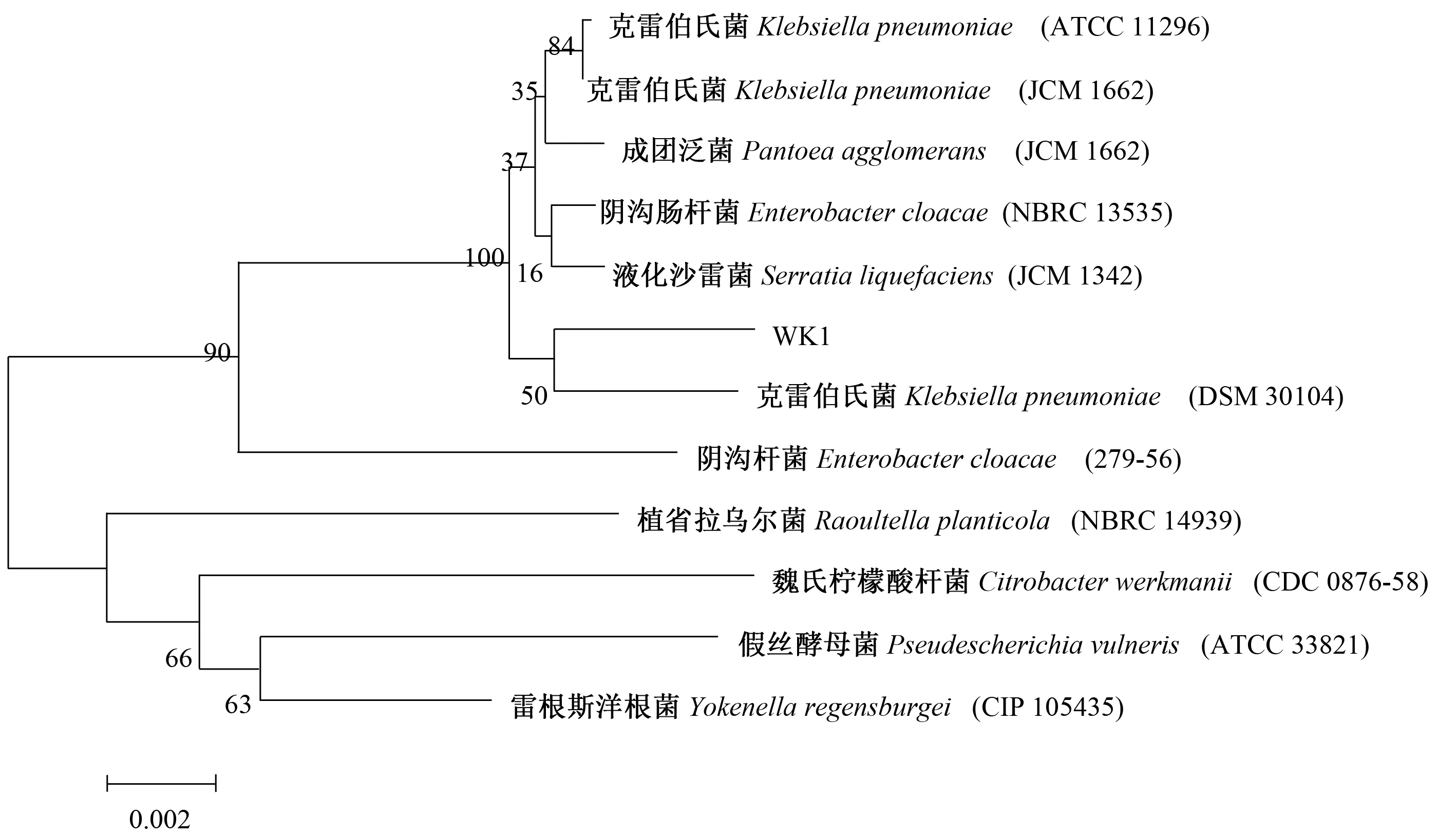
图3 菌株WK1的16S rDNA基因序列的系统发育树

图4 菌株WK1对二氯喹啉酸的降解和生长曲线
所以对二氯喹啉酸的降解也较小。当菌株接种量质量分数由5%增加到10%时,接种量的增加并没有明显增加二氯喹啉酸的降解率,这是因为经过5 d的培养,菌株都达到了平稳期,对二氯喹啉酸的降解率都在35%左右,所以选择质量分数5%作为试验的接种量。
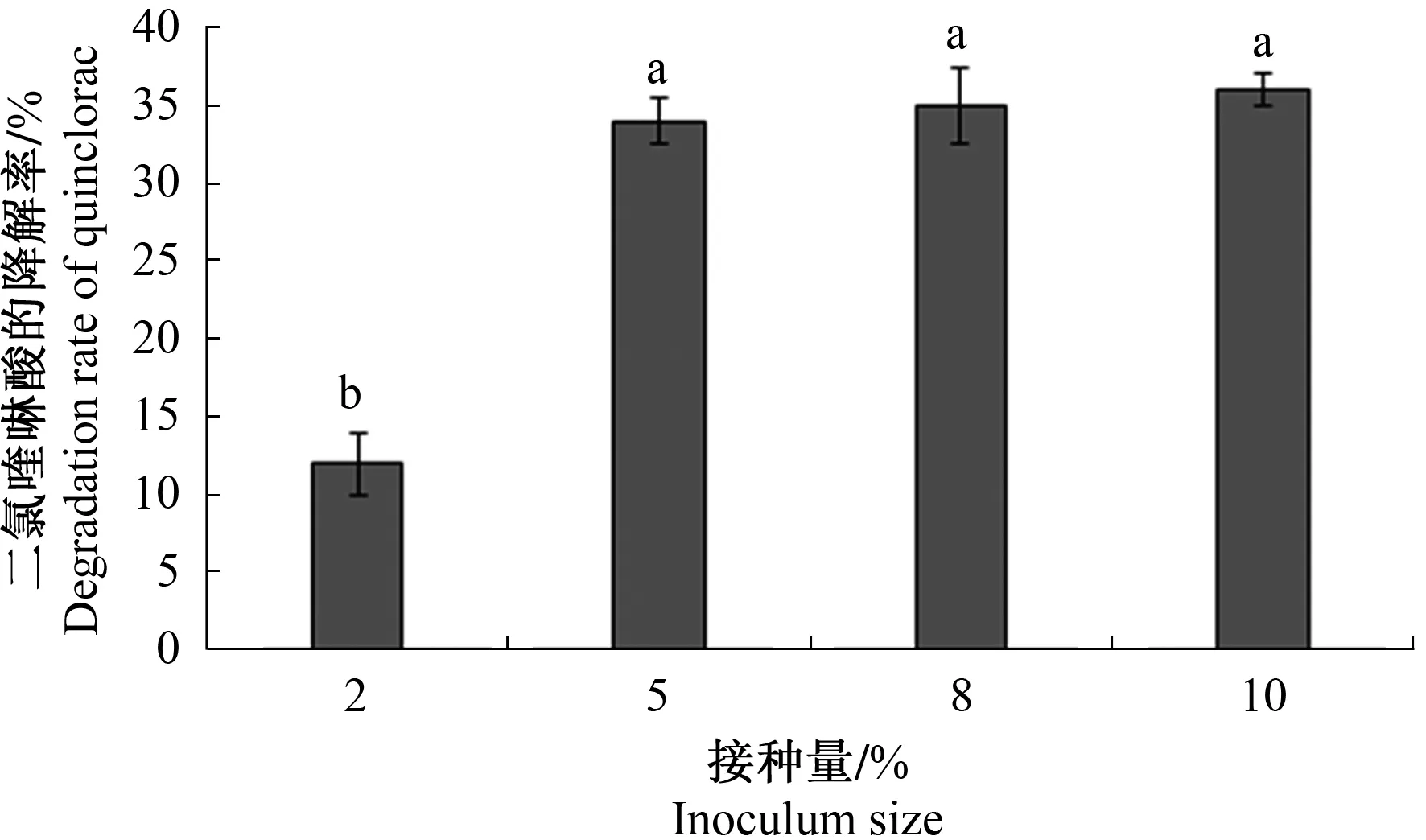
注:不同字母表示差异显著(P<0.05)。下同。Note: Different letters mean significant differences (P<0.05). The same as below. 图5 接种量对菌株WK1降解二氯喹啉酸的影响
2.4.2 二氯喹啉酸初始质量浓度对菌株WK1降解二氯喹啉酸的影响 从图6可以看出,克雷伯氏菌WK1在不同浓度中均能生长,说明该菌有良好的耐受性。二氯喹啉酸初始质量浓度为100 mg·L-1时,克雷伯氏菌WK1对二氯喹啉酸的降解效果最好,降解率为38.1%。当二氯喹啉酸质量浓度超过100 mg·L-1时,克雷伯氏菌WK1的降解率下降,推测是高质量浓度的二氯喹啉酸对克雷伯氏菌WK1产生毒害,影响了菌体生长代谢,从而导致二氯喹啉酸的降解率下降。

图6 二氯喹啉酸初始浓度对菌株WK1降解 二氯喹啉酸的影响
2.4.3 温度对菌株WK1降解二氯喹啉酸的影响 由图7可知,温度对克雷伯氏菌WK1降解二氯喹啉酸的影响相对较大,随着温度的升高,菌株对二氯喹啉酸的降解率增大。温度在35 ℃时,降解率最大,为38.7%;温度超过35 ℃后,菌株降解能力下降,随着温度增加降解率明显降低;温度为45 ℃时,降解率最低为18.9%。

图7 不同温度对菌株WK1降解二氯喹啉酸影响
2.4.4 pH值对菌株WK1降解二氯喹啉酸的影响 由图8可知,该菌可以在pH值为4~9的范围内降解二氯喹啉酸,克雷伯氏菌WK1对二氯喹啉酸的降解效果在pH值6~8之间较好。pH值为8时,二氯喹啉酸的降解率达到最大值,降解率为39.7%。pH的增大或减小都会影响菌株对二氯喹啉酸的降解,pH值为4时最差,降解率仅为10%,说明该菌适宜在中性或微碱性的环境中生长。

图8 初始pH值对菌株WK1降解二氯喹啉酸的影响Fig.8 Effects of initial pH value on degradation of quinclorac by strain WK1
2.5 菌株WK1降解二氯喹啉酸的正交试验
在单因素试验的基础上,通过正交试验确定菌WK1降解二氯喹啉酸的最佳条件。试验结果如表2所示。菌株WK1降解效果最好为第6组,即在pH值为8,接种量为6%,二氯喹啉酸初始质量浓度为90 mg·L-1,温度为35 ℃时对二氯喹啉酸的降解率为42%。通过表2中的极差R,可知影响菌株降解二氯喹啉酸的主要因素是pH值,其次是温度,然后是二氯喹啉酸的初始质量浓度和接种量。
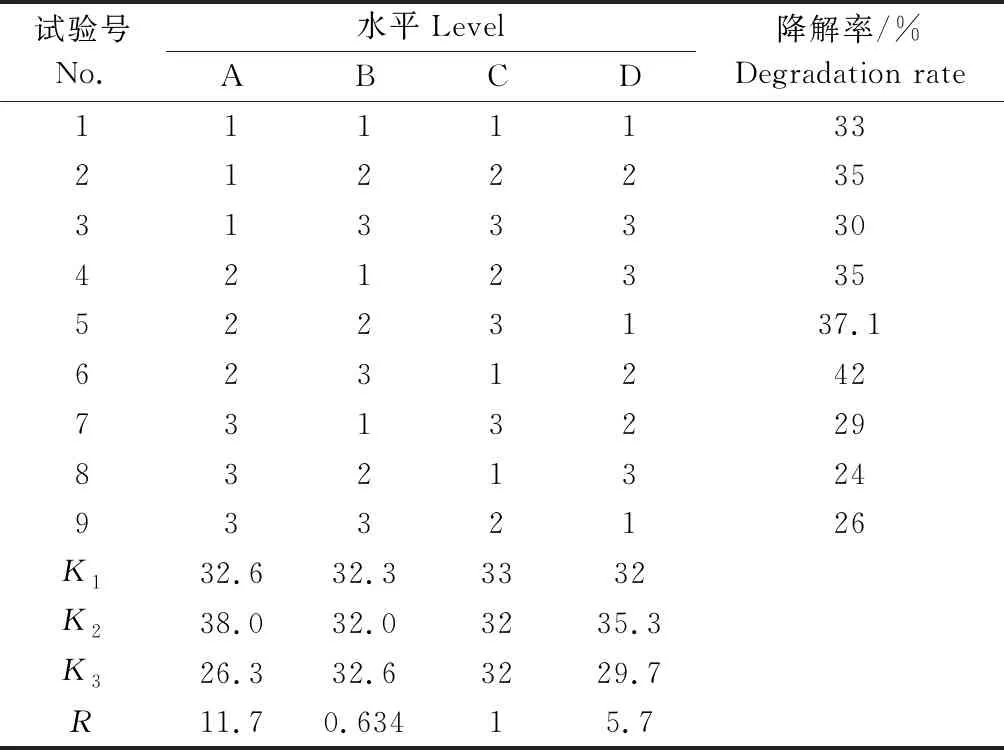
表2 正交试验结果
2.6 二氯喹啉酸胁迫对降解菌的影响
2.6.1 二氯喹啉酸胁迫对胞内蛋白的影响 图9是2种处理下的菌体胞内蛋白的SDS-PAGE图谱。菌株WK1受到二氯喹啉酸胁迫后蛋白表达出现了差异。对照组在大约20.0、30.0、45.0、56.0 kD的条带处,有大量的特异性蛋白表达。其中在30.0、56.0 kD处的条带最为明显。与处理组相比较,处理组在96.0、35.1、25.0 kD的条带处,蛋白条带减少,说明菌体蛋白表达受到抑制。

注:1,Mark; 2、3、4,对照组;5、6、7处理组。Note: 1, Mark; 2, 3 and 4, control groups; 5, 6 and 7, treatment groups. 图9 菌体胞内蛋白的SDS-PAGE图谱Fig.9 SDS-PAGE map of intracellular protein
2.6.2 二氯喹啉酸胁迫对胞外蛋白的影响 图10为克雷伯氏菌WK1在2种处理下的胞外蛋白SDS-PAGE图谱。克雷伯氏菌WK1在受到二氯喹啉酸的胁迫下胞外分泌蛋白出现了差异。处理组在31.0 kD的条带处,有大量特异性蛋白表达,这和胞内蛋白表达增加的大小相接近。对照组14.5、35.0 kD的条带出,蛋白条带减少,说明菌体减少了在胞外蛋白的表达和分泌。
3 结论与讨论
本研究在农药厂污泥中分离得到降解菌,经过形态学观察、生理生化测试,以及16S rDNA同源性分析,鉴定菌株WK1为克雷伯氏菌属(Klebsiella)。克雷伯氏菌是广泛分布于空气,水,土壤和人的肠道以及呼吸道中的革兰氏阴性菌。研究发现,该菌群具有多种特殊功能,除了能引起人和家畜的肺炎外,还可以治理水体中的铬污染。徐淑霞等[19]分离发现了1株高效还原Cr(Ⅵ)的菌株,鉴定为克雷伯氏菌属(Klebsiella),该菌对质量浓度为70 mg·L-1的Cr(Ⅵ)离子的还原率可达92%。

注:1,Mark;2、3,对照组;4、5,处理组。
本研究表明菌株WK1能以二氯喹啉酸为碳源生长,对二氯喹啉酸有较高的耐受性。通过正交试验优化了菌株降解二氯喹啉酸的条件,在pH 值为8、菌株接种量为6%、温度为35 ℃条件下,对初始质量浓度为90 mg·L-1二氯喹啉酸的降解率最大为42%。降解菌对二氯喹啉酸的降解效率与多种因素有关,包括二氯喹啉酸初始质量浓度、接种菌量、降解条件以及菌株自身降解能力。张顺等[12]报道1株节杆属菌株MC-10对初始质量浓度为20 mg·L-1二氯喹啉酸的降解率在90%以上。周挺等[14]报道1株寡养单胞菌J03对初始质量浓度在5 mg·L-1二氯喹啉酸的降解率为33.5%。此类菌株在降解过程中二氯喹啉酸初始质量浓度较低,而本研究中菌株WK1可以在二氯喹啉酸初始质量浓度较高的环境中对二氯喹啉酸进行降解,适用于较为极端的条件,实用性更强。土壤的酸碱度能够影响二氯喹啉酸的降解,二氯喹啉酸在酸性土壤中比较稳定,解离度小,不容易被降解,在碱性土壤中解离度大,容易被降解[20]。菌株WK1在pH为8时降解率最高,对二氯喹啉酸的降解率在弱碱性条件比酸性条件高,这与董俊宇[9]等发现的降解菌J3在弱酸性和中性条件下有较高的降解率有所不同。土壤的酸碱度会影响微生物的影响代谢,所以菌株WK1适合处理中性或弱碱性土壤中的二氯喹啉酸残留问题。
目前,关于二氯喹啉酸降解菌的研究大多集中在其降解特性上,对于其降解机制的研究较少。李子木等[21]研究发现邻苯二甲酸双加氧酶是和氯化邻苯二酚1,2-双加氧酶在二氯喹啉酸降解发挥关键作用。通过在SDS-PAGE检测了在二氯喹啉酸的胁迫下菌体蛋白的表达,发现蛋白表达出现了明显的差异。这可能与菌体缓解迫害有关,也有可能与二氯喹啉酸的降解有关。56.0 kD条带和邻苯二甲酸双加氧酶相对分子质量大小相吻合,该条带的具体蛋白需要进一步确定。超氧化物歧化酶和过氧化氢酶是生物清除活性氧的重要组成部分,可以使细胞降低活性氧的伤害,不同微生物缓解活性氧的机制是不相同[22]。菌体在受到二氯喹啉酸胁迫蛋白表达差异出现在30.0 kD左右,而超氧化物歧化酶相对分子质量大小也在30.0 kD,这可能是菌株在受到二氯喹啉酸迫害的缓解方式。

