黄芩苷对大鼠压疮模型的干预作用及机制
安辉,应秀东,方晶,梁春光
(锦州医科大学附属第一医院,辽宁 锦州 121000)
压疮(pressure ulcer,PU)是由于机体突出部位组织受到持续性压力导致局部组织长期持续血流障碍,致使组织发生缺血、缺氧性溃烂坏死,现已成为长期卧床或瘫痪患者常见并发症[1]。压疮一旦发生,病程常迁延,并伴多种并发症出现,甚至引发严重的继发感染而导致患者死亡[2]。目前,压疮的临床治疗多采用西医的局部换药法,效果不理想,特别对于重症压疮患者,单纯换西药对创面的愈合效果不佳。促进创面局部血管重建及粘膜再生,改善创面微循环,提高抗感染能力是压疮治疗的重要因素。
研究表明多酚具有抗炎、免疫调节、抗微生物、抗氧化和抗癌等多种生物学活性,尤其在预防和治疗炎症性疾病中具有广泛的应用前景[3]。多酚来源于植物,有8000多种,以糖苷酯或游离糖苷的形式存在[4]。中药成分黄芩苷属于多酚家族中的一员,是从黄芩干燥根中提取出来的黄酮类活性成分,具有抗炎,抗氧化和抗过敏特性[5]。黄芩苷在体外和体内均能抑制Th17细胞分化,调节Th17和Treg细胞之间平衡,可能是治疗Th17细胞介导的炎性疾病的治疗剂。课题组前期结果显示Th17细胞及相关细胞因子参与压疮损伤过程[6],拮抗Th17细胞的治疗方案成为压疮治疗的新思路。本研究通过观察黄芩苷对压疮大鼠模型的干预效果,进一步探讨其对Th17/Treg细胞亚群失衡的调节作用。
1 材料和方法
1.1 实验动物
清洁级SD大鼠40只、雄性、12~14 w、体质量(200±20) g,购自北京维通利华公司。饲养温度20~25 ℃,湿度40%~70%,采用标准饲料进行饲养,饲料及垫料购自北京维通利华公司。
1.2 主要试剂
黄芩苷(纯度> 98%)购自北京生物制品研究所(批号201811126);贝复济购自珠海亿胜生物制药有限公司(批号20180427)HE染色试剂购自北京中杉金桥生物技术有限公司(批号20190128);RNA提取及SYBRRT-PCR试剂盒购自德国Qiagen公司(Cat No 52904);RORγt、Foxp3、IL-17及β-actin单克隆抗体购自美国Abcam公司(Cat No ab11177,ab215206,ab79056,ab8226);FITC-CD4、Percp-IL-17、Percp-CD25及BV421-Foxp3购自美国BD公司(Cat No 340043、565866、551071、562996);细胞破膜剂/缓冲液购自美国BD公司(Cat No 554715):Brefeldin A购自美国BD公司(Cat No 555029)。TUNEL试剂盒、蛋白marker、loading buffer、SDS-PAGE凝胶制备试剂盒和BCA蛋白定量试剂盒均购自北京索莱宝科技有限公司(批号20180216、20190308、20181229、20190425、20180923);圆形金属磁盘(直径25 mm,厚3 mm)、圆环形铁盘(内径8 mm,外径25 mm,厚1 mm)由锦州医科大学附属第一医院科研中心提供。
1.3 建立大鼠压疮模型
SD大鼠适应性喂养1 w后,随机将大鼠分为模型对照组(A组)、黄芩苷预防性用药组(B组)、黄芩苷治疗性用药(C组)和阳性对照组(D组),每组10只。B组于压疮造模前给予预防性给药,黄芩苷(100 mg/kg)腹腔注射,每天两次,连续14 d。造模前4组大鼠禁食8 h,给予10%水合氯醛麻醉(0.3 mL/100 g),沿背部正中线备皮,纵向切口深至筋膜,用镊子钝性分离,将圆环形铁盘植入大鼠背部皮下组织,缝合筋膜和皮肤层。体外用圆形金属磁盘吸引体内铁盘产生持续压力,使大鼠皮肤局部缺血。缺血2 h后,取下体外磁盘,使血液恢复灌注30 min,此为1个实验周期,每天做5个周期,连续3 d后取出体内铁盘。腹腔给予葡萄糖-盐水溶液(2.5 h/3 mL)确保体内水和电解质平衡。模型构建成功后,各组压疮大鼠给予不同的处理,在处理前均给予生理盐水清创和碘伏消毒。A组:腹腔注射等体积PBS,每天两次,连续14 d;B组:无需处理;C组:黄芩苷(100 mg/kg)腹腔注射,每天两次,连续14 d。D组:创面均匀喷洒贝复济,再以无菌纱布包扎。4组每天换无菌纱布1次,并观察溃疡面局部愈合情况。连续治疗14 d后取材检测指标。其中6只大鼠在实验过程中死亡:A组在造模后第3、4天因伤口感染死亡3只、B组在造模后第4天死亡2只,C组在造模后第3天死亡1只。
1.4 局部变化
创面红肿、水泡、渗出、溃疡和坏死五项分4个等级分数。0分:无变化,用“-”表示;1分:轻度变化,用“+”表示;2分:中度变化,用“++”表示;3分:重度变化,用“+++”表示。
1.5 标本采集
大鼠创面处取材,用于HE、TUNEL、组化染色(4%多聚甲醛,4 ℃)、qPCR(-80 ℃)Western blot(-80 ℃);开腹腔取脾脏,放入含预冷PBS平皿中备用,后进行流式细胞术检测。
1.6 HE染色
大鼠创面皮肤及皮下肌肉分别用4%多聚甲醛固定,石蜡包埋,做连续切片,常规HE染色后封片并镜检。
1.7 TUNEL染色
石蜡切片脱蜡至水;修复:蛋白酶K覆盖组织,37 ℃ 25 min,洗涤3次,每次5 min;破膜:滴加破膜工作液,常温20 min,洗涤3次,每次5 min;加试剂TdT和dUTP混合液:按1∶9混合,覆盖组织,37 ℃ 2 h;BSA封闭;加一抗,湿盒内4 ℃过夜;加二抗,避光室温50 min;DAPI复染细胞核;封片;ipwin32分析结果。
1.8 qPCR检测EGF、VEGF、IL-17、IL-6、TGF-β和IL-10mRNA水平
创面组织用Qiagen匀浆器均质,4 ℃ 12 000rpm离心15 min,取上清200 μL提取总RNA后进行一步法qPCR检测。反应条件:42 ℃ 5 min,95 ℃ 15 s;95 ℃ 15 s,50 ℃ 60 s 40个循环;72 ℃绘制熔解曲线。2-ΔΔCT计算mRNA相对表达量,见表1。

表1 引物序列
1.9 Western blot检测
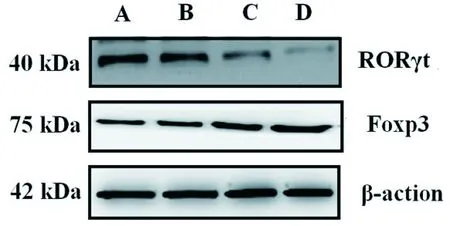
RORγt和Foxp3蛋白表达创面组织匀浆后加入裂解液,12 000 rpm离心,BCA蛋白定量后进行SDS-PAGE电泳。加入10 μL样品,80 V电泳20 min后,调电压至110 V,继续电泳20~30 min。120 mA 2 h转膜,5%BSA室温封闭1 h。加一抗稀释液RORγt(1∶1000)/ Foxp3(1∶1500)/β-actin(1∶2000),4 ℃摇床过夜。TBST洗涤,加1∶10 000稀释的羊抗兔IgG二抗,室温孵育1 h。电化学ECL发光,ImageJ分析条带。
1.10 FCM检测Th17和Treg细胞
研磨脾脏,用预冷PBS重悬脾细胞并用200目尼龙筛网过滤至离心管中,离心弃上清,加入红细胞裂解液1 mL,5 min后用10 mL PBS终止,离心弃上清,调整细胞密度至1×106/mL,分装于EP管中1毫升/管。加1640培养基1毫升/管,离心后弃上清,每管加1640培养基200 μL,PMA 2 μL和Ionomycin 2 μL,混匀后培养箱(37 ℃,5% CO2)培养1 h,加BFA 1微升/管,继续培养4 h,PBS洗涤后离心。Th17细胞染色:加FITC- CD4 1微升/管,4 ℃ 30 min,PBS洗涤,离心后弃上清,加破膜液100微升/管,4 ℃ 30 min;Perm wash buffer洗涤,离心后弃上清,加Percp-IL-172微升/管,4 ℃ 30 min。Treg细胞染色:加FITC- CD4和Percp-CD25 1微升/管,4 ℃ 30 min,PBS洗涤,离心后弃上清,加破膜液100微升/管,4 ℃ 30 min;Perm wash buffer洗涤,离心后弃上清,加BV421-Foxp3 2微升/管,4 ℃ 30 min。两种细胞染色后均用Perm wash buffer洗涤,离心后弃上清,buffer重悬细胞,用300目尼龙筛网过滤细胞悬液,流式细胞仪检测。
1.11 统计学方法
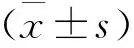
2 结 果
2.1 创面情况评分
对大鼠创面五种情况评分进行方差分析,组间差异均具有统计学意义。与模型对照组相比,黄芩苷预防和治疗性用药组创面红肿、水泡、渗出、溃疡和坏死情况有不同程度的好转(P<0.05);阳性对照组创面红肿、水泡、渗出、溃疡和坏死评分较比模型对照组明显降低,差异有统计学意义(P<0.01),见表2。
2.2 HE染色结果
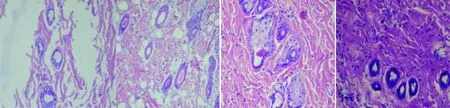
模型对照组鳞状上皮层次不清,毛囊数量减少且结构模糊,皮下组织炎性细胞浸润明显;肌纤维排列紊乱且断裂明显,肌横纹不清晰,间质变宽,大量炎症细胞浸润。黄芩苷预防性和治疗性用药组毛囊结构较清晰,皮下组织有部分炎性细胞浸润;黄芩苷预防性用药组较治疗性用药组肌纤维增生及炎性细胞浸润情况明显,有少量肌纤维断裂。阳性对照组真皮层内毛囊数量多且清晰,少量炎性细胞浸润;肌纤维紧密排列,横纹较清晰,见图1、图2。

表2 大鼠创面情况评分
ABCD
ABCD
2.3 TUNEL法检测创面细胞凋亡
与模型对照组比较,黄芩苷预防性、治疗性用药组和阳性对照组创面细胞凋亡荧光强度明显降低(P<0.01)。且黄芩苷治疗性用药组下降的幅度高于预防性用药组,见表3、图3、图4。

ABCD
A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组
图3 大鼠压疮组织TUNEL染色(200倍)

表3 大鼠压疮组织TUNEL荧光强度值
2.4 EGF、VEGF、IL-17、IL-6、TGF-β和IL-10 mRNA水平
黄芩苷预防性、治疗性用药组创面组织EGF、VEGF、TGF-β和IL-10 mRNA水平较比模型对照组有不同程度的升高(P<0.05),而阳性对照组各因子明显高于模型对照组(P<0.01)。与模型对照组比较,黄芩苷预防性、治疗性用药组IL-17和IL-6水平有降低趋势(P<0.05),阳性对照组水平显著降低(P<0.01)。黄芩苷治疗性用药组各因子变化幅度均高于黄芩苷预防性用药组(P<0.05),见表4、图5。

A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组;B与A组比较,a代表P<0.01;C与A组比较,b代表P<0.01;D组与A组比较,c代表P<0.01;B与C组比较,d代表P<0.05
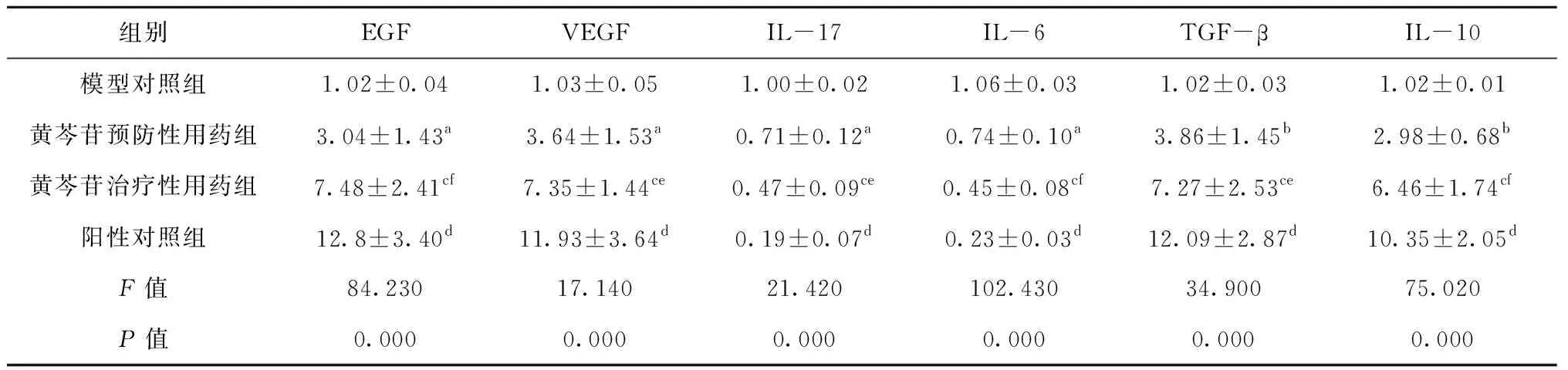
表4 创面组织EGF、VEGF、IL-17、IL-6、TGF-β和IL-10 mRNA相对表达量

A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组;B与A组比较,a代表P<0.05,b代表P<0.01;C与A组比较,c代表P<0.01;D组与A组比较,d代表P<0.01;B与C组比较,e代表P<0.05,f代表P<0.01
2.5 RORγt及Foxp3蛋白表达
与模型对照组比较,黄芩苷预防性、治疗性用药组RORγt蛋白表达呈降低趋势(P<0.05),阳性对照组显著降低(P<0.01)。黄芩苷预防性、治疗性用药和阳性对照组Foxp3蛋白表达较比模型对照组有小幅增加(P>0.05),见表5、图6、图7。
A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组
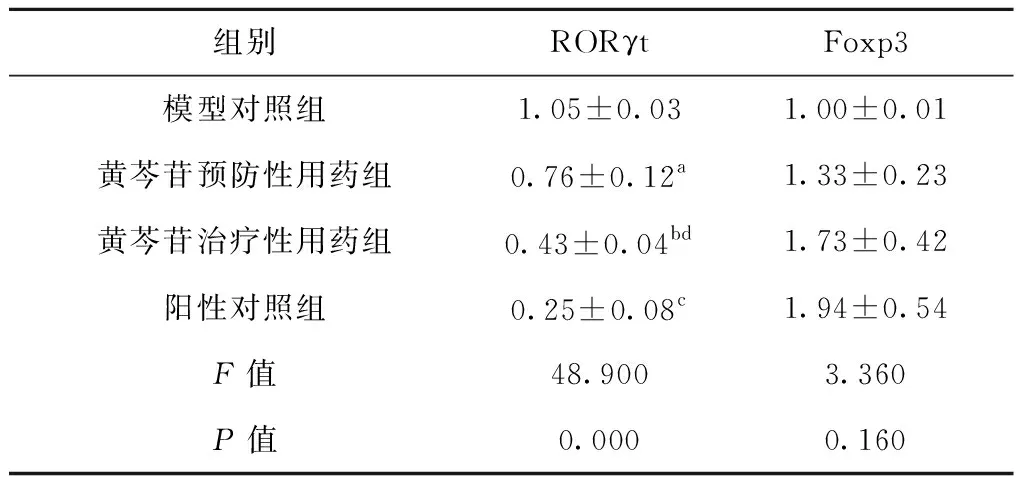
表5 RORγt及Foxp3蛋白相对表达
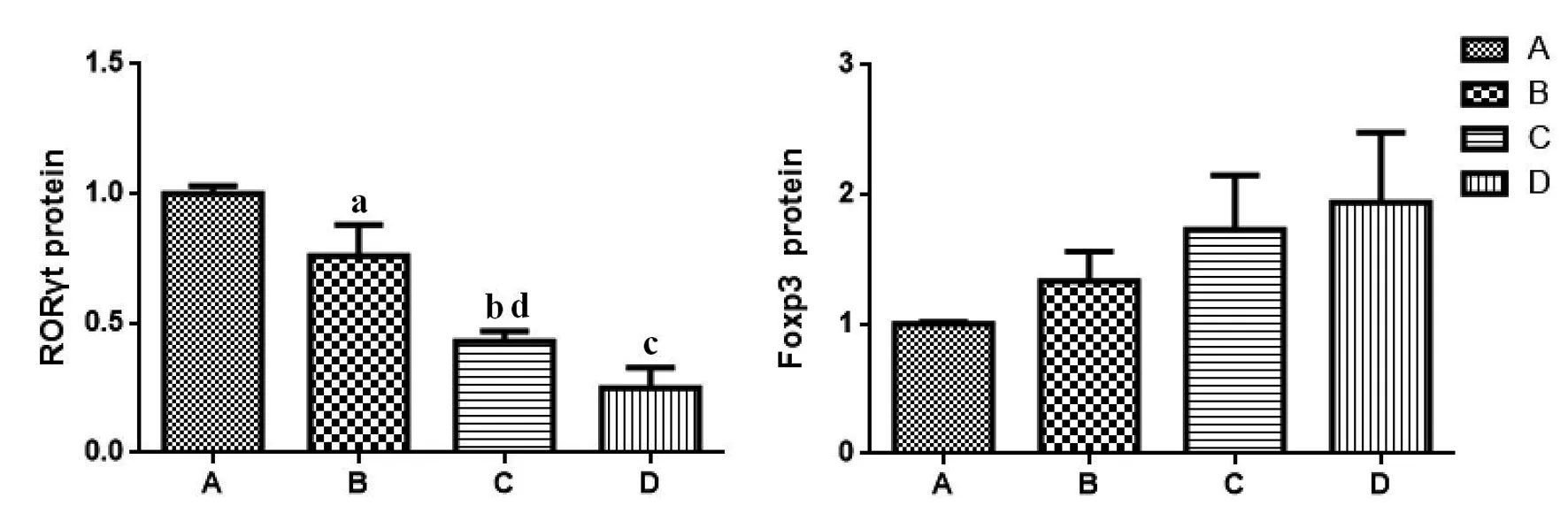
A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组;B与A组比较,a代表P<0.05;C与A组比较,b代表P<0.01;D组与A组比较,c代表P<0.01;B与C组比较,d代表P<0.01
2.6 Th17和Treg细胞比例
与模型对照组比较,黄芩苷预防性、治疗性用药组和阳性对照组脾脏Th17细胞比例呈下降趋势(P<0.01),Treg细胞比例有小幅上升(P>0.05),黄芩苷治疗性用药组Th17比例降低幅度高于预防用药组(P<0.05),见表6、图8、图9。

表6 大鼠脾脏Th17和Treg细胞比例

图8 大鼠脾脏Th17和Treg细胞流式图

A:模型对照组;B:黄芩苷预防性用药组;C:黄芩苷治疗性用药组;D:阳性对照组;B与A组比较,a代表P<0.05;C与A组比较,b代表P<0.01;D组与A组比较,c代表P<0.01;B与C组比较,d代表P<0.05
3 讨 论
CD4+T淋巴细胞是介导机体适应性免疫应答的关键细胞,初始CD4+T在不同的细胞因子刺激下分化为辅助性T细胞1(T helper cells,Th)、Th2细胞、Th17细胞、调节性T细胞(regulatory T cells,Treg)和辅助性滤泡T细胞(Follicular T helper cells,Tfh)[7]。CD4+T细胞各亚群具有不同的免疫学功能,其中Th17细胞为“促炎性细胞”,主要诱导炎症反应发生,而Treg细胞为“抑炎细胞”,负向调节免疫功能,主要介导免疫耐受[8]。二者相互拮抗、彼此制约,维持Th17/Treg细胞亚群平衡有利于机体处于稳定状态。一旦失衡会导致多种疾病的发生,如自身免疫性疾病、慢性炎性感染、哮喘和恶性肿瘤[9-10]。本课题前期实验发现Th17细胞及相关细胞因子参与压疮损伤,CD4+T细胞向Th17细胞分化,介导炎症损伤[6]1857-1861。在此基础上,本研究通过观察黄芩苷对压疮大鼠模型的干预效果,进一步探讨其对Th17/Treg细胞亚群失衡的调节作用。
本实验结果显示黄芩苷预防性和治疗性用药均能有效改善压疮创面渗出、水泡、红肿和溃疡等情况,一定程度上修复毛囊结构,减少皮下组织炎性细胞浸润,促进肌纤维再生,使肌纤维排列较紧密。给予黄芩苷治疗2 w后创面表皮生长因子(EGF)和血管内皮生长因子(VEGF)水平较比模型组明显增加。EGF和VEGF 是表皮和血管内皮细胞特异性多功能细胞因子,促进表皮及血管内皮细胞增殖再生和基质细胞生长[11-12]。由此可见,黄芩苷通过促进EGF和VEGF表达,改善创面微血管环境,加强表皮、内皮细胞及纤维组织再生,诱导创面愈合。
黄芩苷不同时间点用药均能降低压疮局部IL-17和IL-6mRNA水平,并提高TGF-β和IL-10水平。IL-6是诱导Th17细胞分化的关键细胞因子,分化后并产生特异性IL-17,但Th17细胞可被高浓度TGF-β抑制;高水平TGF-β促进Treg分化,并产生抑制因子IL-10[13]。可见,黄芩苷抑制初始CD4+T细胞向“促炎性细胞”Th17细胞分化,促进其向“抑炎细胞”Treg分化,进而减少压疮局部的炎症损伤。为了进一步证实此观点,对影响Th17和Treg细胞分化的重要转录因子RORγt及Foxp3进行检测,结果发现黄芩苷降低RORγt蛋白表达,并同时小幅增加Foxp3表达,提示黄芩苷下调RORγt以抑制Th17细胞分化,减少炎症因子IL-6和IL-17的分泌,同时小幅上调Foxp3表达以促进Treg细胞分化,有利于Th17/Treg恢复平衡状态。流式细胞术结果显示,黄芩苷降低大鼠脾脏Th17细胞比例,进一步证实细胞因子和转录因子结果,提示Th17/Treg亚群平衡在压疮模型中发挥重要作用,压疮引起Th17细胞介导创面炎症损伤,抑制Treg细胞发挥负向免疫调节作用,限制Treg对Th17介导的过度免疫应答。黄芩苷作为多酚类活性介质,具有免疫调节作用,通过诱导Th17细胞和Treg细胞分化的关键细胞因子和转录因子,调节Th17细胞和Treg细胞比例,诱导Th17/Treg细胞亚群恢复平衡。Sun F等[14]报道黄芩苷能抑制小鼠Th17细胞分化,减轻小鼠胶原诱导的关节炎。黄芩苷可通过活化芳基烃受体来调节Treg/Th17平衡改善实验性自身免疫性葡萄膜炎[15]。本研究结果显示黄芩苷治疗性用药的干预效果要高于预防性用药,提示黄芩苷对于慢性炎症性疾病更适合于作为治疗性药物或佐剂而应用。
压疮模型中适应性免疫细胞CD4+T细胞倾向向Th17细胞亚群分化,Th17/Treg细胞比例失衡,导致压疮创面的持续性炎症反应,而多酚类黄芩苷应用后促进机体Th17/Treg细胞恢复平衡,控制过度炎症损伤,这为临床压疮治疗提供基础数据,并为新型生物制剂的研制提供新思路。

