脑内皮及海马区阿尔茨海默病相关基因筛选
崔凯,赵斯奇,李欣,葛晓燕
(锦州医科大学公共卫生学院,辽宁 锦州 121000)
阿尔茨海默病(alzheimer’s disease,AD)是最常见的神经退行性疾病,约占痴呆患者的70%,也是老年人常见的致死性疾病之一[1]。AD的特征是由细胞外β淀粉肽形成斑块、细胞内神经纤维缠结、微管蛋白及突触和神经元的丢失引起的快速进展性认知功能及行为障碍,伴有大脑记忆区结构及功能改变[2]。患者出现生理功能紊乱伴随记忆丧失、认知功能受损、言语异常和其他身体症状。随着全球人口老龄化加剧,AD对患者及其家庭乃至整个社会造成了巨大威胁[3]。AD患者不仅在发达国家数量庞大[4],据报道,我国大陆地区AD的患病率也达到2.44%(95%CI:2.06~2.89%)[5]。AD的发病机制复杂,与遗传因素、环境因素、免疫因素、脑部外伤、抑郁和高血压等均有关,目前尚无治愈该病的方法,因此仍需探索新的相关基因和治疗靶点。
生物信息学是应用统计学和信息学方法与技术对生物数据进行处理和分析,从中挖掘潜在的生物信息。其利用高通量基因芯片对基因表达数据进行系统分析,进而揭示复杂的生物学过程和疾病机制,从而为疾病的临床治疗提供相应的线索和依据。自2000年,美国国立生物技术信息中心(NCBI)发布了基因表达谱库(GEO),储存大量的高通量生物芯片数据,以便于对表达数据进行检索和分析,为生物信息学研究提供数据来源。本研究即采用生物信息学方法,从GEO数据库获取AD患者和对照的脑内皮(entorhinal cortex,EC)和海马组织(hippocampus,HIP)基因表达数据集,利用GEO2R在线工具对共同差异表达基因(DEGs)进行筛选,并进行基因本体(GO)分析、KEGG通路富集分析和蛋白-蛋白相互作用(PPI)网络分析,以期发现与AD发病的相关基因。本研究可为了解AD的发病机制提供线索,有助于发现AD新生物标志物和治疗靶点。
1 资料和方法
1.1 资料来源
基因表达数据集从GOE数据库(https://www.NCBI.nlm.nih.gov/GEO/)中检索获取。纳入数据集的标准如下:(1)数据集为基因芯片表达数据;(2)样本来自与确诊的AD患者和非痴呆对照组的脑组织;(3)数据集中病例和对照组的可用样本数均≥10个。最终纳入GSE5281和GSE48350两个基因芯片数据集,均基于GPL570平台,采用美国Affymetrix公司Human Genome U133 Plus 2.0 Array阵列芯片检测。选取两个数据集中EC和HIP区的表达数据进行分析。
1.2 方法
采用GEO2R在线工具(https://www.ncbi.nlm.nih.gov/geo/GEO2R/)对DEGs进行筛选。筛选条件为P<0.05,其中log2FC≥1.0为表达上调,log2FC≤-1.0为下调(FC表示AD病例组受试芯片荧光信号强度与对照组的差异倍数),筛选两个数据集共同的DEGs。采用DAVID6.7生物信息学资源数据库(https://david.ncifcrf.gov)进行GO分析和KEGG通路富集分析,以P<0.05为显著富集。其中,GO分析用于描述及注释基因功能,其将基因功能分为生物过程、细胞组分和分子功能三部分,可用于发现疾病形成及进展的重要生物学过程;KEGG分析依据分子水平的生物系统和基因组功能信息资源分析基因相关代谢途径。利用STRING数据库(https://STRING-db.org/)构建DEGs的PPI网络,以评估功能基因组数据,进而分析基因产物蛋白的相互作用及其影响的主要生物学功能。利用Cytoscape 3.7.2软件对PPI网络进行可视化,选取节点度值最大的前10个相关基因。
2 结 果
2.1 DEGs的筛选结果
共收集25例AD患者和52例对照的EC,29例AD患者和56例对照的HIP组织表达数据。EC中,GSE5281和GSE48350数据集中共有62个DEGs,包括33个上调基因和29个下调基因;HIP中有91个DEGs,其中上调基因20个,下调基因71个,见表1。
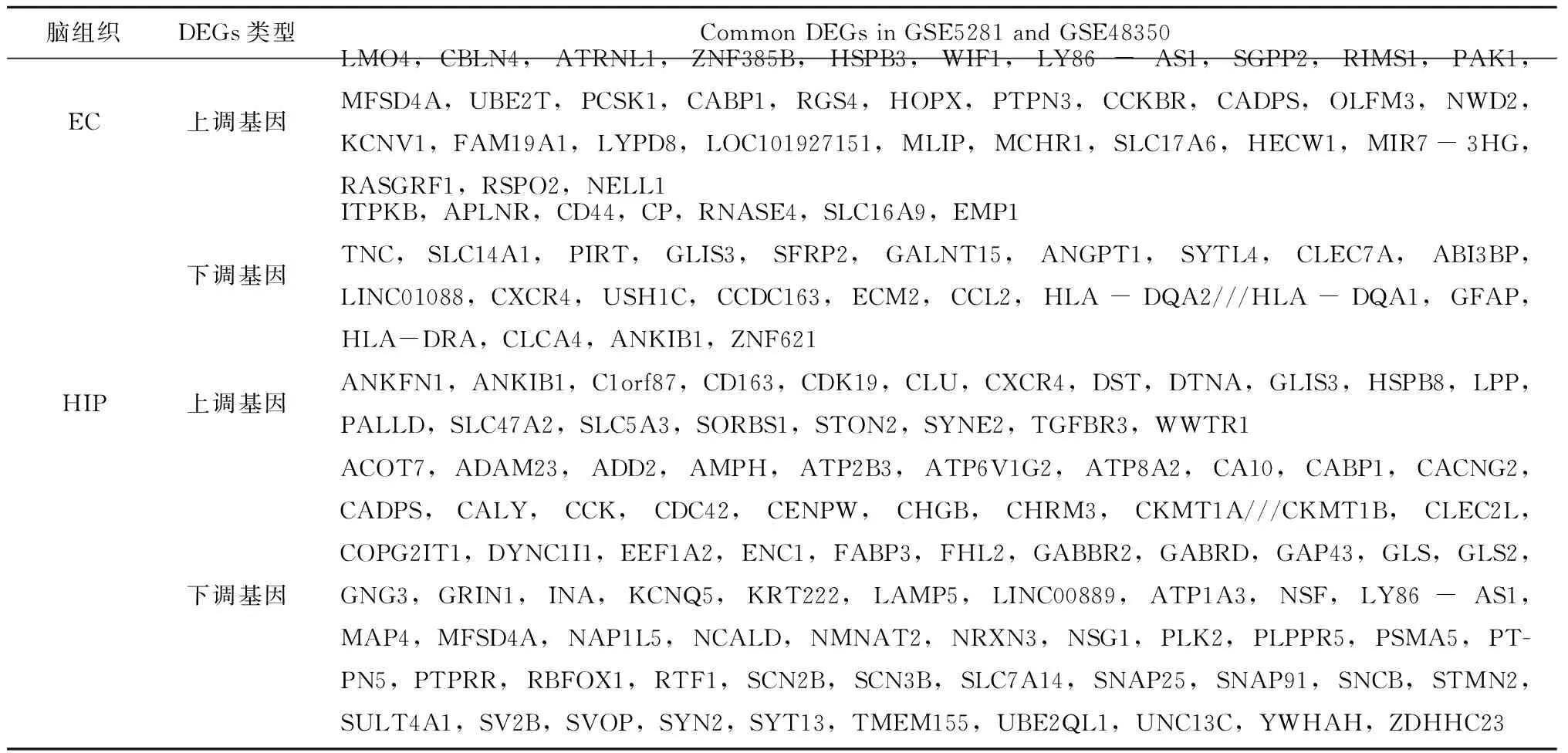
表1 EC和HIP组织中的DEGs结果
2.2 DEGs的GO分析和KEGG通路富集分析结果
在EC组织中,上调的DEGs主要涉及细胞外分泌、突触囊泡胞外分泌等生物学过程和细胞连接成分;下调的DEGs涉及细胞外基质、创伤反应等生物学功能,分布于细胞膜、细胞外隙、溶酶体等细胞组分,涉及整合素及肝素结合等分子功能。在HIP区,GO分析发现上调DEGs并未明显富集;而下调DEGs主要涉及化学突触传递、神经系统发育等生物学过程,分布于胞膜、突触等细胞组分,涉及蛋白质和蛋白激酶结合等分子功能。
KEGG通路分析显示,EC和HIP组织中的上调DEGs均未显著富集,而下调的DEGs基因显著富集于γ氨基丁酸突触、谷氨酸突触、类风湿性关节炎、突触囊泡循环、D-谷氨酰胺和D-谷氨酸代谢等通路,见表2。
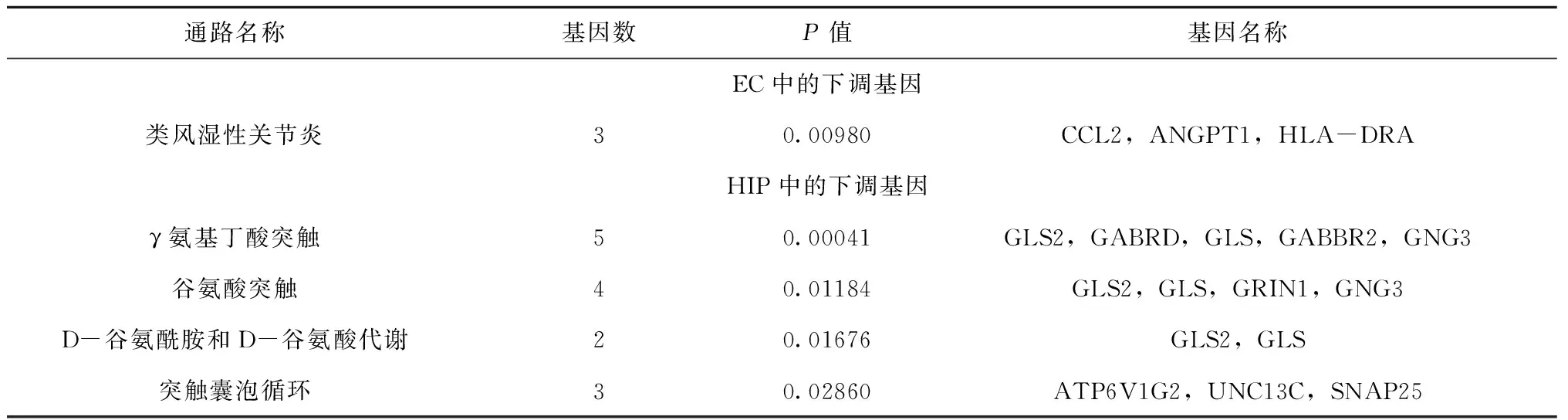
表2 KEGG分析中富集的途径
2.3 DEGs编码蛋白PPI网络分析结果
对于EC组织,PPI网络中包含56个节点和33条边,其中节点表示蛋白,边表示蛋白之间的相互联系,见图1。前10个高度相关的相关基因包括CXCR4、CCL2、GFAP、CD44、ANGPT1、MCHR1、ITPKB、aAPLNR、WIF1和ANG。在HIP中,有85个节点和163条边,见图2。前10位高度相关基因为SNAP25、SNCB、GRIN1、ATP2B3、SNAP91、CA10、RBFOX1,SYN2、CCK和GABRD。

图1 EC中DEGs的PPI网络
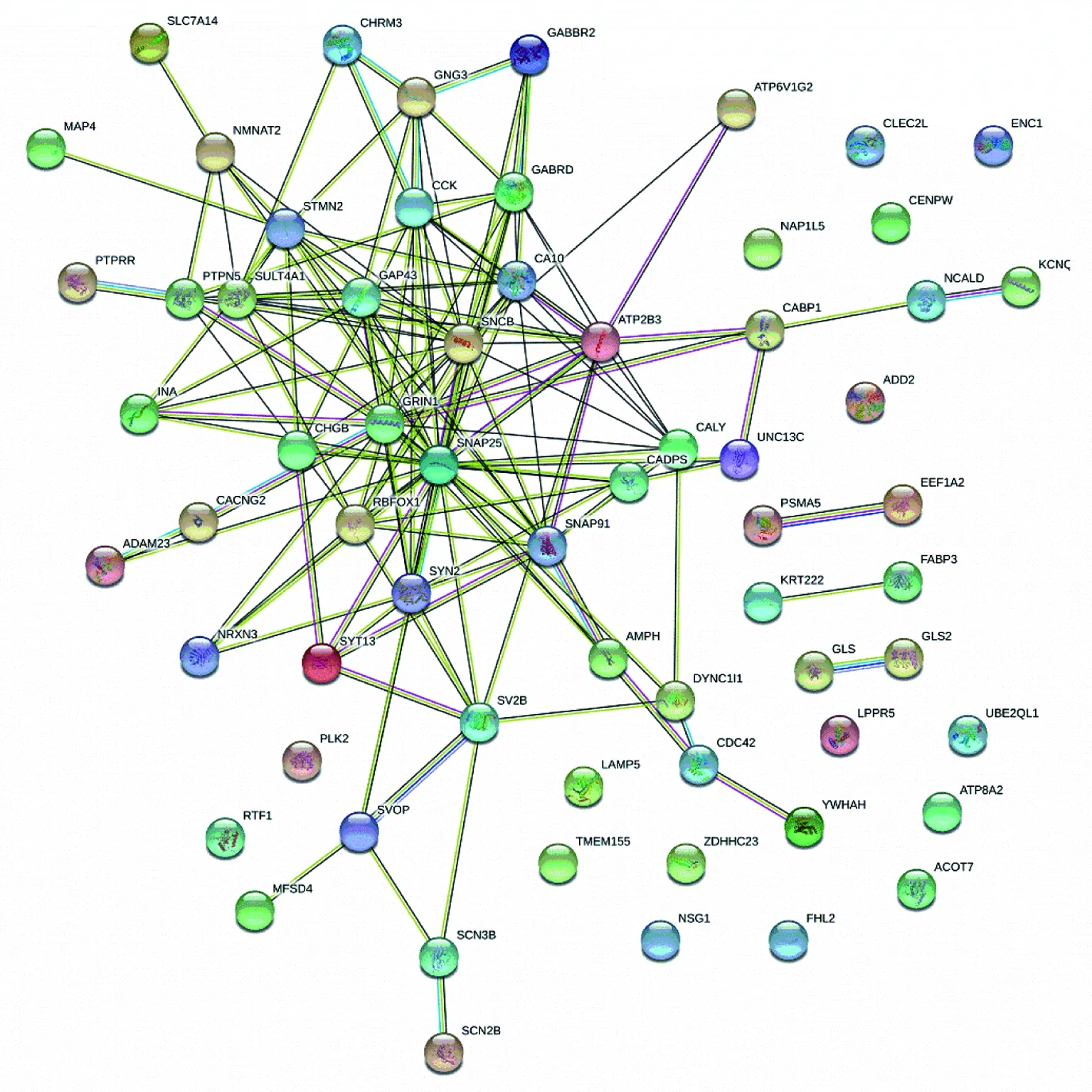
图2 HIP中DEGs的PPI网络
3 讨 论
AD是中枢神经系统的退行性疾病,与包括遗传在内的多种因素有关,其发病机制涉及多种基因。基因芯片能同时对大量基因转录体的表达水平进行检测和分析,在生物信息学中被广泛地用于疾病潜在靶标的挖掘。本研究采用生物信息学方法对AD患者的基因芯片数据进行了整理和挖掘分析,以期发现潜在的治疗靶点。为了减少批次效应并获得可靠的结果,本研究收集了基于同一芯片平台的GSE5281和GSE48350数据集,二者均包含AD患者和正常人脑组织尸检样本的基因表达数据。从两个数据集中选取共有的脑区域,EC和HIP,其在认知和记忆功能中起着至关重要的作用,在AD进展的早期阶段即会受到影响[6]。
本研究中利用GEO2R在线工具对两个数据库中的共有DEGs进行了筛选,并进行了GO分析和KEGG通路富集分析。根据结果,相关基因主要集中在化学突触传递、细胞外基质组织和蛋白质结合等生物学过程中。利用STRING在线数据库分别从EC和HIP脑区获得了与AD发病相关的基因。文献资料显示,这些相关基因中的大多数已被发现与AD相关,如CCL2通过神经炎症途径与AD相关,CCL2的过表达能促使Tau蛋白沉积增加,同时促进神经胶质的有害炎症性改变[7-8];Liu等研究发现,WIF1基因在AD患者中表达降低,WIF1在抑制Wnt信号传导方面起作用,而Wnt信号传导与AD中的低磷酸化水平有关,进而影响AD的发生[9];RBFOX1是一种RNA结合蛋白,在选择性剪接、mRNA稳定性和翻译过程中发挥关键作用,可直接与Tau mRNA结合并影响其稳定性和翻译,同时促进Tau蛋白的表达[10];SYN2在神经递质释放中起重要作用,研究表明其在AD大鼠和患者中均显著降低,记忆受损增加而产生AD[11]。然而,本研究中也发现了4个少有报道的AD相关基因,包括ANGPT1、APLNR、MCHR1和ATP2B3。其中,ANGPT1编码一种属于血管生成素家族的糖蛋白,近期研究报道其可通过增加大鼠体内β淀粉肽分泌进而加速AD的进展[12];APLNR和MCHR1属于G蛋白偶联受体基因家族;ATP2B3编码离子转运ATP酶。这4个基因对AD的进展可能存在影响,其机制尚待进一步研究。
综上所述,本研究中通过生物信息学方法分析发现ANGPT1、APLNR、MCHR1和ATP2B3基因可能与AD发病具有一定关联,这或许能为了解AD的发病机制和探索新的治疗靶点提供科学依据。

