日照海域分泌肽聚糖水解酶菌株的筛选、初步鉴定及抑菌活性测定*
李 淼 侯灵芝 徐兴浩 王肖肖 郑明灿 刘 昂
(济宁医学院基础医学院,济宁 272067)
肽聚糖是细菌细胞壁的特有组分,其水解酶作用靶点是细胞壁中肽聚糖成分的酶类物质,也称为溶素(lysin),具有裂菌杀菌能力,是潜在的抗菌武器,受到了较多的关注[1-2]。
金黄色葡萄球菌(Staphylococcus aureus)是常见的引起人化脓性感染的病原菌。可引起伤口的化脓性感染、肺炎、败血症等,严重者会危及生命[3]。金黄色葡萄球菌极易产生耐药性变异,例如耐甲氧西林金黄色葡萄球菌现已经成为患者死亡的重要病原菌[4]。开发新型的杀菌药物迫在眉睫。本研究以金黄色葡萄球菌肽聚糖为底物,从海洋沉积物中筛选能够水解胞外肽聚糖的细菌菌株,以金黄色葡萄球菌的菌体为底物对8株细菌进行了发酵产酶培养,并检测了粗酶液对金黄色葡萄球菌的抑菌活性。现报道如下。
1 材料与方法
1.1 材料
1.1.1沉积物样品 分离菌株所用的沉积物样品是用无菌的50 mL离心管采集自日照附近黄海海域的潮间带(35°28' N 119°36'E),低温运输到实验室并于4℃保存备用。
1.1.2菌株 金黄色葡萄球菌(ATCC 27217T)购自Solarbio公司,在实验室中接种LB培养基传代培养。
1.1.3培养基 LB培养基[1%胰蛋白胨(Oxoid公司),0.5% 酵母浸出物(Oxoid公司),1.5%琼脂(Biosharp公司),蒸馏水,pH 7.5]。
TYS 培养基(0.5%胰蛋白胨,0.1% 酵母浸出物,1.5%琼脂,人工海水,pH 7.5)。
肽聚糖水解酶筛选平板(0.5%胰蛋白胨,0.1% 酵母浸出物,1.5%琼脂,人工海水,1% 金黄色葡萄球菌肽聚糖,pH 7.5)。
以金黄色葡萄球菌菌体为底物的发酵培养基(2%金黄色葡萄球菌体,人工海水,pH 8.0)。
1.2 方法
1.2.1金黄色葡萄球菌肽聚糖提取 将500ml金黄色葡萄球菌过夜培养物,8000rpm 离心2min收集菌体,蒸馏水重悬,离心洗涤1次,倒掉上清液;用100ml蒸馏水重悬菌体;将样品煮沸10min,然后10000rpm 离心8min收集菌体;用预热的5%(w/v)的SDS缓冲液重悬菌体,煮沸40min,不可溶物通过离心(10000rpm,15min)重新收集;用预热的(60℃)蒸馏水洗涤菌体以去除SDS,离心洗涤6次;利用超声破碎细胞,间隔5s,破碎5s,功率400W,99次每轮,破碎4轮;将样品4000rpm离心10min,去掉未破碎的菌体,保留上清,12000rpm离心10min收集破碎的细胞壁并水洗2次即得到肽聚糖。
1.2.2肽聚糖水解酶分泌菌株的初筛 将1g沉积物样品和9ml的无菌人工海水悬浮加入三角瓶中,另加入10颗直径为1mm的无菌小玻璃球,于25℃、200r/min震荡1h。之后取悬浮液梯度稀释后涂布肽聚糖水解酶筛选平板,置于25℃静置培养10d,选取周围有透明圈的菌落分离纯化,用于后续实验。
1.2.3所筛选菌株在发酵培养基中生长情况分析 将筛选到的能在肽聚糖水解酶筛选平板上产生透明圈的菌株接种到以金黄色葡萄球菌菌体为底物的发酵培养基中,培养3d后镜检观察生长结果,选取能够在该种发酵培养基中明显生长的菌株用于进一步研究。
1.2.4所筛选菌株16S rRNA基因序列测定和同源比对 将筛选的能分泌肽聚糖水解酶且能够在以金黄色葡萄球菌菌体为底物的发酵培养基中生长的菌株,利用基因组小量提取试剂盒提取其基因组。之后利用细菌16S rRNA基因扩增通用引物27F和1492R扩增其16S rRNA基因片段,扩增产物经琼脂糖凝胶电泳,切胶回收后连接到PMD-19T克隆质粒中,转化大肠杆菌DH5α菌株后寄送到北京擎科新业生物技术有限公司测序。将得到的序列在EzBioCloud网站同源比对,分析其分类学地位。
1.2.5所筛选菌株粗酶液的制备 将筛选到的8株菌株接种以金黄色葡萄球菌菌体为底物的发酵培养基,培养4d后,12000rpm离心5min后收集上清液即为粗酶液。
1.2.6粗酶液抑菌活性测定 平板菌落计数法:1)挑取金黄色葡萄球菌到LB液体培养基,于25℃、200r/min条件下震荡培养5h。吸取1ml培养物离心收集菌体,之后用1ml 0.5mM的PBS缓冲液重悬制备菌悬液。2)实验组吸取200μl制备好的菌悬液,与200μl粗酶液混匀,30℃环境下反应40min;对照组操作与实验组仅有一处不同,即粗酶液先沸水浴1min后再与菌悬液混匀反应。3)反应后,将对照组与实验组反应液进行梯度稀释到1×10-8、1×10-9、1×10-10,稀释液为LB液体培养基。之后将稀释后的反应物涂布固体LB培养基, 37℃恒温培养箱静置培养24h后,计数对照组与实验组的菌落个数。显微镜观察:将平板菌落计数法步骤中第二步粗酶液和菌悬液的反应产物,取3μl涂布载玻片,革兰染色后油镜观察并拍照。
2 结果
2.1 分泌肽聚糖水解酶菌株筛选
在肽聚糖筛选平板上经过两周的培养,长出了很多的菌落,但是仅有15株细菌菌落周围产生了明显的透明水解圈,表明这15株细菌能够分泌肽聚糖水解酶。我们将这15株细菌进一步纯化后制作甘油管保种备用。
2.2 所筛选菌株在发酵培养基中生长情况
经过培养检测,发现所筛选到的15株能分泌肽聚糖水解酶的菌株中,有8株可以在金黄色葡萄球菌菌体为底物的发酵培养基中生长。这8株细菌菌株具有较低成本下进一步扩大发酵产酶的可行性,有潜在的应用价值。
2.3 所筛选菌株16S rRNA基因序列测定和同源比对结果
为初步确认本实验筛选到的8株有潜在应用价值的细菌菌株的分类地位,我们对这些菌株的16S rRNA基因序列进行了测定,并将获得的序列进行同源比对。结果表明,这8株细菌均属于芽孢杆菌属,物种丰富度较低。见表1。

表1 8株细菌菌株16S rRNA基因序列同源比对
2.4 粗酶液抑菌活性初步测定
与对照组相比,经过粗酶液处理过的金黄色葡萄球菌的菌落形成单位均大幅下降。对金黄色葡萄球菌抑菌效果最显著的是菌株S213,实验组的菌落形成单位下降了95.0%。而对金黄色葡萄球菌抑菌效果相对最差的是菌株S324,实验组的菌落形成单位下降了61.9%。其他6株细菌粗酶液的实验组菌落形成单位下降了78.6%~93.5%,均展示出了良好的抑制金黄色葡萄球菌的能力。见图1、表2。
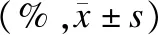
表2 粗酶液处理过的金黄色葡萄球菌的菌落形成单位下降比例
2.5 粗酶液的杀菌能力
与对照组相比,经粗酶液作用后,实验组金黄色葡萄球菌数量明显减少,出现了一些轮廓不清晰的碎片样物质;实验组金黄色葡萄球菌的排列方式也不再是葡萄串状,而是单球、双球或者短链样不规则排列。粗酶液能够裂解金黄色葡萄球菌,大幅度减少其数量并导致其排列方式发生变化。见图2。
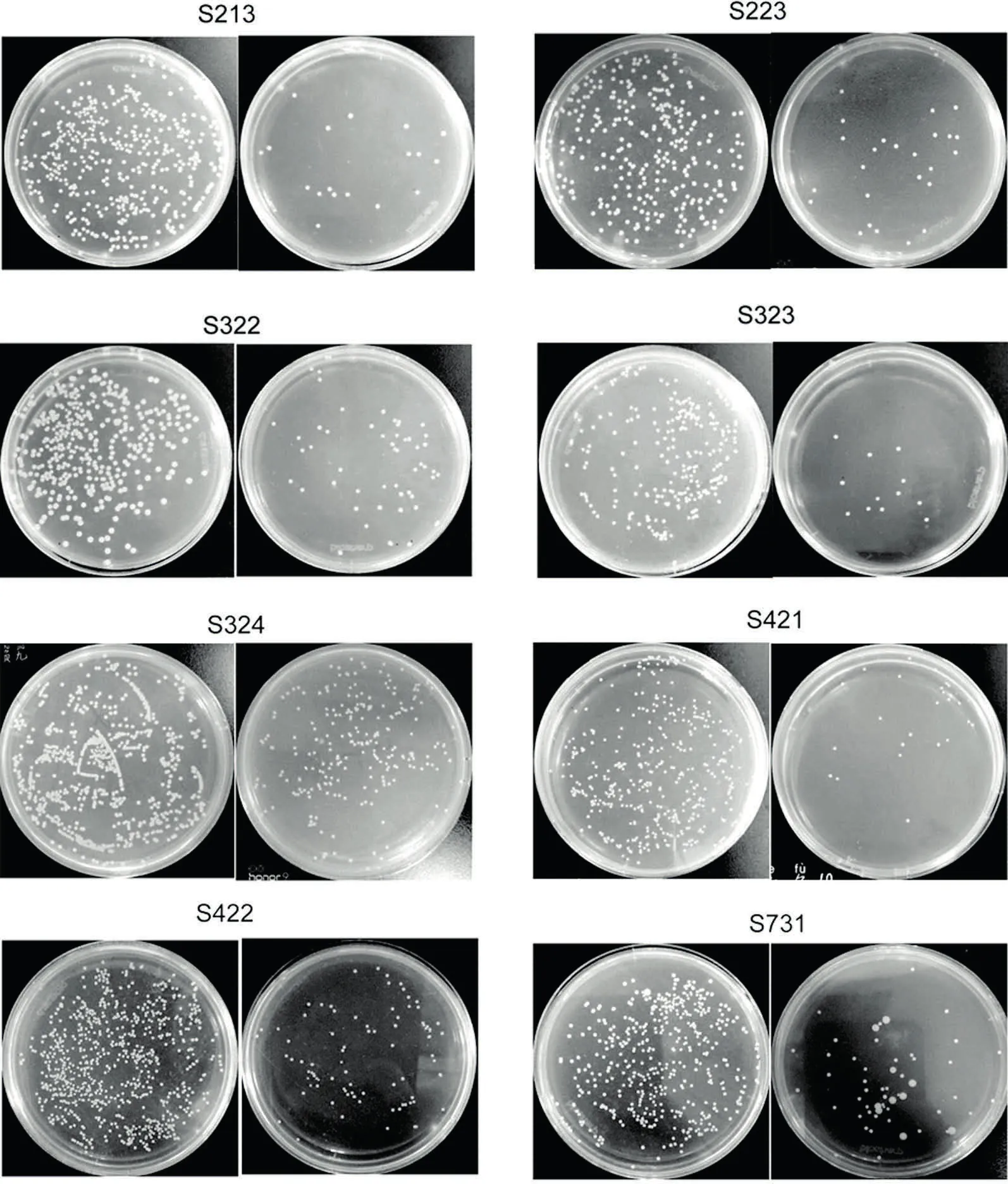
注:每菌株对应两张图片,左边图片为对照组,右边图片为实验组,菌株编号在图片组的上方。
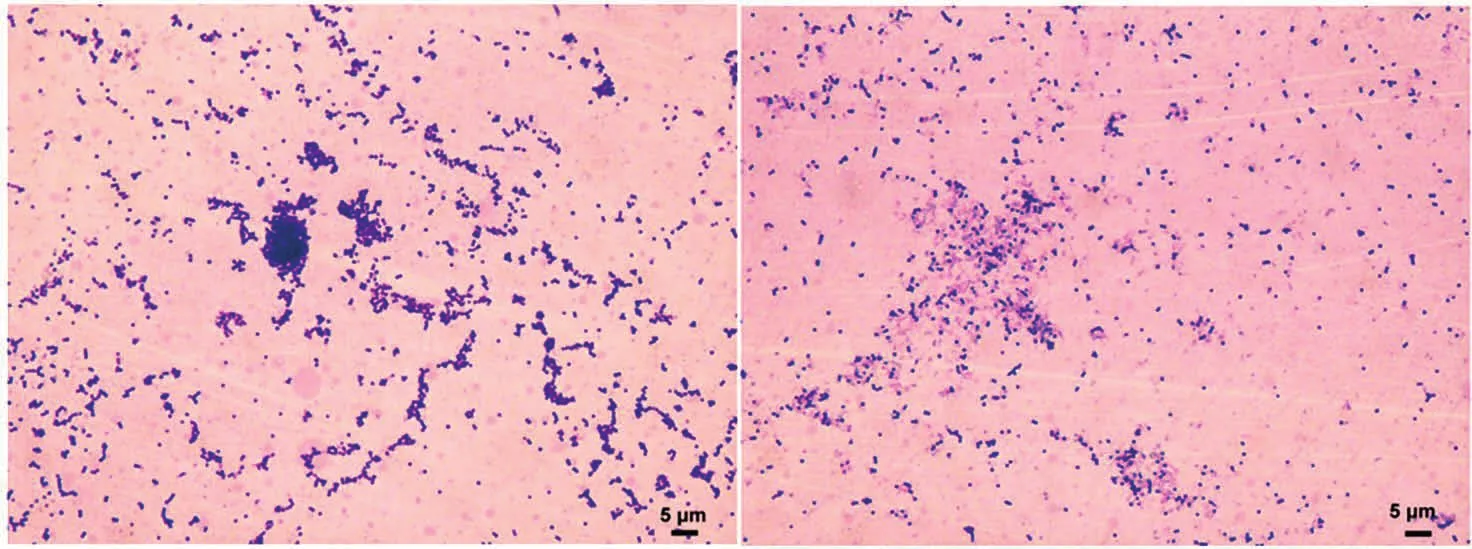
注:左边图片为对照组,右边图片为实验组。图中的标尺代表的长度为5μm。
3 讨论
细菌的耐药问题越来越严重,据调查显示,在全世界范围内,有700000人因细菌耐药而丧生。如果细菌耐药问题不能解决,到2050年将导致与感染有关的死亡超过癌症引起的死亡。肽聚糖水解酶也称为溶素,可根据其来源和功能分为外溶素(exolysin)、内溶素(endolysin)和自溶素(autolysin)[5-7]。具有裂菌功能的主要是肽聚糖水解酶中的外溶素和自溶素[8]。而肽聚糖水解酶与传统抗菌药物不同[9],通过裂解细胞壁肽聚糖从而裂解杀菌,是潜在的抗菌武器,具有良好的应用前景[10-13]。
鉴于细菌分泌肽聚糖水解酶多为诱导型,如若希望通过液体培养基发酵产酶,需要添加肽聚糖作为诱导物诱导产酶。但商品化的肽聚糖价格昂贵,而在实验室提纯过程繁琐,成本高,均不适用于之后的大规模发酵产酶,本实验为解决这一问题,尝试直接将金黄色葡萄球菌菌体作为发酵培养基中的唯一有机物来培养所筛选出的产酶菌株,金黄色葡萄球菌菌体上的肽聚糖即可作为诱导物诱导产酶。
本研究从山东日照海域沉积物样品中,以金黄色葡萄球菌肽聚糖为底物筛选出了15株能分泌肽聚糖水解酶的菌株。我们进一步的实验表明其中有8株可以在以金黄色葡萄球菌为唯一有机物的培养基中生长并产酶,这8株菌具有低成本发酵生产肽聚糖水解酶的应用潜力。通过16S rRNA基因序列比对分析,我们选择的8株菌均为芽孢杆菌属细菌。芽孢杆菌属菌株是分离肽聚糖水解酶的良好来源。将选取的8株芽孢杆菌进行以金黄色葡萄球菌为底物的发酵培养后,制取粗酶液,通过平板菌落计数法测定菌株粗酶提取液的抑菌活性,结果表明8株芽孢杆菌属菌株对金黄色葡萄球菌具有较好的抑菌效果,并且通过显微镜观察证实了粗酶液的杀菌能力。本研究所筛选到的菌株及探索出来的低成本发酵产酶方法,为下一步分离纯化肽聚糖水解酶,开发新型抗菌药物奠定了坚实的基础。

