摄食信息对球形棕囊藻和布氏双尾藻竞争结果的影响
霍铱萍,王小冬,王 艳
暨南大学,赤潮与海洋生物学研究中心, 广州 510632
化学信息是海洋浮游植物和浮游动物感受环境的重要媒介[1]。浮游动物利用化学信息寻找,定位,识别和捕获合适的食物[2]。同时,浮游植物也会感知浮游动物产生的化学信息[3]。部分浮游植物进化出诱导性防御以减少摄食死亡率[3]。在摄食信息的存在下,它们会改变自身的特征,如生化物质[4]、形态[5]、行为[6]和生活史[7]。在影响浮游植物防御效率的因素中,粒径大小的改变尤其重要[8]。粒径大小的改变会导致捕食者和猎物的粒径不匹配,使浮游植物得以避免浮游动物的摄食[9]。
棕囊藻(Phaeocystis)是广泛分布于从热带到两极海区的藻华物种,对食物网功能和结构、碳和硫的生物地球化学循环和气候变化有重要的作用[10-11]。它存在游离单细胞和凝胶状囊体间转换的独特生活史[12]。游离单细胞直径3—10 μm,而由粘液基质包裹细胞的囊体直径普遍达几百微米,甚至几厘米[12]。囊体形成的优势在于它凭借囊体较大的直径及坚韧的囊被,在浮游动物的攻击下能有效地增加囊体细胞的存活率[13]。桡足类,纤毛虫类和异养甲藻摄食信息的存在下,棕囊藻能形成更大的囊体[14,16]。囊体的形成被认为是一种诱导性防御机制。
但是诱导性摄食信息的释放可能不仅限于诱导出植物的防御功能。粒径显著影响海洋浮游植物光的利用,营养需求和摄入,以及新陈代谢/呼吸率等主要功能性特征[17]。由于较低的表面积与体积比值,扩散层增厚,粒径更大的浮游植物生长率较低可能会导致竞争能力下降[18]。海洋浮游植物必须和共存的物种竞争有限的资源;任何微妙的生理和生物变化都会影响它们之间竞争。棕囊藻被认为是优秀的防御者,但是并非很好的竞争者[19]。棕囊藻藻华通常在硅藻藻华之后爆发[10],说明棕囊藻的竞争力低于硅藻。然而,仍未知球形棕囊藻(Phaeocystisglobosa)竞争力低于硅藻是否与诱导性防御有关。因此,我们选择生长率较低的硅藻—布氏双尾藻(Ditylumbrightwellii)作为与球形棕囊藻共存的竞争者,研究了微型浮游动物海洋尖尾藻(Oxyrrhismarina)和中型浮游动物火腿伪镖水蚤(Pseudodiaptomuspoplesia)释放的摄食信息是否会使球形棕囊藻相对布氏双尾藻的竞争力下降。本研究将有助于理解诱导性防御对浮游植物生长和竞争的影响。
1 材料与方法
1.1 浮游植物和摄食者的培养
球形棕囊藻和布氏双尾藻在南中国海海域采集,用f/2培养基培养,培养条件为:盐度30‰,温度20℃,光强100 μmol photons m-2s-1,光暗周期14 h∶10 h。在欧洲和中国沿海水域中能观察到布氏双尾藻与球形棕囊藻共同出现[20,21]。每5—7天用新鲜f/2培养基稀释球形棕囊藻和布氏双尾藻以维持指数生长,用细胞丰度增长率计算它们的最大生长率分别为(0.69±0.04) d-1和(0.28±0.03) d-1。实验前,利用Nikon倒置显微镜(400×),在Sedgwick-Rafter计数板中测量细胞大小。布氏双尾藻的细胞体积使用形态-体积模型[22]中的三棱柱体积公式计算,球形棕囊藻的细胞体积按照球形体积公式计算。
采用南中国海两种常见的中型和微型浮游动物,桡足类火腿伪镖水蚤和异养甲藻海洋尖尾藻,作为产生摄食信息的摄食者[15]。实验前经过检验,火腿伪镖水蚤和海洋尖尾藻都能摄食球形棕囊藻和布氏双尾藻。火腿伪镖水蚤在实验开始2周前用450 μm孔径的拖网于珠江口采集。海洋尖尾藻从Shannon Point海洋中心获得。两种摄食者都培养在f/2培养基中,用球等鞭金藻(Isochrysisgalbana)喂养。实验开始2d前,将成年的雌性火腿伪镖水蚤转移到新鲜的f/2培养基下培养,不投喂食物以清空肠胃。饥饿处理后,3只火腿伪镖水蚤用已过滤的海水清洗,然后转移装有200 mL f/2培养基的500 mL玻璃烧杯中。实验前,海洋尖尾藻在黑暗下培养7d,使球等鞭金藻被完全消耗。之后,将海洋尖尾藻转移玻璃烧杯中,控制其初始密度为100 个/mL。火腿伪镖水蚤和海洋尖尾藻的培养体系中每4—5d更换新鲜的f/2培养基,同时加入处于指数生长期的球形棕囊藻单细胞喂养,细胞丰度范围为105—106个/mL。
1.2 竞争-防御实验
为了研究摄食信息对竞争结果的影响,球形棕囊藻和布氏双尾藻暴露在火腿伪镖水蚤和海洋尖尾藻摄食信息下培养。实验在50 mL的聚苯乙烯细胞培养瓶中进行。实验组和对照组设置5个平行。实验期间,每天用GF/F膜在低真空下过滤火腿伪镖水蚤和海洋尖尾藻的培养液作为含有摄食信息的滤液[23]。实验组培养瓶中各加入5 mL滤液;对照组中加入5 mL f/2培养基。球形棕囊藻培养液用10 μm尼龙膜在重力作用下过滤2次以收集球游离单细胞[14,24],与布氏双尾藻一同转移到对照组和实验组的培养瓶中,补充f/2培养基至50 mL。球形棕囊藻和布氏双尾藻的初始密度分别为10000个/mL和100 个/mL,使实验开始时两种藻类总细胞体积相等,均为1.1×106μm3[25]。实验培养条件与藻种培养时相同:盐度30‰,温度20℃,光强100 μmol photons m-2s-1,光暗周期14 h:10 h。
实验在半连续培养下持续25天,每天移除10 mL培养液用作细胞和囊体丰度的显微计数,每个实验组培养瓶中加入5 mL新鲜的f/2培养基和5 mL含有新鲜摄食信息的滤液,每个对照组培养瓶中加入10 mL f/2新鲜的培养基,每天加入f/2培养基避免了营养盐限制。同时培养摄食者的玻璃烧杯中每天加入25 mL的新鲜f/2培养基,保证饵料数量的充足,并且减少营养盐限制对饵料质量的影响。在整个实验过程中,检测火腿伪镖水蚤的游动行为。移除动作迟钝的火腿伪镖水蚤,用游动活跃的成年雌性火腿伪镖水蚤代替,排除死亡火腿伪镖水蚤摄食信息的潜在影响[23,26]。
1.3 细胞计数和囊体测量
用于显微计数的细胞和囊体样品用终浓度为4%的鲁格试剂固定。球形棕囊藻和布氏双尾藻的细胞丰度用Sedgwick-Rafter计数板计数。球形棕囊藻囊体丰度用带有标尺的Nikon倒置显微镜在24孔板中测量[14,24]。每个样品随机测量30个囊体的直径以及囊体内的细胞数。计数当天完成。
预实验发现在火腿伪镖水蚤和海洋尖尾藻摄食信息的存在下,布氏双尾藻细胞大小或者硅含量都没有变化,表明布氏双尾藻不存在形态的诱导性防御能力。为了进一步证明布氏双尾藻与球形棕囊藻共存时缺乏硅化作用上的诱导性防御能力,每5d检测生物硅含量和细胞大小。用0.6 μm的聚碳酸酯膜过滤5 mL样品,用无Si的培养基和0.01 mol/L 的HCl清洗。滤膜在60℃下干燥,然后在100℃下用0.2 mol/L NaOH消化1 h。冷却到室温之后,用1 mL 1 mol/L的HCl中和样品,用比色法测定硅酸的浓度[27]。根据布氏双尾藻的细胞数计算单位细胞的生物硅含量。使用倒置显微镜测量布氏双尾藻的细胞长度和宽度。
浮游植物的竞争能力利用公式(1)计算:
(1)
式中,VPha和VDit分别表示球形棕囊藻和布氏双尾藻在时间(t)下的总生物体积。Y(t)与时间(t, day)线性回归的斜率表示球形棕囊藻相对布氏双尾藻的竞争力,正值代表球形棕囊藻竞争能力较高,而负值表示布氏双尾藻竞争能力较高[28]。
1.4 数据分析
使用Prism GraphPad (v.5.0) 软件进行统计分析和作图。用D′Agostino-Pearson正态检验分析数据的正态性,用Levene′s检验分析方差同质性。用two-way RM ANOVA检验分析实验组和对照组的生物体积随时间的变化。用非参数的Mann-Whitney 检验分析实验组和对照组最大囊体直径和囊体丰度的变化。用线性拟合分析 (Yt) 与t的关系,用one-way ANCOVA分析实验组和对照组之间的回归方程的斜率。显著性水平为P<0.05。
2 结果
2.1 球形棕囊藻囊体丰度和直径的变化
对照组中球形棕囊藻囊体最早在第4天出现,共存在13d;而两个实验组中第2天就出现了囊体,一直存在至实验结束(25d;图1)。对照组中最大囊体丰度达(1346±50) 个/mL,但是在加入火腿伪镖水蚤和海洋尖尾藻摄食信息组中分别只有(211±60) 个/mL和(122±21) 个/mL(P<0.01)(图1)。对照组中的最大囊体直径为(112±26.7) μm,显著低于火腿伪镖水蚤和海洋尖尾藻摄食信息组(P<0.05),分别为(134±54.7) μm和 (150±58.8) μm(图2)。
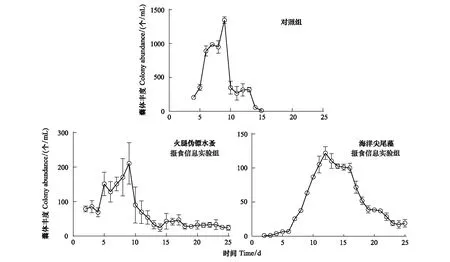
图1 对照组,火腿伪镖水蚤摄食信息实验组和海洋尖尾藻摄食信息实验组中球形棕囊藻的囊体丰度/(个/mL)Fig.1 Colony abundances of P. globosa in the control, Pseudodiaptomus poplesia-induced and O. marina-induced treatment
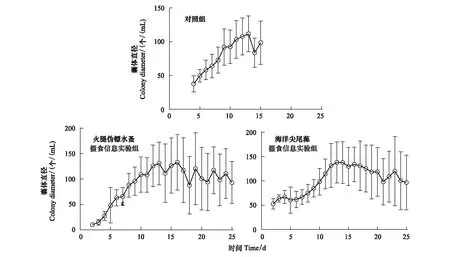
图2 对照组,火腿伪镖水蚤摄食信息实验组和海洋尖尾藻摄食信息实验组中球形棕囊藻的囊体直径Fig.2 Colony diameters of P. globosa in the control, Pseudodiaptomus poplesia-induced and O. marina-induced treatment
2.2 布氏双尾藻细胞大小和生物硅含量的变化
在整个实验过程中,火腿伪镖水蚤和海洋尖尾藻摄食信息组中的布氏双尾藻细胞的长度,宽度和单位细胞的生物硅含量与在对照组中的相比均无显著的差异(P>0.05),表明布氏双尾藻不存在形态大小和硅化作用方面的诱导性防御策略(表1)。
2.3 球形棕囊藻和布氏双尾藻生物体积的变化
对照组和火腿伪镖水蚤摄食信息组中球形棕囊藻的生物体积都显著高于布氏双尾藻(P<0.0001),而海洋尖尾藻摄食信息组中则有相反的趋势(P<0.0001)。对照组和火腿伪镖水蚤摄食信息组中球形棕囊藻的最大生物体积分别是(65.3±2.59)×106μm3/mL和(93.2±5.92)×106μm3/mL,显著高于海洋尖尾藻摄食信息组中的(11.1±0.17)×106μm3/mL(P<0.0001)(图3)。对照组和火腿伪镖水蚤摄食信息组中布氏双尾藻的最大生物体积低于15×106μm3/mL,显著低于海洋尖尾藻摄食信息组的(67.9±2.52) ×106μm3/mL(P<0001)(图3)。
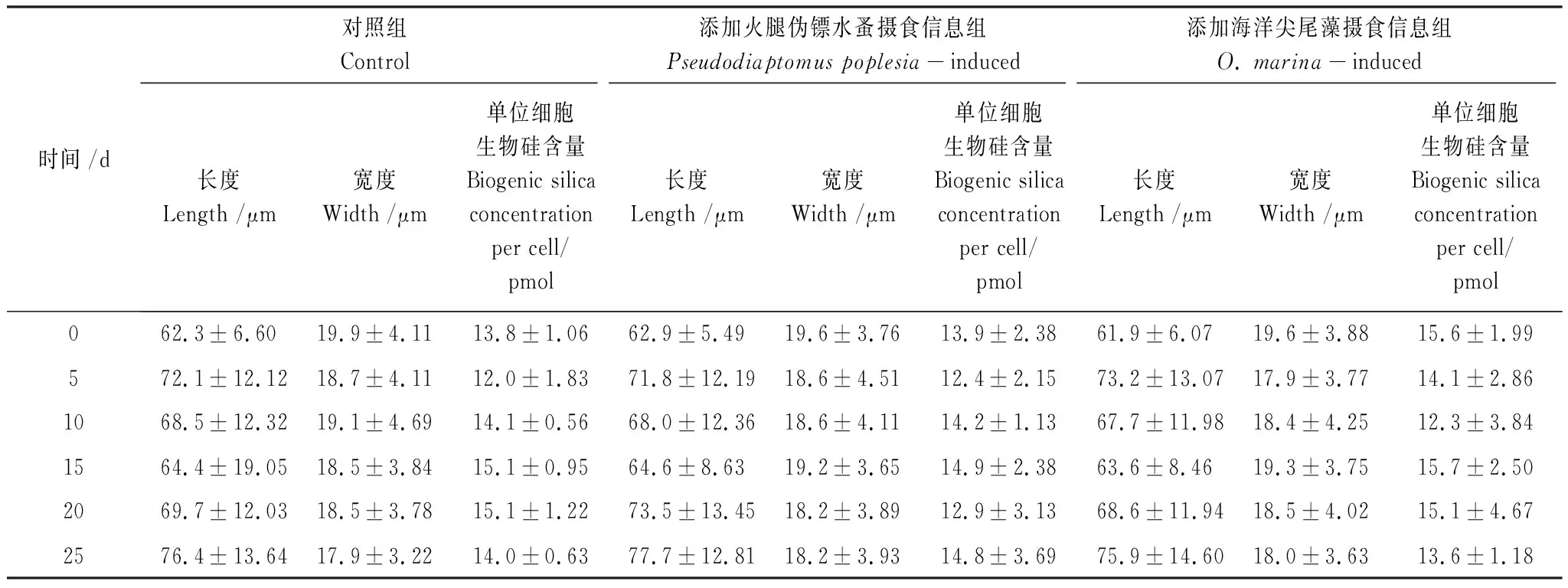
表1 布氏双尾藻的细胞大小和单位细胞的生物硅含量
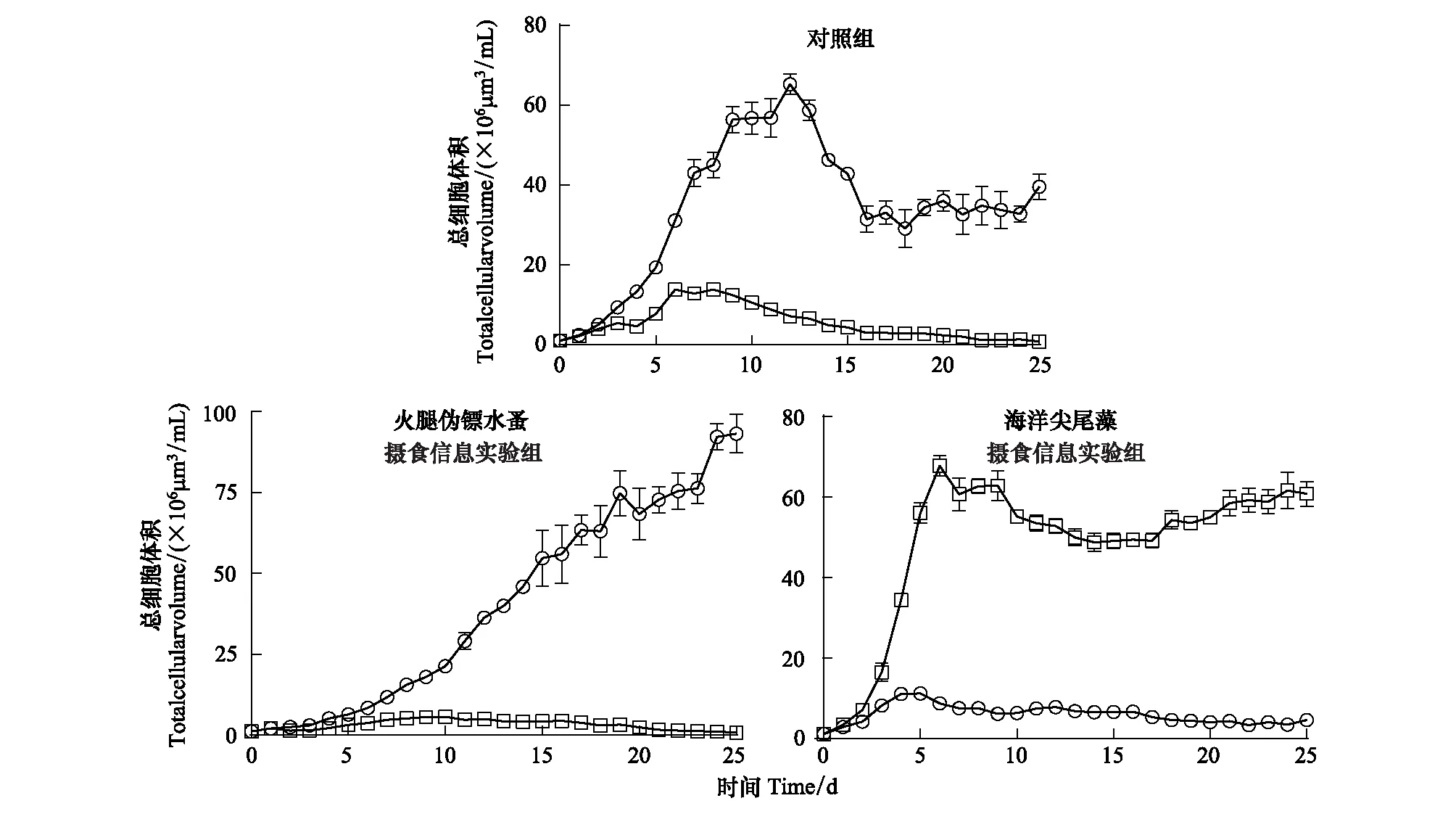
图3 对照组,火腿伪镖水蚤摄食信息实验组和海洋尖尾藻摄食信息实验组中球形棕囊藻(圆点)和布氏双尾藻(方块)的细胞体积Fig.3 The cell volume of P. globosa (circles) and D. brightwellii (squares) in the control, Pseudodiaptomus poplesia-induced and O. marina-induced treatment
2.4 球形棕囊藻和布氏双尾藻竞争力的比较
对照组和火腿伪镖水蚤摄食信息组中Y(t)和t有显著正向线性相关(P<0.0001)(图4),表明布氏双尾藻在与球形棕囊藻的竞争中处于劣势。火腿伪镖水蚤摄食信息组中的斜率显著高于对照组中的(P<0.0001),表明火腿伪镖水蚤摄食信息增强了球形棕囊藻相对布氏双尾藻的竞争力。相反,在海洋尖尾藻摄食信息组中的斜率为负值(P<0.0001),表明球形棕囊藻的竞争力低于布氏双尾藻。
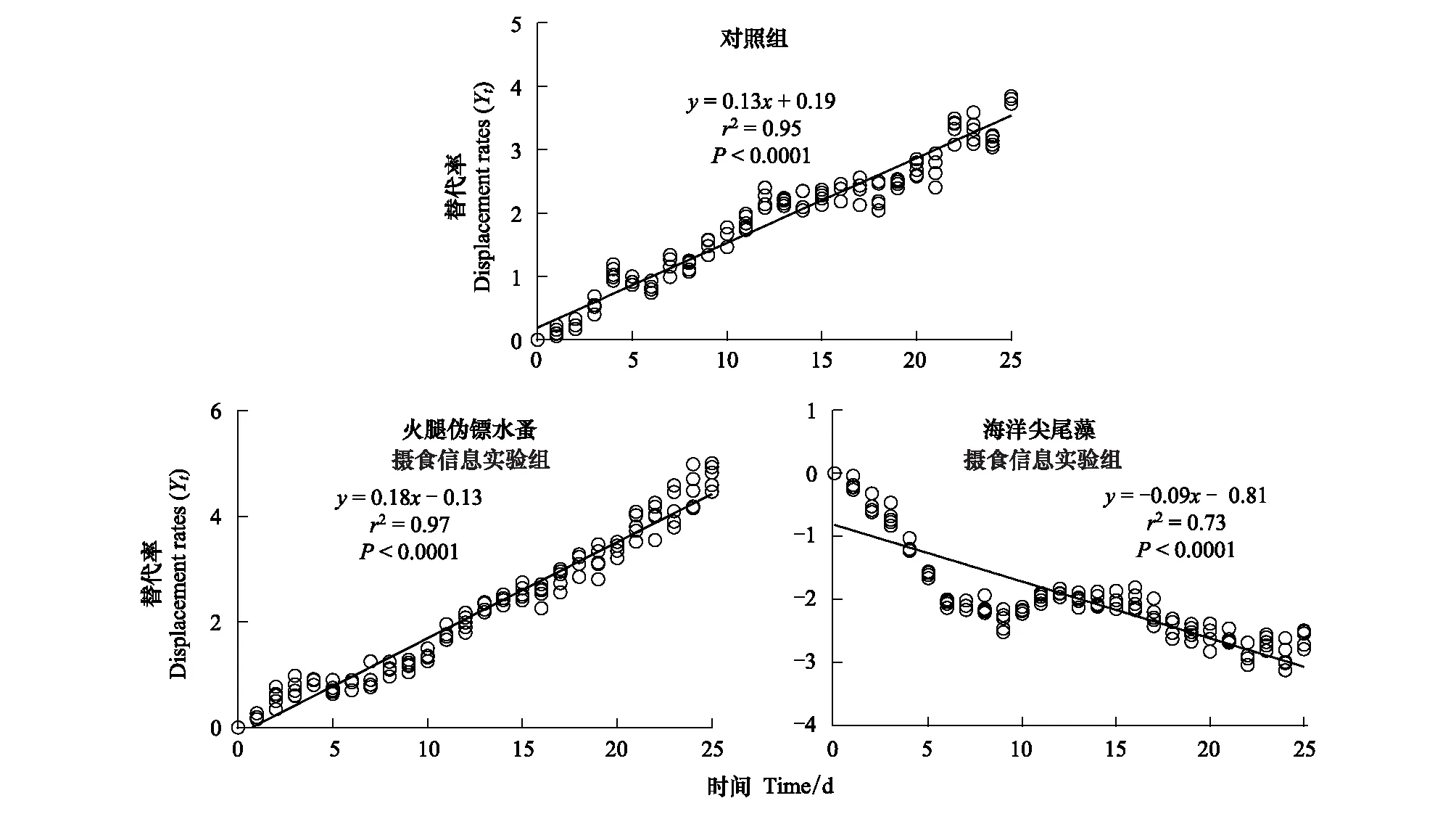
图4 对照组,火腿伪镖水蚤摄食信息实验组和海洋尖尾藻摄食信息实验组中球形棕囊藻的替代率Fig.4 The displacement rates for P. globosa in the control, Pseudodiaptomus poplesia-induced and O. marina-induced treatment
3 讨论
桡足类,纤毛虫和异养甲藻释放的化学信息会使球形棕囊藻的囊体增大[14-16]。囊体的增大是一个简单且有效的诱导性防御机制[23],避免了大多数浮游动物的摄食[13]。实验期间球形棕囊藻的生物量没有受囊体增大的影响,进一步论证了诱导性防御是一种可持续的策略。火腿伪镖水蚤和海洋尖尾藻摄食信息的实验组中球形棕囊藻形成的囊体比对照组大。海洋尖尾藻摄食信息组中球形棕囊藻的最大生物体积比火腿伪镖水蚤摄食信息组小8倍;然而两个实验组中的球形棕囊藻囊体大小相当。尽管摄食者或食物球形棕囊藻的生长会可能导致摄食信息滤液的营养盐差异,但摄食信息组和摄食者培养体系中持续添加新鲜的f/2培养基保证充足的营养盐,尽量避免营养盐缺乏。而且海洋尖尾藻摄食信息组中布氏双尾藻的生物体积处于较高水平,因此培养体系中不存在营养缺乏。我们的结果与Wang等[15]的研究结果相符:营养充足情况下,接收摄食信息后的球形棕囊藻比未接收摄食信息的产生的细胞丰度更高以及形成的囊体更大;营养限制条件下,启动诱导性防御的球形棕囊藻仍比未被激发防御反应的形成的囊体更大但细胞丰度更低[15]。因此,诱导性防御的维持和表达只与摄食信息的存在有关,与生物量无关。很多研究已经证实,球形棕囊藻在摄食压力下,形态和生化含量立即发生变化,但是生长率保持不变甚至下降[14-15]。防御优先启动,同时避免防御引发的能量消耗即随后的生长抑制。球形棕囊藻在营养盐充足条件下,生长不受影响,一旦营养盐限制,防御立即进行,但是生长率降低[15]。因此相似地,棕囊藻在同时面临摄食危机和竞争压力情况下,会优先选择启动防御而不是生长和生物量的积累。
诱导性防御的优先表达也表现在火腿伪镖水蚤和海洋尖尾藻的摄食信息促进了球形棕囊藻囊体的形成和维持。棕囊藻游离单细胞和小囊体经常附着在硅藻上[29]。表明硅藻可能给棕囊藻提供固着基质,从而刺激囊体的形成[30]。然而,我们的研究表明对于刺激囊体的形成,摄食信息比硅藻的存在更重要。对照组球形棕囊藻囊体比加入摄食信息组的晚2d形成。添加摄食信息也增强了囊体持久性。摄食信息组球形棕囊藻囊体持续时间约为对照组的2倍。有学者在欧洲沿海和罗斯海观察到在与不同浮游动物和硅藻共存情况下,棕囊藻囊体持续2个月[31-32],该现象与本研究结果一致。然而,当不存在摄食者的情况下,波切棕囊藻(Phaeocystispouchetii)囊体的持续时间少于20d[25]。之前的研究也表明球形棕囊藻独自生长时囊体的持续时间同样少于20d[33]。刺激囊体更快形成和囊体持续时间更长会增强囊体的防御能力,使其免受摄食。
普遍认为任何防御都必须付出相应的代价[34-35]。棕囊藻中囊体的形成会导致生长和竞争能力的损耗。南极棕囊藻囊体碳含量中粘液碳含量占(14±4)%[36],而在南中国海水域中该比值高达90%[37]。囊体的增大会减少营养的摄取,因为更低的表面积与体积比,以及囊体扩散层的存在[38]。在本研究中,火腿伪镖水蚤摄食信息组中球形棕囊藻的囊体增大并未对生长产生负面影响,直到实验结束球形棕囊藻总生物体积都在不断增加。前人的一些研究发现桡足类摄食信息会刺激球形棕囊藻的细胞丰度增加[14-15]。也有实验证据和野外观察表明囊体细胞生长率比游离单细胞高[33]。这些结果表明囊体的形成和增大并未表现出显著的能量损耗。囊体的形成被认为是抵抗摄食者的一种优势,因为形成囊被的物质是一次性投入而不需要重新构建[39]。火腿伪镖水蚤摄食信息的存在下,形成囊体所投入碳的量不足以妨碍棕囊藻的生长。另外,在黑暗期间,囊体内基质中的营养和能量可以给生长和繁殖提供重要的营养来源[40]。火腿伪镖水蚤释放的摄食信息不仅诱发球形棕囊藻的诱导性防御,而且增强了球形棕囊藻的竞争力。然而,火腿伪镖水蚤摄食信息组和海洋尖尾藻摄食信息组的囊体丰度都小于对照组。一方面,在摄食压力下,棕囊藻囊体体积的扩增可能比囊体的数量增多更有效,诱导性防御状态下的球形棕囊藻需要增大和维持囊体,可能会导致没有额外的物质和能量形成更多新囊体;另一方面球形棕囊藻成熟的囊体会向外释放囊体细胞,被释放的细胞会重新形成囊体[12],更大更持久的囊体也意味着囊体较少向外释放细胞,因此新囊体形成的途径变少。囊体丰度的减少这可能是诱导性防御的代价。
海洋尖尾藻释放的摄食信息降低了球形棕囊藻相对布氏双尾藻的竞争能力,这可能也是启动诱导性防御付出的代价。对照组的布氏双尾藻在竞争中始终处于劣势,而海洋尖尾藻摄食信息组球形棕囊藻处于劣势。微型浮游植物的摄食信息的存在显著地改变了棕囊藻和硅藻的竞争结果。火腿伪镖水蚤和海洋尖尾藻摄食信息组中两种藻竞争动态的差异可能是由于布氏双尾藻对摄食信息的响应不同。在本研究中,我们检测了布氏双尾藻细胞大小和细胞硅含量这两种硅藻防御浮游植物摄食者的主要策略[4]。然而,摄食信息会诱发其它生化和生长的响应。Ratti等[41]观察到纤毛虫增加了威氏海链藻(Thalassiosiraweissflogii)的生长率,而火腿伪镖水蚤对硅藻生长率没有影响。我们的研究也发现微型浮游动物摄食信息刺激了硅藻的生长。硅藻的生长可能对微型浮游动物的摄食敏感,而球形棕囊藻可能对中型浮游动物的摄食敏感,因此在海洋尖尾藻摄食信息存在下,球形棕囊藻的生长不如布氏双尾藻,则球形棕囊藻相对布氏双尾藻的竞争力下降。不论棕囊藻和硅藻对摄食信息的响应机制不同,摄食信息能显著影响浮游植物的种间竞争。
微型浮游动物释放的摄食信息会降低球形棕囊藻相对硅藻竞争力,这一结果有助于解释频繁观察到棕囊藻藻华会出现在硅藻藻华之后[10]。微型浮游动物是浮游植物的主要摄食者[42],而且普遍认为它们对初级生产力和生物量的影响超过中型浮游动物[43]。微型浮游动物对球形棕囊藻游离单细胞的摄食率显著高于中型浮游动物[44]。因此微型浮游动物的摄食是棕囊藻诱导性防御进化的主要压力。而囊体形成这一诱导性防御在对抗微型浮游动物摄食者上是有效的[13,23],但也会导致球形棕囊藻在与硅藻的竞争中处于劣势。另外,布氏双尾藻的生长率也低于海区中与球形棕囊藻共存的更小的硅藻,例如骨条藻(Skeletonema)和角毛藻(Chaetoceros)[45]。这些较小的硅藻也能在与球形棕囊藻的竞争中获胜,使棕囊藻藻华只有在水体中的硅被硅藻耗尽之后才开始爆发[46]。
诱导性防御的表达导致竞争力的下降可以提供对“浮游生物悖论”的进一步理解。前人提出了几个关于该悖论的解释[47]:营养和温度的季节循环[48],不完全的垂直混合层[49],资源竞争策略[50],和生理学和生活史特征[51]。海洋生态系统中的摄食行为能促进物种共存和生物多样性增加(如,摄食者会对竞争优胜者施加更高的摄食压力,防止劣势竞争者的灭绝)[52]。摄食信息也能间接地促进物种的共存。摄食信息的存在下,诱导性防御的表达可以使棕囊藻把摄食压力转移到其它物种上,如硅藻,间接地减小了球形棕囊藻的竞争压力[53]。棕囊藻因而成为具有优秀防御机制的竞争优胜者。另一方面,微型浮游动物摄食信息对它们的生物量和竞争产生负反馈调节,阻止防御优胜者排挤其它物种。因此,摄食信息具有调节浮游植物的竞争和共存生态功能。
4 结论
火腿伪镖水蚤和海洋尖尾藻摄食信息均能诱发球形棕囊藻的防御反应。火腿伪镖水蚤摄食信息诱导下球形棕囊藻比布氏双尾藻更具竞争力;而海洋尖尾藻摄食信息导致球形棕囊藻在与布氏双尾藻的竞争中处于劣势。研究表明在面临摄食和竞争压力下,棕囊藻会优先选择启动防御,而不是增加细胞丰度和生物量的积累。棕囊藻的诱导性防御机制——囊体增大和持续时间增长,是对抗浮游动物摄食有效而经济的措施,但作为代价,会表现出竞争能力下降。海洋尖尾藻摄食信息组中布氏双尾藻处于竞争优势,表明布氏双尾藻的生长对微型浮游动物的摄食信息更敏感,诱导性防御状态下的球形棕囊藻生长不如布氏双尾藻。棕囊藻的主要摄食者是微型浮游动物,微型浮游动物对棕囊藻诱导性防御机制进化施加主要摄食压力。自然海区微型浮游动物存在下,诱导性防御状态的棕囊藻在与硅藻竞争中处于劣势,有利于硅藻藻华在球形棕囊藻藻华之前爆发。由此可见,摄食信息通过对浮游植物种间竞争的调节,促进了物种的共存和物种多样性的增加。
——以“不同咖啡因饮料对水蚤心率的影响”为例

