原子转移自由基聚合法合成分子印迹聚合物及其吸附性能的研究
宋立新, 张云霞, 芮超凡, 何 娟*, 谷立峰
(1.河南水利与环境职业学院,河南郑州 450000 2.河南工业大学,河南郑州 450001;3.河南省科学院生物研究所有限责任公司,河南郑州 450000)
赭曲霉毒素是一类结构类似的真菌毒素,包括7种毒性物质。其中以赭曲霉毒素A(Ochratoxin A,OTA)毒性最大,对农产品的污染最重,与人类生活密切相关[1]。赭曲霉毒素A是一种具有多种毒性的真菌毒素,是真菌同化异化产生的一种有毒次级代谢物[2]。赭曲霉毒素A的污染范围广泛,特别是对小麦、玉米、大豆、高粱等农产品产生直接和间接污染,会在农作物、植物及其产品的储藏、运输与加工过程中产生[3]。为了有效预防和控制赭曲霉毒素A的污染,保证食品安全,必须严格把控食品中赭曲霉毒素A的含量。目前,赭曲霉毒素A的分析检测方法主要有薄层色谱法、免疫亲和柱-高效液相色谱法等[4 - 6]。样品前处理技术对于分析检测至关重要,而且在复杂样品中痕量赭曲霉毒素A的分析中要求更为严格[7]。近年来,分子印迹聚合物(Molecularly Imprinted Polymers,MIPs)以其精确、特异性的吸附能力、高重复性、低检出限、又不易受复杂样品基体干扰的特点,正被逐渐应用于痕量物质的前处理中,弥补了传统固相萃取和免疫分析的不足[8 - 10]。
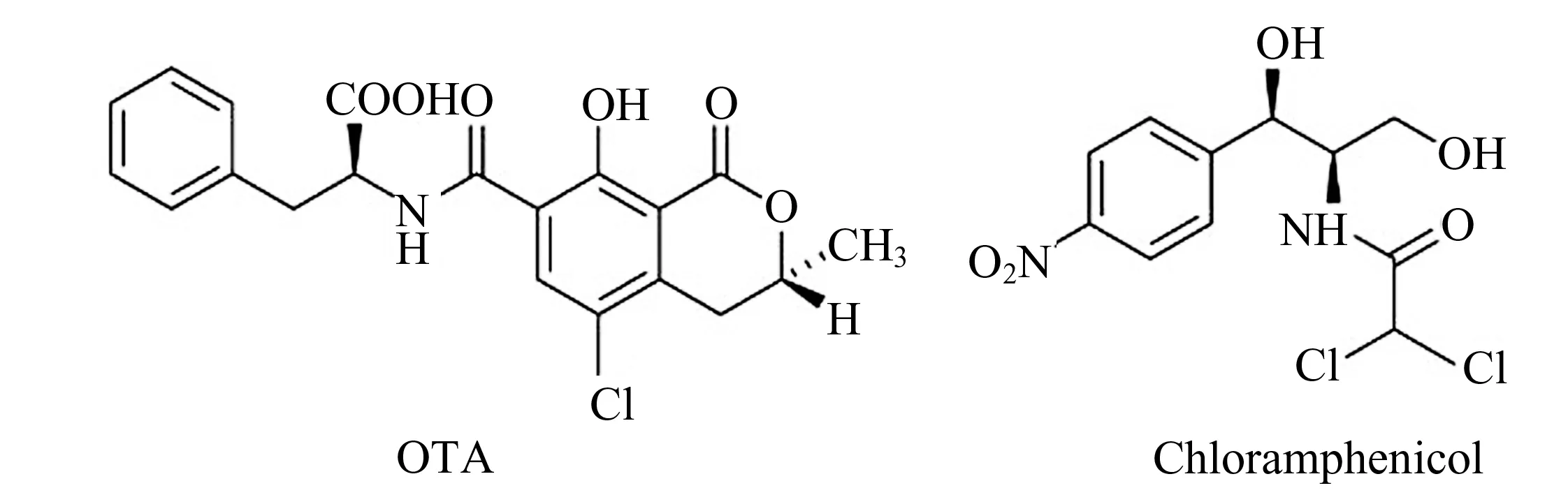
图1 赭曲霉毒素A(OTA)和氯霉素的结构式Fig.1 Structural formulas of OTA and chloramphenicol
由于赭曲霉毒素A有较强毒性和致癌性,且赭曲霉毒素A标准品价格极其昂贵,所以本文选用赭曲霉毒素A的结构相似物氯霉素作为替代模板,采用原子转移自由基聚合法[11,12]合成MIPs,赭曲霉毒素A和氯霉素的结构式如图1所示。将该MIPs作为柱填料制成固相萃取柱,替代免疫亲和柱对样品中的赭曲霉毒素A进行富集净化,然后利用高效液相色谱-荧光检测法进行检测。
1 实验部分
1.1 实验仪器与试剂
JASOV-750紫外-可见分光光度仪(日本,岛津公司);Waters 2695高效液相色谱仪(美国,沃特世公司);Waters2475荧光检测器(美国,沃特世公司)。
氯霉素(天津希恩恩生化科技有限公司);标准赭曲霉毒素A(OTA,上海阿拉丁试剂有限公司);甲醇、乙腈(色谱纯,天津赛孚瑞);偶氮二异丁腈(分析纯,天津市科密欧化学试剂);甲基丙烯酸缩水甘油酯(上海麦克林试剂有限公司)。实验用水为超纯水。
1.2 高效液相色谱条件
色谱柱:C18柱,柱长150 mm,内径4.6 mm,粒径5 μm;流动相:乙腈-水-冰乙酸(49.5+49.5+1);流速:1.0 mL/min;柱温:35 ℃;进样量:10 μL;荧光检测:激发波333 nm,发射波长460 nm。
1.3 分子印迹聚合物的合成
称取0.15 g氯霉素,加入盛有150 mL无水乙醇的三口烧瓶中,振荡溶解,加入308.75 μL甲基丙烯酸缩水甘油酯,885.65 μL乙二醇二甲基丙烯酸酯,5.75 μL氯化苄(单体和交联剂总质量的0.5%),通入氮气5 min,加16.83 mg CuCl,在机械搅拌下继续通氮气5 min,逐渐升温至86 ℃后,反应6 h,过滤得到MIPs。非印迹聚合物(Non-Imprinted Polymers,NIPs)的合成除不加氯霉素模板,其他步骤与MIPs的合成步骤一样。
将MIPs用滤纸包好,置于索氏抽提器中。加入甲醇-乙酸(4∶1,V/V)混合提取液,95 ℃下回流洗脱至回流液中检测不到氯霉素的紫外吸收峰;换纯甲醇洗脱除去残留乙酸,烘干备用。
1.4 吸附性能检测
1.4.1 等温吸附实验称取10 mg的MIPs和10 mg NIPs,分别置于5 mL离心管中,再加入3 mL的0.1~30 μg/mL不同浓度的赭曲霉毒素A溶液(乙腈∶水=1∶9,V/V),静态吸附8 h后,用高效液相-荧光检测器测定上清液中游离赭曲霉毒素A浓度。根据公式计算吸附容量(Q,μg/mg):Q=(c0-c)×V/m。式中Q为聚合物对赭曲霉毒素A的吸附容量,μg/mg;c0为吸附前赭曲霉毒素A溶液浓度,μg/mL;c为吸附后的赭曲霉毒素A溶液浓度,μg/mL;V为加入到聚合物中赭曲霉毒素A标准溶液的体积,mL;m为聚合物质量,mg。
1.4.2 吸附速率实验称取12份10 mg MIPs置于5 mL离心管中,每份样品中加入3 mL 10 μg/mL的赭曲霉毒素A溶液(乙腈∶水=1∶9,V/V),1~7号分别吸附5、10、30、40、50、60、90 s,8~12号分别吸附2、3、4、5、6 min。计算吸附不同时间后聚合物的吸附容量大小。
1.5 实际样品分析
1.5.1 固相萃取柱的制备称取100 mg 聚合物,用20 mL甲醇,湿法装于直径8 mm、长8 cm的固相萃取小柱中,萃取柱的两端(顶端和底部)均用聚四氟乙烯隔垫封口。
1.5.2 实际样品制备根据国家标准(GB/T 30955-2014)中的方法处理饲料样品:称取50 g粒度小于1 mm 的饲料样品于250 mL锥形瓶中,加入5 g NaCl和100 mL甲醇水溶液(8∶2,V/V),超声振荡30 min,过滤。取10 mL滤液用40 mL磷酸盐缓冲溶液(PBS:8 g NaCl,1.2 g Na2HPO4,0.2 g KH2PO4,0.2 g KCl,纯水稀释,HCl调节pH=7.0,纯水定容至1 000 mL)稀释。用纤维滤纸过滤,滤液备用。
1.5.3 自制固相萃取柱和免疫亲和柱的对比分别用免疫亲和柱和分子印迹固相萃取柱,对加入标准赭曲霉毒素A溶液的饲料提取液进行萃取富集。为保证自制固相萃取柱与免疫亲和柱的对比,因此免疫亲和柱和自制柱的使用操作保持一致。柱子使用前先用10 mL甲醇,2 mL纯水活化后,上样3 mL含有赭曲霉毒素A的样品提取液,控制流速为1 mL/min,然后用10 mL纯水淋洗,最后用1 mL甲醇洗脱。洗脱液使用高效液相色谱-荧光检测器测定。
2 结果与讨论
2.1 单因素实验优化
对温度,模板与单体的摩尔比,模板与交联剂摩尔比,引发剂用量4种因素做了优化实验。在单因素优化实验中得到的条件是温度86 ℃,模板∶单体∶交联剂=1∶5∶10(摩尔比),引发剂用量为0.5%。
2.2 正交实验优化
为了进一步优化聚合物的实验条件,进行了正交试验,如表1所示:因素A为反应温度;因素B为模板与单体的摩尔比例;因素C为模板与交联剂的摩尔比例;因素D为引发剂用量(单体与交联剂质量之和的百分比)。从表1中得出极差大小顺序RC>RD>RB>RA,即模板与交联剂的摩尔比例对合成的产物影响最大。从各组实验产物的吸附量来看,编号8的吸附容量最大为3.992 μg/mg,即最佳合成条件应为A3B2C1D1,跟单因素试验得出的最佳合成条件一致。故最佳合成条件为温度86 ℃,模板∶单体∶交联剂为1∶5∶10(摩尔比),引发剂的量为0.5%。

表1 正交实验优化
2.3 聚合物的表征
2.3.1 扫描电镜图2为MIPs在不同放大倍数下的扫描电镜图。由图可以看出:MIPs的整体呈蓬松状,由颗粒直径在0.5 μm左右的聚合物颗粒组成,较小的聚合物颗粒拥有更大比表面积,为MIPs良好的吸附性能提供了基础。

图2 MIPs的扫描电镜图Fig.2 Scanning electron microscope images of MIPs A:×2.00 K;B:×30.00 K.

图3 MIPs和NIPs的红外谱图Fig.3 Infrared spectra of MIPs and NIPs
2.3.2 傅里叶变换红外光谱如图3所示:MIPs在3 656 cm-1处有一个较宽的峰,是由-OH的伸缩振动引起的。在2 990 cm-1处的吸收峰由甲基中C-H伸缩振动引起。在1 740 cm-1处比较强的吸收峰是由羰基的C=O双键引起的。从MIPs和NIPs的红外图谱比较来看,无明显差别,说明在洗脱过程中模板分子已被洗脱下来。
2.4 聚合物的吸附性能

图4 MIPs和NIPs的吸附性能Fig.4 Adsorption properties of MIPs and NIPsA:Isothermal adsorption of MIPs and NIPs; B:Adsorption rates of MIPs and NIPs.

图5 赭曲霉毒素A(OTA)标准溶液、自制分子印迹固相萃取(MISPE)柱和免疫亲和柱(IAC-OTA-WB)色谱图Fig.5 Chromatograms of standard solution before and after extraction by self-made column(MISPE) and immune affinity column(IAC-OTA-WB)
研究MIPs和NIPs对不同浓度的赭曲霉毒素A溶液的吸附性能,测定0.1~30 μg/mL条件下的等温吸附。由图4A可知,当赭曲霉毒素A的浓度不断增加时,MIPs和NIPs的吸附容量也在不断地增大,赭曲霉毒素A增大到一定浓度时,吸附量的增加速率减缓。总体来说MIPs的吸附容量比NIPs的吸附容量大。图4B所示为MIPs和NIPs对赭曲霉毒素A的吸附容量随时间的变化曲线。吸附容量随着吸附时间的增加呈现正增长趋势,一定时间后,趋于稳定,此时聚合物达到吸附平衡。由图4B中可以知道MIPs对赭曲霉毒素A的吸附速率非常迅速,吸附容量在4、5、6 min相差很小,即在4 min基本达到吸附平衡,这为固相萃取快速达到平衡提供了有力保障。
2.5 实际样品分析
利用高效液相-荧光检测器分别检测赭曲霉毒素A标准溶液、用免疫亲和柱萃取液和分子印迹固相萃取柱的萃取液,实验结果如图5所示。很明显自制分子印迹固相萃取柱萃取滤液对应的赭曲霉毒素A的信号峰明显高于免疫亲和柱,说明自制柱吸附赭曲霉毒素A的效果比免疫亲和柱的效果好。
3 结论
本文采用片段印迹技术,以原子转移自由基聚合法合成分子印迹聚合物。经单因素和正交试验优化确定最佳合成条件,合成的聚合物能够快速吸附溶液中的赭曲霉毒素A,且吸附量很大。将合成的分子印迹聚合物用作填料制备了自制固相萃取柱,与免疫亲和柱对比,发现自制柱萃取效果要优于免疫亲和柱,相对于免疫亲和柱昂贵的价格和苛刻的使用条件,自制固相萃取柱在未来的生产实践中将会有更好的应用前景。

