呼肠孤病毒空斑检测方法建立
窦丽丽,陶晓莉,李婷婷,李藤菲,林家锋,李永刚
呼肠孤病毒之前是从人和动物的呼吸道或肠道中分离出来的。 它被称为呼吸(R),肠(E),孤儿(O)病毒,是因为病毒的发病机制尚不清楚,简称为呼肠孤病毒[1]。 在呼肠孤病毒科内,正呼肠孤病毒属包括感染爬行动物,鸟类和哺乳动物(包括人类)的病毒。正呼肠孤病毒分为几个亚组:第1个亚组包括哺乳动物正呼肠孤病毒(MRV); 第2个亚组包括禽呼肠孤病毒(ARV)以及从果蝠中分离出的纳尔逊海湾病毒(NBV); 第3个亚组包括从狒拂体内分离到的呼肠孤病毒(Baboon reovirus, BRV)[2]。正呼肠孤病毒包含一种由内层和外层组成的双层蛋白衣壳,正呼肠孤病毒内衣壳层加上其封闭的病毒基因组通常被称为病毒核心。病毒基因组由线性双链RNA(dsRNA)组成,分为3个大片段(L1、L2、L3),3个中片段(M1、M2、M3),4个小片段(S1、S2、S3、S4)[3]。本文研究的方向是NBV。NBV 最初从澳大利亚果蝠中分离出来,超过 40 年的时间以独立形式存在,且不与任何疾病发生关联。然而,最近已证实几种NBV病毒株是人呼吸道感染的病原体,并且从一些患有急性呼吸道疾病的患者体内分离的病原体已经表明NBV已经演变成可以在人类中传播的一种人兽共患病[4-9]。2007年,日本学者将NBV从印度尼西亚巴厘岛返回日本的患有急性呼吸道感染的患者中分离出来,并命名为Miyazaki-Bali/2007(MB)[10-11]。致病性NBV能引起人类急性呼吸道及肠道炎症,并且在东南亚地区呈逐步漫延的趋势。NBV感染者可出现流感样症状如发热、咳嗽和咽喉炎等[4,8,11-13],也可出现腹痛、水样腹泻和呕吐的症状[12]。纳尔逊海湾正呼肠孤病毒是一种具有未知人兽共患潜力的融合蝙蝠病毒[1,14-16]。以前的研究表明,NBV可以感染和复制来自其天然宿主(蝙蝠)以及人类,小鼠和猴子的各种细胞类型。在这些细胞内,NBV诱导显著的细胞病变效应,其特征在于细胞-细胞融合和合胞体形成[17-18]。对NBV致病机制的研究需对NBV-Miyazaki病毒株的滴度进行定量测定。空斑形成试验作为测定病毒滴度的金标准已经得到广泛的应用,但是有些方法不易形成空斑,因此通过本实验建立了空斑检测方法,为进一步研究呼肠孤病毒病毒所需进行的滴度检测打下了基础。
1 材料与方法
1.1材料 L929细胞由锦州医科大学病原生物学实验室常规传代保存;BSR细胞、NBV-Miyazaki病毒株由日本大阪大学馈赠。DMEM培养基、青链霉素均购自美国Gibco公司;胎牛血清(fetal bovine serum, FBS)购自美国Hyclone公司;0.25%胰酶和中性红染色液均购自Sigma公司;Mouse Anti-β-actin mAb购自北京中杉金桥公司;BactoTMAgar购自美国Becton, Dickinson and Company;NP-40裂解液购自上海碧云天公司;蛋白酶抑制剂(phenylmethyl sulfonylfluoride,PMSF)、4×蛋白上样缓冲液均购自北京索来宝科技有限公司;6×loading buffer购自大连宝生物公司;琼脂糖购自北京百晶生物技术有限公司;Trizol·ls、HRP-goat anti-mouse IgG (H+L)、Alexa Flour 594 goat anti-mouse IgG均购自Invitrogen公司;抗体NBV S3由锦州医科大学病原生物学实验室制备。
1.2方 法
1.2.1Western Blot检测目的蛋白 试验分两组:空白对照组(不感染病毒)和实验组(感染病毒),每组2个孔。L929细胞8×105细胞/孔铺6孔板,待细胞贴壁后,PBS洗3遍,NBV-Miyazaki病毒株感染细胞(对照组加PBS),置于培养箱培养1 h,PBS洗3遍,DMEM高糖培养基(含5% FBS、1%青链霉素)培养24 h。除去培养基,用PBS洗涤细胞3次,并在含有蛋白酶抑制剂(PMSF)的NP-40 buffer中裂解。将蛋白质裂解物与4×蛋白上样缓冲液混合,然后106 ℃变性10 min,用10%聚丙烯酰胺凝胶电泳(SDS-PAGE),并使用半干转移系统(Bio-Rad,USA)转移到PVDF膜上。用NBV S3(经ELISA检测,效价达1∶64 000)作为一抗,HRP-goat anti-mouse IgG (H+L)作为二抗检测目的蛋白是否存在。
1.2.2NBV-Miyazaki病毒感染细胞进行免疫荧光测定 用实验室保存的NBV-Miyazaki病毒株感染BSR细胞在24孔板中培养,PBS洗掉培养基,用4%多聚甲醛室温固定30 min,PBS洗3遍,0.1% Triton-100室温打孔10 min,洗掉后用PBS洗3遍,2% FBS封闭1 h,选择一抗NBV S3,1∶250倍稀释,37 ℃孵育1 h;PBS洗3遍;二抗为Alexa Flour 594 goat anti-mouse IgG,进行1∶500倍稀释,37 ℃避光孵育1 h。PBS洗3遍,洗最后1遍时保留PBS。使用免疫荧光显微镜进行观察和拍摄。
1.2.3NBV-Miyazaki病毒核酸电泳分析 提病毒RNA:病毒加Trizol·l s,静置5 min;加入氯仿,颠倒混匀,静置5 min;12 000 r/min离心15 min;弃上清,80%乙醇洗1次,12 000 r/min离心2 min;弃上清,室温干燥5~10 min;加10 μL RNase-Free水。加6×Loading Buffer,混匀,加样,进行水平凝胶电泳。然后紫外照相。
1.2.4空斑形成试验测定NBV-Miyazaki病毒滴度 L929细胞经0.25%胰酶消化后,以(0.8 ~ 1)×106个/孔铺12孔板,37 ℃,5% CO2条件下培养24 h。以未感染Miyazaki的细胞作为空白对照。共5个稀释度将病毒样品进行10倍梯度稀释,做2次重复,每个稀释度按图4进行接种,每孔250 μL病毒液,37 ℃,5% CO2条件下孵育,间隔 15 min摇晃1次;1 h后,吸去病毒液,将于37 ℃预热的含 5%胎牛血清的DMEM培养液与2.4% BactoTMAgar以2∶1的比例混匀,每孔加入2 mL混合物,待细胞板中覆盖物凝固后,倒置,37 ℃,5% CO2条件下培养,观察并记录细胞形成典型融合病变即空斑的时间、形态和数量。病毒感染细胞7 d后,每孔加入1 mL中性红染色液与培养基、BactoTMAgar的混合物,于 5% CO2、37 ℃培养过夜;次日,加入1 mL 4%甲醛固定细胞于冰箱固定一夜,弃去上层覆盖物,观察空斑形态,记录空斑数,并按下式计算病毒滴度。 病毒滴度(PFU/mL)=(每孔平均空斑个数×病毒稀释度倒数)/每孔病毒接种量(mL)。
2 结 果
2.1Western Blot检测NBV S3蛋白 通过Western Blot实验显示,结果如图1,经NBV-Miyazaki病毒感染的两组均能检测到病毒非结构蛋白NBV S3,未经感染的两组未能检测到蛋白。
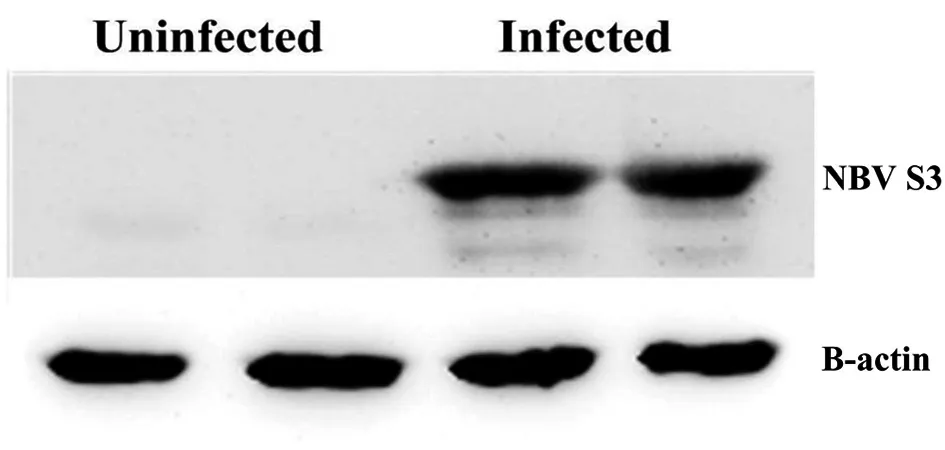
图1 Western Blot检测NBV S3蛋白Fig.1 Western Blot detection of NBV S3 protein
2.2免疫荧光检测NBV-Miyazaki病毒感染细胞 免疫荧光显示经NBV-Miyazaki病毒感染的细胞有红色荧光表达,未感染病毒的细胞未检测到非特异性的荧光标记。见图2。
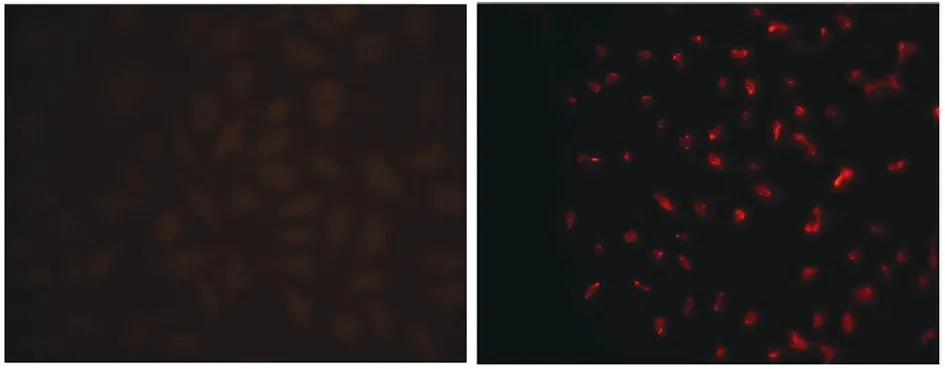
图2 免疫荧光检测病毒感染细胞(×200)Fig.2 Immunofluorescence detection of virus-infected cells (×200)
2.3NBV-Miyazaki病毒核酸电泳分析 为了验证NBV-Miyazaki病毒中核酸的成分,采用病毒RNA水平凝胶电泳。结果如图3,病毒所含核酸为具有大中小3类共10段双链 RNA(dsRNA):大基因组(L1、L2、L3),中基因组(M1、M2、M3)和小基因组(S1、S2、S3、S4)。

图3 NBV-Miyazaki病毒核酸电泳分析Fig.3 NBV-Miyazaki virus nucleic acid electrophoresis analysis
2.4用本实验方法的空斑形成试验测定NBV-Miyazaki病毒滴度 L929细胞接种 10 倍比稀释病毒液加入覆盖物7 d后,每孔加入1 mL中性红染色液与培养基、胶的混合物,于5% CO2、37 ℃培养过夜;次日,加入 1 mL 4%甲醛固定细胞,于冰箱固定一夜,弃去胶,结果如图4,观察空斑形态,记录空斑数,并按下式计算病毒滴度。 病毒滴度(PFU/mL)=(每孔平均空斑个数×病毒稀释度倒数)/每孔病毒接种量(mL)。病毒滴度为 2.2×108PFU/mL。未被病毒感染发生细胞病变区域的区域,被中性红染成红色;被病毒感染发生细胞病变处,不能被中性红染色,呈现为无色空斑。肉眼可见:空斑呈圆形或类圆形,在12孔板内散在分布,空斑较多时可以与邻近空斑形成融合现象。显微镜下可观察到形成空斑处,细胞脱落;而未形成空斑处,细胞存留。
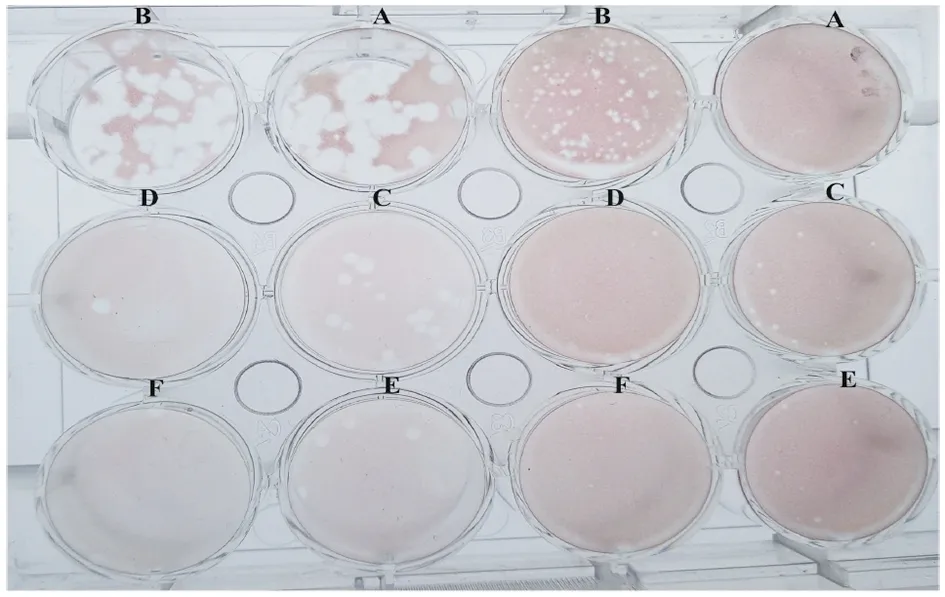
Note:A: blank control; B ~ F: virus dilution is 10-4-10-8图4 NBV-Miyazaki病毒空斑测定结果Fig.4 NBV-Miyazaki virus plaque assay results
3 讨 论
正呼肠孤病毒属广泛存在于自然界的生物中,可从多种生物体内分离,但大部分生物感染该病毒后无明显体征[19],且对人的致病性无法确定。纳尔逊海湾正呼肠孤病毒作为膜融合正呼肠孤病毒,最近被证实[4,7], 它可以从患有急性呼吸道疾病的患者中分离出来,并且这种致病性呼肠孤病毒的分离引起人们对潜伏的呼肠孤病毒传播疾病的关注。正呼肠孤病毒根据在细胞中诱导细胞的能力分为促融合正呼和非促融合正呼[20],该病毒因含有独特的RNA多聚酶,在宿主体内可利用自身 RNA 逆转录酶合成的新mRNA作为新RNA和病毒蛋白质合成的模板[21]。病毒在复制正链基础上,通过自身RNA多聚酶翻译成蛋白,合成负链,形成双链RNA分子,此后,双链RNA 与蛋白外壳重新组装,形成新的病毒粒子,致细胞破裂,在宿主体内产生大量病毒[22]。
本实验所用的NBV-Miyazaki病毒株经过Western Blot实验、免疫荧光检测病毒感染细胞验证了是可以感染细胞的,具有病毒毒力;同时进行了病毒RNA垂直电泳验证了NBV-Miyazaki病毒株的核酸成分是符合正呼肠孤病毒的基因组成分的。本实验改进的空斑形成试验准确测定出了NBV-Miyazaki病毒株的滴度,为应用此病毒株进行后续实验提供理论基础。滴度测定可以让我们知道病毒颗粒的含量,这对于之后的MOI实验是很方便的。这样就不会因为滴度过低而导致转染成功率降低,也不会因为滴度过高而浪费病毒或者引起宿主细胞的死亡。
在用本文方法之前进行了几次空斑形成实验。所用培养基为2×DMEM培养基,为500 mL高压后超纯水所溶解的DMEM粉末,按照说明加入碳酸氢钠,调节pH至7.2,与2.4%浓度的BactoTMAgar以1∶1的比例混合均匀。余下步骤均与空斑形成实验方法相同。但重复此方法几次结果均不佳。1×DMEM培养基与2.4%浓度的BactoTMAgar以1∶1的比例混合、2×DMEM培养基与2.4%浓度的BactoTMAgar以2∶1的比例混合均效果不佳。但用本文所述1×DMEM培养基与BactoTMAgar 2∶1混合所得结果如图4,空斑清晰可见。用将目前已知的几种测定病毒滴度的方法进行比较,其中TCID50法限制较多,不容易观察,而空斑法易于观察和计数;FFU法(间接免疫荧光法)需要抗体等,所耗费用较多、成本较高,但空斑法耗费较少、节约成本;CMC(羧甲基纤维素钠)法不容易得到结果,方法不成熟,而空斑法适用于大多数病毒,有着大量的报道和研究;细胞病变法观察结果主观因素大, 而空斑法较为客观,细胞病变法以阳性结果作为判定, 病变程度判定不准确, 空斑法以斑数判定结果较准确。本实验建立的空斑检测方法,对于测定呼肠孤病毒滴度较为准确。空斑试验是测定病毒滴度的经典方法,说服力强,已经有多个文献报道和记载。每一个空斑代表一个感染性病毒颗粒的繁殖,被破坏的死细胞不能被染色从而呈现白斑。该方法简单、经济、方便,可准确计算出病毒感染的单位数量,可用于基础研究,实验结果可长期保存。因此,综上所述,本文空斑检测方法成功建立,为后续进一步研究呼肠孤病毒奠定了基础。
利益冲突:无

