基于不同稳定剂纳米金冷融指示剂的制备及稳定性研究
李安琪
(墨尔本大学兽医和农业科学学院,澳大利亚墨尔本 VIC3010)
冷冻保藏是目前最常用的保藏手段之一[1],既可以最大限度地保持食品的风味质构及营养价值,又可以抑制大部分微生物的生长繁殖。但冷冻保藏不能起到杀菌作用,在冷冻条件下,仍然有许多微生物甚至致病菌具有代谢活性和治病能力,一旦出现温度浮动,残存的细菌就会快速生长繁殖[2-3],但目前在家庭条件下很难对其进行检测和判断。而纳米金能与致病微生物结合[4],粒径发生改变而导致颜色变化,且不影响其生物活性,被广泛应用于生物化学、医学检测和食品安全等领域[5-6]。因此,本文拟制备一种纳米金冷融指示剂,将其单独包装加入到食品当中,食用前可通过观察指示剂的颜色变化判断食品的质量,简易快捷,既能起到指示剂的作用,又不存在与食品或人体直接接触的情况。
目前制备纳米金溶胶的方法主要为氯金酸还原法,即使用还原剂还原氯金酸溶液制得可溶性纳米金颗粒的稳定溶胶[7-8]。但是,在合成时仅加入还原剂还原氯金酸,无法控制合成的纳米金颗粒粒径的大小[9-10]。纳米金颗粒的形成是晶核成长的过程,在制取纳米金颗粒时加入稳定剂,可以有效地阻止粒子间的聚集。稳定剂可以吸附在已经生成的金颗粒的表面,形成空间位阻,阻止晶核的进一步成长,达到控制粒子尺寸的作用,所以纳米金颗粒的大小尺寸与稳定剂的种类和用量有着密切的关系[11-14],但关于稳定剂对合成纳米金颗粒相关性质的研究较少[15-17]。
因此,本文选择柠檬酸三钠、海藻酸钠、壳聚糖3种不同性质的稳定剂分别制备纳米金溶胶,以其冷冻前后溶胶颜色的变化、离子体吸收峰的峰值、纳米金颗粒的粒径大小为考察指标,考察不同种类、不同浓度稳定剂对纳米金冷融指示剂指示效果的影响,以期为纳米金冷融指示剂的制备及其在冷冻食品中的应用提供理论基础和数据支撑。
1 材料与方法
1.1 材料与仪器
氯金酸(分析纯) 上海麦克林生化科技有限公司;海藻酸钠(中等分子量)、海藻酸钠(低分子量)、柠檬酸三钠(分析纯) Sigma公司;壳聚糖(分析纯) Aladdin Industrial Corporation;硼氢化钠(分析纯) 国药集团化学试剂有限公司;氢氧化钠(分析纯) 西陇化工股份有限公司;冰醋酸(分析纯) 广州金华大化学试剂有限公司;硝酸、盐酸(分析纯) 南京化学试剂股份有限公司。
UV Blue Start A紫外可见分光光度计 北京LabTech仪器有限公司;Fisher Scientific磁力搅拌器 赛默飞世尔科技公司;HH-1数显恒温水浴锅 江苏荣华仪器制造有限公司;MODEL86pH计 上海Thermo Electron 公司;DZG-6021真空干燥箱 上海森信实验设备有限公司;DHP120恒温培养箱 上海实验仪器厂有限公司;YC-300L冰箱 中科美菱公司;EL204电子天平(感量:0.0001 g) Mettler-Toledo仪器上海有限公司;NUT-Ⅱ-5T优普超纯水机 超纯科技公司;Tecnai 12透射电子显微镜 FEI电子光学有限公司;TD24-WS离心机 长沙湘智离心机仪器有限公司;DK-98-Ⅱ电子调温万用电炉 天津市泰斯特仪器有限公司;MCR301流变仪 奥地利安东帕有限公司。
1.2 实验方法
1.2.1 基于不同稳定剂纳米金溶胶的制备
1.2.1.1 以柠檬酸三钠为稳定剂合成纳米金颗粒 a. 1%的柠檬酸三钠溶液的配制:称取1.0 g(精确至0.0001 g)柠檬酸三钠固体置于100 mL的容量瓶中,去离子水定容至刻度,摇匀。
b. 0.25 mmol/L的氯金酸溶液配制:称取0.083 g(精确至0.0001 g)氯金酸粉末1000 mL的容量瓶中,去离子水定容至刻度,摇匀,于4 ℃冰箱中密封避光保存。
c.以柠檬酸三钠为稳定剂和还原剂的纳米金溶胶的制备:分别取100 mL的0.25 mmol/L的氯金酸溶液置于两个250 mL的烧杯中,置于电炉上搅拌加热至沸腾,5 min后,分别加入1.6、2.0 mL质量分数为1%的柠檬酸三钠,继续加热3 min,颜色由浅黄色变为深蓝色再逐渐变为酒红色。继续沸腾15~30 min后,关闭电炉,自然降温至室温,得到以柠檬酸三钠为稳定剂的纳米金溶胶。
1.2.1.2 以海藻酸钠为稳定剂合成纳米金颗粒 a.不同浓度海藻酸钠溶液的配制:分别准确称取3.0、4.0 g中等分子量及5.0 g低等分子量的海藻酸钠,置于3个500 mL烧杯中,加入200 mL去离子水,于磁力搅拌器上搅拌至其完全溶解。分别得到质量分数为1.5%、2.0%、2.5%的海藻酸钠溶液,室温下密封保存。
b.不同浓度氯金酸溶液的配制:分别准确称取0.0340、0.0272、0.0204、0.0136 g氯金酸粉末,置于4个100 mL容量瓶中,去离子水定容至刻度,摇匀,分别得到浓度为1.0、0.8、0.6、0.4 mmol/L的氯金酸溶液,于4 ℃冰箱中密封保存。
c.以海藻酸钠为稳定剂的纳米金溶胶的制备:分别取质量分数为1.5%的海藻酸钠溶液30 mL置于4个100 mL烧杯中,于75 ℃的磁力搅拌器下加热搅拌,分别加入10 mL浓度为1.0、0.8、0.6、0.4 mmol/L的氯金酸溶液,加入10 mL的去离子水,搅拌1 h,得到以海藻酸钠为稳定剂的纳米金溶胶。
以质量分数为2.0%、2.5%海藻酸钠溶液为稳定剂的纳米金溶胶制备方法同上。
1.2.1.3 以壳聚糖为稳定剂合成纳米金颗粒 a. 20 mmol/L氯金酸溶液的配制:准确称取0.136 g氯金酸粉末,置于20 mL的容量瓶中,去离子水定容至刻度,得到浓度为20 mmol/L的氯金酸溶液,于4 ℃冰箱中密封保存。
b. 0.4 mol/L硼氢化钠溶液的配制:准确称取0.575 g硼氢化钠粉末,置于50 mL的容量瓶中,pH为10~12的氢氧化钠溶液定容至刻度,得到浓度为0.4 mol/L的硼氢化钠溶液,于4 ℃冰箱中密封保存。
c.不同浓度壳聚糖溶液的配制:分别准确称取0.20、0.10、0.05 g壳聚糖粉末,置于3个250 mL烧杯中,加入100 mL 1%的醋酸溶液,于磁力搅拌仪上搅拌2 h,分别得到质量分数为0.2%、0.1%、0.05%的壳聚糖溶液。
d.以壳聚糖为稳定剂的纳米金溶胶的制备:分别取质量分数为0.2%的壳聚糖溶液39 mL置于4个100 mL烧杯中,分别加入0.4、0.5、0.6、0.7 mL浓度为20 mmol/L的氯金酸溶液,于磁力搅拌仪上搅拌45 min后,加入0.3 mL浓度为0.4 mol/L的硼氢化钠溶液,继续搅拌60 min,得到以壳聚糖为稳定剂的纳米金溶胶。
以质量分数为0.1%、0.05%壳聚糖溶液为稳定剂的纳米金溶胶制备方法同上。
1.2.2 纳米金溶胶的冷冻条件 将制备得到的纳米金溶胶置于-25 ℃的条件下冷冻24 h,取出解冻24 h,再放入-25 ℃的条件下冷冻24 h,反复进行冷冻解冻,直至其颜色发生明显变化。
1.2.3 纳米金溶胶的稳定性研究
1.2.3.1 纳米金溶胶颜色的观察 将冷冻前后的纳米金溶胶置于黑色灯箱中拍摄照片,观察冷冻前后纳米金溶胶的颜色、透明度和均匀性。
1.2.3.2 纳米金溶胶吸收波长的测定 采用紫外可见分光光度计(UV-Vis)对冷冻前后的纳米金溶胶进行全波长扫描,测定纳米金颗粒等离子体吸收峰及其峰值。
1.2.3.3 纳米金颗粒粒径的测定 使用透射电子显微镜对冷冻前后的纳米金溶胶进行观察,测定纳米金颗粒的粒径大小,观察其冷冻前后颗粒间的聚集情况。
2 结果与分析
2.1 以柠檬酸三钠为稳定剂制备得到的纳米金溶胶稳定性研究
2.1.1 以柠檬酸三钠为稳定剂制备得到的纳米金溶胶的颜色 按照1.2.3.1节方法,观察冷冻前后纳米金溶胶的颜色、透明度和均匀性,冷冻前后的纳米金溶胶颜色变化情况如图1所示,冷冻前的纳米金溶胶颜色为酒红色,溶胶透明、均一,经一次24 h冷冻后,纳米金溶胶的颜色由酒红色变为无色透明,且有少量黑色颗粒沉淀在瓶底。柠檬酸三钠纳米金溶胶经一次24 h冷冻后,颜色就变为无色透明,说明其稳定性较差,不符合冷融指示剂的要求,因此没有进一步考察不同浓度氯金酸对柠檬酸三钠纳米金溶胶稳定性的影响。
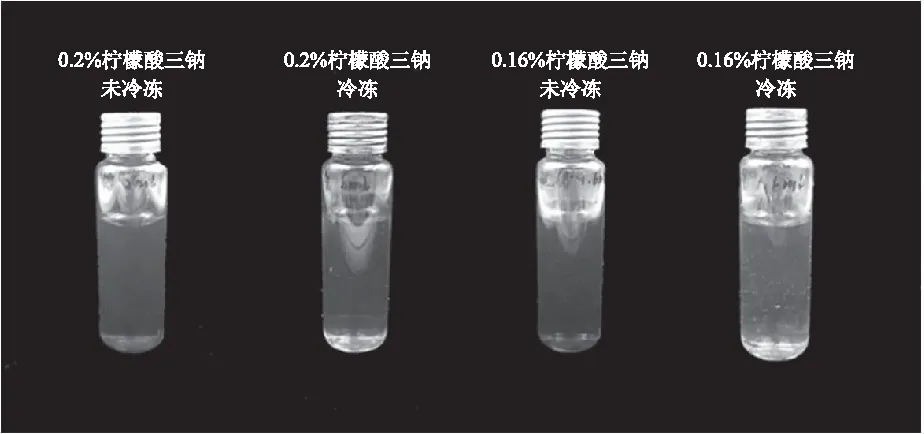
图1 以柠檬酸三钠为稳定剂制备得到的纳米金溶胶冷冻前后颜色对比图
2.1.2 以柠檬酸三钠为稳定剂制备得到的纳米金溶胶的吸收波长 按照1.2.3.2节方法,采用紫外可见分光光度计(UV-Vis)对冷冻前后的纳米金溶胶进行全波长扫描,以柠檬酸三钠为稳定剂制备得到的纳米金溶胶冷冻前后的光谱图如图2所示。结果表明,冷冻前不同浓度柠檬酸三钠合成的纳米金溶胶均在515 nm处出现明显吸收峰,其峰值处于510~530 nm之间,符合纳米金颗粒的表面等离子特性;以浓度为0.2%柠檬三钠所制备的纳米金溶胶的峰值明显高于0.16%柠檬三钠所制备的纳米金溶胶,说明0.2%柠檬酸三钠还原的纳米金颗粒数量多于0.16%所还原的量;且0.16%柠檬酸三钠所制备的纳米金溶胶的半峰宽大于0.2%柠檬酸三钠所制备的纳米金溶胶的半峰宽,表示0.16%还原的纳米金颗粒粒径大于0.2%还原的纳米金颗粒。
由图2可知,纳米金溶胶经一次24 h冷冻后,没有明显吸收峰,说明此时的溶胶中纳米金含量接近于零,再次说明柠檬酸三钠纳米金溶胶经冷冻后稳定性较差,与其颜色观察结果一致。
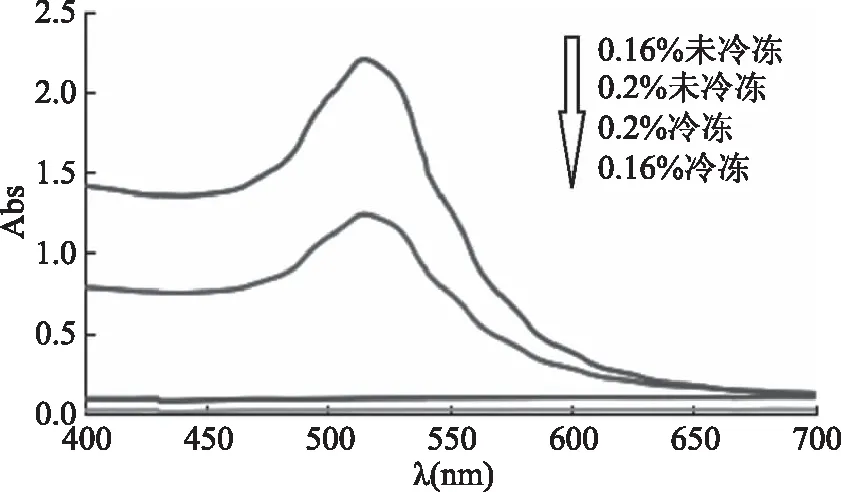
图2 以柠檬酸三钠为稳定剂制备得到的纳米金溶胶冷冻前后的光谱图
2.1.3 以柠檬酸三钠为稳定剂制备得到的纳米金颗粒粒径的测定 按照1.2.3.3节方法,使用透射电子显微镜对以0.2%柠檬酸三钠为稳定剂制备得到的纳米金溶胶进行观察,如图3所示。前面的研究结果表明,柠檬酸三钠纳米金溶胶的稳定性较差,在此不再对其不同浓度颗粒的粒径进行比较,仅对其中一个浓度颗粒的粒径进行测量。
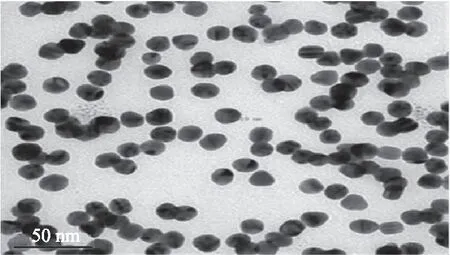
图3 以0.2%柠檬酸三钠为稳定剂制备得到的纳米金颗粒透射电镜图
结果表明,0.2%柠檬酸三钠所制得的纳米金颗粒大小均匀,颗粒分散稳定,测量的颗粒粒径为15.19 nm。
2.2 以海藻酸钠为稳定剂制备得到的纳米金溶胶稳定性研究
2.2.1 不同浓度海藻酸钠对纳米金溶胶稳定性的影响 按照1.2.3.2节方法,采用紫外可见分光光度计(UV-Vis)对不同浓度的海藻酸钠和1 mol/L的氯金酸所制备得到的纳米金溶胶进行全波长扫描,考察不同浓度海藻酸钠溶液对纳米金溶胶最大吸收波长的影响,不同浓度的海藻酸钠和1 mol/L的氯金酸所制备得到的纳米金溶胶光谱图如图4所示。结果表明,纳米金溶胶的最大吸收波长随着海藻酸钠浓度的变化而变化,说明海藻酸钠的浓度影响着纳米金颗粒的稳定性。其浓度越低或分子量越低,起到的保护和稳定作用就越小,制备的纳米金颗粒就越不稳定,2.0%中等分子量的海藻酸钠所制备的纳米金颗粒较为稳定,因此选定2.0%中等分子量的海藻酸钠作为稳定剂进行纳米金溶剂的制备。

图4 不同浓度的海藻酸钠和1 mol/L的氯金酸所制备得到的纳米金溶胶光谱图
2.2.2 不同浓度氯金酸对纳米金溶胶稳定性的影响
2.2.2.1 不同浓度氯金酸对海藻酸钠纳米金溶胶颜色的影响 按照1.2.3.1节方法,考察不同浓度氯金酸溶液对纳米金溶胶颜色的影响,2.0%海藻酸钠分别和0.4、0.6、0.8、1.0 mmol/L氯金酸溶液所制备得到纳米金溶胶,结果如图5所示,其颜色均为红色,随氯金酸浓度的增加而加深,说明随着氯金酸浓度的增加,所还原的纳米金颗粒含量越多,即2.0%海藻酸钠和1.0 mmol/L氯金酸溶液所制备得到纳米金溶胶中纳米金颗粒含量最高。

图5 2.0%海藻酸钠和不同浓度氯金酸溶液所制备得到的纳米金溶胶颜色对比图
按照1.2.2节的条件,考察反复冷冻解冻对2.0%海藻酸钠和1.0 mmol/L氯金酸所制备的纳米金溶胶颜色的影响,结果如图6所示。结果表明,冷冻前纳米金溶胶的颜色为正红色,经两次冷冻后,其颜色发生了明显的变化,由红色变为紫色,且其颜色随着冷冻次数的增加逐渐加深,第四次冷冻解冻后,颜色为深紫色。2.0%海藻酸钠和1.0 mmol/L氯金酸溶液所制备的纳米金溶胶经一次24 h冷冻后颜色由红色变为紫色,发生明显变化,且随着冷冻次数的增加紫色依次加深,说明其稳定性较好。

图6 2.0%海藻酸钠和1.0 mmol/L氯金酸所制备的纳米金溶胶冷冻前后颜色对比图
2.2.2.2 不同浓度氯金酸对海藻酸钠纳米金溶胶最大吸收波长的影响 按照1.2.3.2节方法,采用紫外可见分光光度计(UV-Vis)对2.0%海藻酸钠和不同浓度的氯金酸所制备得到的纳米金溶胶进行全波长扫描,考察不同浓度氯金酸溶液对纳米金溶胶最大吸收波长的影响,2.0%海藻酸钠和不同浓度的氯金酸所制备得到的纳米金溶胶光谱图如图7所示。结果表明,氯金酸浓度分别为0.4、0.6、0.8、1.0 mmol/L时,其对应的AuNPs/SA最大吸收波长分别为506、510、516、537 nm。说明随着氯金酸浓度的增加,AuNPs/SA的最大吸收波长出现红移现象。这可能是因为随着氯金酸浓度的增加,可以被还原的Au3+增加,生成的Au0就越多,即1.0 mmol/L氯金酸生成的纳米金颗粒含量最多,这与其颜色的观察结果一致。
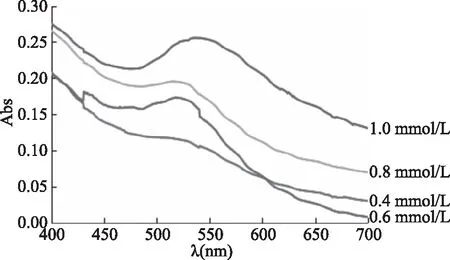
图7 2.0%海藻酸钠和不同浓度的氯金酸所制备得到的纳米金溶胶光谱图
按照1.2.2节条件,考察反复冷冻解冻对纳米金溶胶吸收波长的影响。采用紫外可见分光光度计(UV-Vis)对冷冻前后的2.0%海藻酸钠和不同浓度氯金酸所制备得到的纳米金溶胶进行全波长扫描,2.0%海藻酸钠与不同浓度氯金酸所制备的纳米金溶胶冷冻前后光谱对比图如图8所示。结果表明,0.8 mmol/L氯金酸所制备的纳米金溶胶冷冻前和一次24 h冷冻后的最大吸收峰分别为516和526 nm,0.6 mmol/L氯金酸所制备的纳米金溶胶冷冻前和一次24 h冷冻后的最大吸收峰分别为510和524 nm。其最大吸收峰均发生了红移,冷冻后吸光度均大于冷冻前,半峰宽度变大。以上现象与冷冻后其颜色加深,由红色变为紫色的现象一致,表明冷冻后的纳米金颗粒稳定性变差,粒径增大。
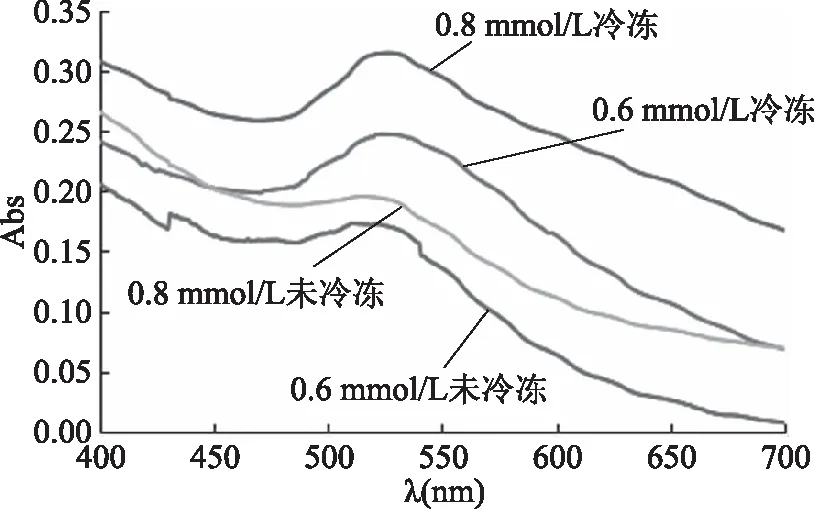
图8 2.0%海藻酸钠和不同浓度的氯金酸所制备得到的纳米金溶胶冷冻前后光谱对比图
2.2.2.3 不同浓度氯金酸对海藻酸钠纳米金颗粒粒径的影响 按照1.2.3.3节方法,使用透射电子显微镜对以2.0%海藻酸钠为稳定剂制备得到的纳米金溶胶进行观察,图9和图10分别为2%海藻酸钠与浓度为0.6、0.8 mmol/L氯金酸所制备的纳米金溶胶电镜图。由图9可知,2.0%海藻酸钠和0.6 mmol/L的氯金酸所制备得到的纳米金颗粒平均粒径为9 nm,由图10可知,2.0%海藻酸钠和0.8 mmol/L的氯金酸所制备得到的纳米金颗粒平均粒径为15 nm。结果表明,两种纳米金颗粒分散且大小较均匀,0.8 mmol/L的氯金酸所制备得到的纳米金颗粒粒径明显大于0.6 mmol/L所制备的纳米金颗粒。这可能是因为随着氯金酸浓度的增加,被还原的Au3+越多,生成的Au0也越多,SA的稳定和保护作用就变得不够稳定,所以其粒径会增大,这与光谱扫描结果一致。

图9 2.0%海藻酸钠和0.6 mmol/L的氯金酸所制备得到的纳米金颗粒透射电镜图

图10 2.0%海藻酸钠和0.8 mmol/L的氯金酸所制备得到的纳米金颗粒透射电镜图
2.0%海藻酸钠和1.0 mmol/L氯金酸所制备的纳米金颗粒冷冻前后透射电镜对比图如图11所示,a图为冷冻前的纳米金溶胶,b图为冷冻后的纳米金溶胶。结果表明,反复冷冻后的纳米金颗粒,因受到温度的影响,其颗粒之间发生了聚集,由单一分散的状态明显变为聚集成团,符合纳米金冷融指示剂的要求,因此说明2.0%海藻酸钠和1.0 mmol/L氯金酸所制备的纳米金溶胶是一种良好的纳米金冷融指示剂。
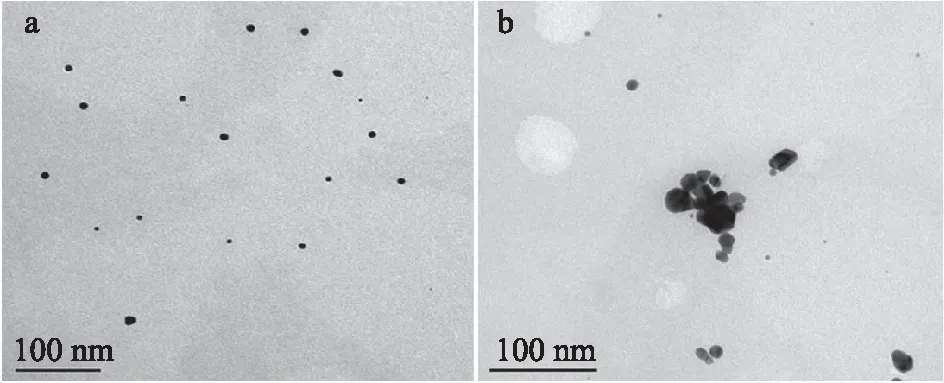
图11 2.0%海藻酸钠和1.0 mmol/L氯金酸所制备的纳米金颗粒冷冻前后透射电镜对比图
2.3 以壳聚糖为稳定剂制备得到的纳米金溶胶稳定性研究
2.3.1 不同浓度壳聚糖对纳米金溶胶稳定性的影响 按照1.2.3.1节方法,考察不同浓度壳聚糖对纳米金溶胶颜色的影响,结果如图12所示。结果表明,0.05%、0.10%、0.20%壳聚糖与0.07‰氯金酸溶液制备得到的纳米金溶胶颜色均为酒红色,说明壳聚糖浓度对纳米金溶胶稳定性影响不大,因此选定中间浓度的壳聚糖进行纳米金溶胶的制备,即0.10%的壳聚糖。

图12 不同浓度壳聚糖与0.07‰氯金酸溶液制备得到的纳米金溶胶颜色对比图
2.3.2 不同浓度氯金酸对壳聚糖纳米金溶胶稳定性的影响
2.3.2.1 不同浓度氯金酸对壳聚糖纳米金溶胶颜色的影响 按照1.2.3.1节方法,考察不同浓度氯金酸对纳米金溶胶颜色的影响,结果如图13所示。结果表明,0.1%壳聚糖与0.07‰、0.09‰、0.10‰、0.12‰氯金酸溶液制备得到的纳米金溶胶颜色均为酒红色,说明氯金酸浓度对纳米金溶胶稳定性影响不大。

图13 0.1%壳聚糖与不同浓度氯金酸溶液制备得到的纳米金溶胶颜色对比图
按照1.2.3.1节方法,观察冷冻前后纳米金溶胶颜色的变化,结果如图14所示。结果表明,1%壳聚糖与0.07‰、0.09‰、0.10‰、0.12‰氯金酸溶液制备得到的纳米金溶胶经一次24 h冷冻后,会出现明显的分层现象,上层颜色变浅为粉红色,但瓶底部的颜色没有发生明显变化,仍为酒红色。说明以壳聚糖为稳定剂制备得到的纳米金溶胶稳定性较差。

图14 0.1%壳聚糖与不同浓度氯金酸溶液制备得到的纳米金溶胶冷冻前后颜色对比图
2.3.2.2 不同浓度氯金酸对壳聚糖纳米金溶胶最大吸收波长的影响 按照1.2.3.2节方法,采用紫外可见分光光度计(UV-Vis)对0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶进行全波长扫描,考察不同浓度氯金酸溶液对纳米金溶胶最大吸收波长的影响,0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶光谱图如图15所示,结果表明,所制备的纳米金溶胶最大吸收波长均为515 nm,符合纳米金颗粒的表面等离子特性。随着氯金酸含量的增加,其吸光度越大,表明壳聚糖起到的稳定作用就越小。
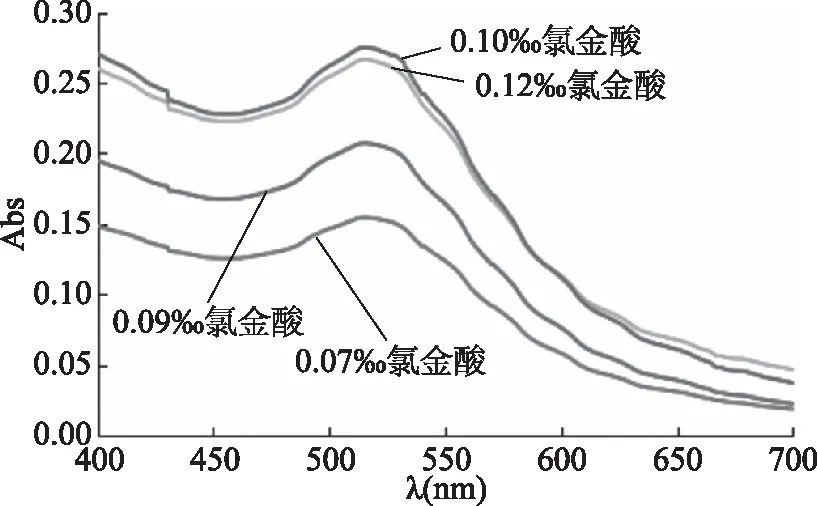
图15 0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶光谱图
按照1.2.3.2节方法,采用紫外可见分光光度计(UV-Vis)对冷冻前后的0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶进行全波长扫描,0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶冷冻前后光谱对比图如图16所示。结果表明,冷冻后的纳米金溶胶最大吸收波长处吸光度均下降,说明冷冻后的纳米金溶胶中的纳米金含量均有所减少。
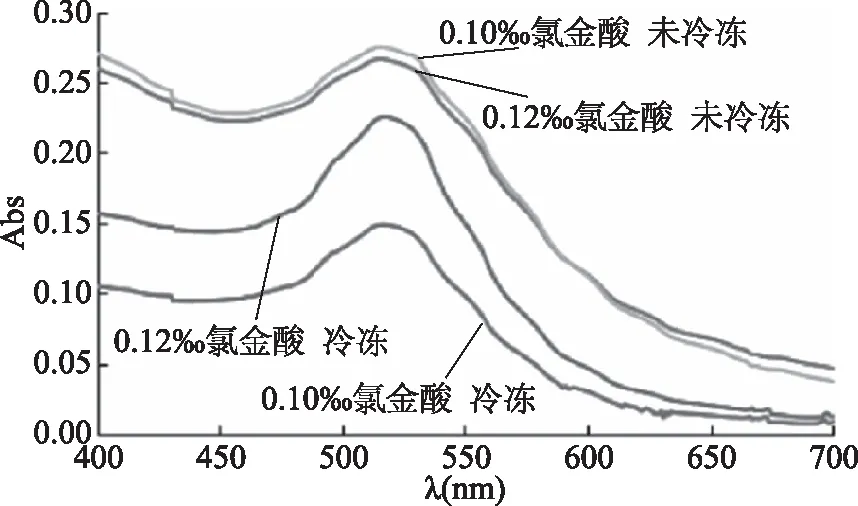
图16 0.1%壳聚糖和不同浓度氯金酸所制备得到的 纳米金溶胶冷冻前后光谱对比图
2.3.2.3 不同浓度氯金酸对壳聚糖纳米金颗粒粒径的影响 按照1.2.3.3节方法,使用透射电子显微镜对0.1%壳聚糖和不同浓度氯金酸所制备得到的纳米金溶胶进行观察,图17和图18分别为0.1%壳聚糖与浓度为0.09‰、0.07‰氯金酸所制备的纳米金溶胶电镜图。结果表明,0.1%壳聚糖与浓度为0.09‰、0.07‰氯金酸所制备的纳米金颗粒均成球型,大小较为均匀,但0.07‰氯金酸溶液所制备的纳米金颗粒的分散性较好。

图17 0.1%壳聚糖和0.09‰氯金酸所制备的纳米金颗粒透射电镜图

图18 0.1%壳聚糖和0.07‰氯金酸所制备的纳米金颗粒透射电镜图
0.1%壳聚糖和0.07‰氯金酸所制备的纳米金颗粒冷冻前后透射电镜对比图如图19所示,a图为冷冻前的纳米金溶胶,b图为冷冻后的纳米金溶胶。结果表明,冷冻前纳米金颗粒较均匀,单一分散性较好,冷冻后纳米金颗粒明显聚集成团,且颗粒大小不够均一。
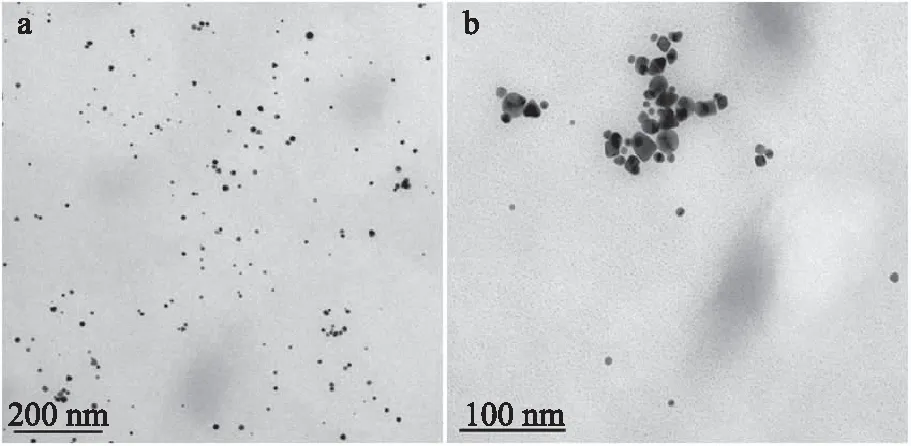
图19 0.1%壳聚糖和0.07‰氯金酸所制备的纳米金颗粒冷冻前后透射电镜对比图
3 结论
以柠檬酸三钠为稳定剂所制备的纳米金溶胶颜色虽可以发生突变,由酒红色变为透明无色,但其经一次冷冻就会发生上述变化,稳定性较差;以壳聚糖为稳定剂所制备的纳米金溶胶,其颗粒经冷冻后虽会聚集,但颜色不会发生明显变化,且其溶胶会发生明显分层现象,说明以壳聚糖为稳定剂制备得到的纳米金溶胶稳定性较差;以上现象均不符合对指示剂的要求。以海藻酸钠为稳定剂所制备的纳米金溶胶效果最为理想:2.0%海藻酸钠与10 mL的1.0 mmol/L氯金酸溶液所制备的纳米金溶胶在反复冷冻2~3次后,其颜色会发生明显变化,由正红色变为紫色,且其颜色随冷冻次数的增加而加深;反复冷冻后的纳米金颗粒,因受到温度的影响,其颗粒之间会发生聚集,由单一分散的状态明显变为聚集成团。以上现象均符合纳米金冷融指示剂的要求,海藻酸钠为稳定剂所制备的纳米金溶胶是一种良好的纳米金冷融指示剂。

