Nanog蛋白在大肠杆菌中的可溶性表达及发酵优化
李正杰,顾正华,石贵阳,李由然,辛瑜,2,张梁*
1(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214000)2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214000)
Nanog是2003年被发现对维持胚胎干细胞自我更新和多能性起关键作用的一个基因[1],能够独立于 LlF/Stats途径维持内细胞团(inner cell mass, ICM)和胚胎干细胞的多能性[2]。它通过转录来调节人类胚胎干细胞的S期,从而维持胚胎干细胞自我更新的功能。Nanog属于ANTP 类 NK(natural killer)家族基因,定位于人的12号染色体 12p13上[3-4]。对Nanog的功能,与疾病之间的关系以及肿瘤作用机理等问题的研究在临床疾病控制与治疗方面都有重要意义[5-7],Nanog的表达很大程度上被认为是人类的内部细胞团胚泡未分化程度高的表现[8]。另外Nanog对于细胞由去分化的中间体过渡到基态多能性来说是必不可少的[9],Nanog蛋白在上皮间质转化中也起着重要作用[10]。近年来,随着研究Nanog基因及其蛋白的功能、作用机制以及与其他因子或信号的相互关系日益增多,对Nanog蛋白及多克隆抗体的需求量也越来越大。
长期以来Nanog蛋白主要通过从动物细胞中分离提取,其缺点在于过程繁琐且产率低。李军等[11]通过大肠杆菌成功实现了小鼠来源的Nanog蛋白表达,但产物为包涵体;张经余等[12]通过大肠杆菌实现了人源Nanog假基因NanogP8蛋白的原核表达,产物也为包涵体,目前虽然存在市售人源Nanog蛋白,但并无人源Nanog蛋白原核表达的相关实验研究报道,且市售人源Nanog蛋白价格昂贵,如艾博抗公司的5 μgNanog蛋白售价为1 595元。因此,为了降低人源Nanog蛋白的成本,满足医学实验研究,也方便后续大量制备Nanog多克隆抗体,本研究通过构建pET32a-Nanog重组质粒并转入到大肠杆菌中,实现人源Nanog蛋白与硫氧还蛋白的可溶性融合表达,最终经肠激酶酶切后得到Nanog蛋白。摇瓶优化诱导温度、诱导剂含量及不同补料碳源,并在15 L发酵罐上以分批-补料发酵的形式考察不同溶氧水平、温度控制方式对菌体产蛋白的影响,为进一步大规模制备Nanog蛋白及多克隆抗体奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
大肠杆菌DH5α、BL21(DE3)、载体pET32a(+)和pMD19-T Simple Vector均为本实验室保存。
1.1.2 试剂与培养基
种子培养基(g/L):胰蛋白胨10、酵母提取物5、NaCl 10,115 ℃灭菌20 min。
斜面保藏培养基(g/L):胰蛋白胨10、酵母提取物5、NaCl 10、琼脂15~20,115 ℃灭菌20 min。
发酵培养基(g/L):葡萄糖20、蛋白胨12、酵母粉24、K2HPO43、MgSO4·7H2O 0.8、(NH4)2SO45,115 ℃灭菌20 min。
补料培养基:质量分数为35%的甘油溶液。
试剂:TaqDNA聚合酶、限制性内切酶,加拿大Fermentas 公司;酵母膏、胰蛋白胨、质粒小量提取试剂盒、DNA片段纯化试剂盒、胶回收试剂盒,北京博大泰克生物技术公司;氨苄霉素、兔抗Nanog多克隆抗体及羊抗兔的二抗、核糖核酸酶(Ribonuclease),生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.1.3 仪器与设备
BoltTMMini Gel Tank、iBlotTM2 Gel Transfer Device、iBindTMWestern Systern,美国Thermo Fisher Scientific公司;SCG蛋白纯化系统,苏州赛谱仪器有限公司;S100D型PCR仪,美国BIO-RAD公司;CF16RX Ⅱ冷冻离心机,日本HITACHI公司;V-1200分光光度计,上海美谱达仪器公司;高压蒸汽灭菌锅,上海民仪电子有限公司;HYL-C型组合式摇床,太仓市实验设备厂;T&J Atype 15 L发酵罐,上海迪必尔生物工程有限公司。
1.2 实验方法
1.2.1 重组大肠杆菌表达质粒的构建
NCBI数据库中查询得到人源Nanog基因序列(GenBanK:AY230262.1),基于大肠杆菌偏好性完成密码子优化,由生工生物工程(上海)有限公司合成。以合成的Nanog基因为模版设计引物P1(5-CGGAATTCATGAGTGTGGATCCAGCTTG-3),P2(5-CCC-TCGAGCACGTCTTCAGGTTGCATGT-3),进行PCR扩增,95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸70 s,30个循环,16 ℃保温10 min。然后把PCR片段Nanog通过T/A克隆连入pMD19T-Simple,经测序验证正确。用EcoR I和XhoI对pMD19T-Nanog进行双酶切然后胶回收目的片段,用T4DNA连接酶将目的片段连接至经相同双酶切后的pET32a载体中,得到重组质粒pET32a-Nanog。向准备好的大肠杆菌DE3感受态中加入适量的质粒pET32a-Nanog,经热击处理后轻轻混匀,于37 ℃、200 r/min摇床培养2.5 h。离心收集菌体,弃掉部分上清液后留100 μL重悬菌体,涂布于含有氨苄霉素的LB培养基平板,37 ℃培养10 h,挑取转化子进行菌落PCR验证,将验证正确的转化子经摇瓶培养后保存并提取质粒送到上海生工测序,得到大肠杆菌BL21(DE3)/pET32a-Nanog重组菌株。
1.2.2 重组Nanog蛋白的粗发酵液制备
将重组大肠杆菌BL21(DE3)/ pET32a-Nanog接种于斜面培养基,12 h后从斜面培养基中挑取单菌落接种于装液量为50 mL LB液体培养基的250 mL三角瓶中,在37 ℃、200 r/min振荡培养12 h,以此作为种子液。将培养好的种子液按体积分数2%接种量转接至250 mL的三角瓶中,LB液体培养基装液量为50 mL,于37 ℃、200 r/min培养至OD600为0.6左右后,加入终浓度为0.2 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)。置于37 ℃、200 r/min摇床诱导培养5 h。将发酵液于4 ℃、12 000 r/min离心5 min收集菌体,弃上清液,用Tris-HCl缓冲液(25 mmol/L Tris,pH 7.4)清洗并重悬菌体。采用超声波破碎法破碎细胞,冷冻离心后所得上清液即为粗蛋白液。
1.2.3 重组Nanog蛋白的纯化
将经超声破碎及冷冻离心后粗蛋白液用5 mL镍离子柱对其进行纯化。先用40 mL A液(25 mmol/L Tris-HCl、500 mmol/L NaCl、50 mmol/L咪唑,pH 7.4)平衡镍离子柱然后进样,进样时流速为1 mL/min。完成进样后,先用50 mL A液进行柱冲洗,再用体积分数85% A液和体积分数15% B液(25 mmol/L Tris-HCl、500 mmol/L NaCl、500 mmol/L咪唑,pH 7.4)洗脱杂蛋白,最后以体积分数100% B液洗脱目的蛋白,收集蛋白峰洗脱液,进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析。另将得到的上述Nanog洗脱液用含有500 mmol/L NaCl的25 mmol/L Tris-HCl溶液(pH 8.0)进行透析,去除高浓度咪唑,便于后期肠激酶酶切处理。
1.2.4 融合蛋白的酶切
将1 U肠激酶加入到1 mL经纯化透析过的含有500 μg的Nanog融合蛋白中,放入含有25 mmol/L Tris-HCl、50 mmol/L NaCl和2 mmol/L CaCl2的缓冲液(pH 7.6)中,在25 ℃条件下进行酶切,24 h后取样,15% SDS-PAGE检测酶切程度。
1.2.5 重组蛋白的SDS-PAGE及Western blot检测
取2 mL发酵液于4 ℃冷冻条件下12 000 r/min离心5 min收集菌体,弃上清液,用Tris-HCl缓冲液(25 mmol/L Tris,pH 7.4)清洗并重悬菌体,采用超声波破碎法破碎细胞,4 ℃冷冻条件下12 000 r/min离心10 min后所得上清液即为蛋白样品。将蛋白样品按1.2.4小节的方法处理,然后取40 μL酶切后蛋白样品加入10 μL 5×蛋白缓冲液,沸水浴变性10 min,12 000 r/min下离心15 min,取其中20 μL进行SDS-PAGE分析。将 SDS-PAGE电泳后的蛋白再电转至硝酸纤维素膜, 进行Western blot免疫杂交检测。一抗用兔抗Nanog多克隆抗体(anti-Nanog rabbit polyclonal antibody),二抗用羊抗兔,根据蛋白大小选择相应的程序,用干转仪将蛋白条带转移至硝酸纤维素膜上。利用iBindTM全自动蛋白印迹处理系统实现相应一抗的孵育、洗膜;二抗的孵育、洗膜,ECL化学发光法显色。
1.2.6Nanog蛋白表达量的测定
根据考马斯亮蓝染色法测定其总蛋白浓度,采用统一10 μg的总蛋白样品量进行SDS-PAGE分析,然后用Image Lab软件对SDS-PAGE电泳图进行蛋白条带灰度扫描,分析出每条泳道Nanog蛋白占总蛋白的百分含量,再根据总蛋白的含量从而计算出Nanog蛋白的含量,该含量仅用于不同发酵条件的对比优化。最终将纯化后的目的蛋白通过Bradford法测定获得相对准确的Nanog蛋白得率。
1.2.7Nanog蛋白表达条件的优化
在保持菌种活化时间一样的情况下,分别改变摇瓶发酵的诱导温度、诱导剂含量、补料碳源;15 L发酵罐上改变溶氧(dissolved oxygen,DO)、温度控制方式等条件。
发酵罐参数设置:设置DO与搅拌转速相关联,DO分别设置为(10±3)%、(20±3)%、(30±3)%、(40±3)%,通气量2 vvm,转速范围设置为200~850 r/min,pH设置维持在(7.0±0.2),温度设置为(37±0.5) ℃。
发酵温度控制分别采用全程37 ℃不变;诱导前37 ℃,诱导后30 ℃;诱导前37 ℃,诱导期间30 ℃维持30 min,之后调回37 ℃ 3种方式。具体操作如下:
第一阶段温度设定为37 ℃,重组菌在含有质量浓度20 g/L葡萄糖的培养基中扩增,通过葡萄糖定糖仪测定罐内葡萄糖残余量,待其耗尽后,通过流动加入甘油的方式补充碳源。第二阶段在甘油补加3 h后将温度分别设定为37 ℃、30 ℃、30 ℃各维持0.5 h,在变温后添加IPTG对重组大肠杆菌产Nanog蛋白进行诱导表达,其中第3种方式在30 min后将温度重设为37 ℃,体积分数35%的甘油流加质量浓度为50 g/L。
酶标仪测定波长600 nm处的OD值,并测定最高OD600处的菌体干质量,按照1.2.2小节的方法处理发酵液后制备SDS-PAGE蛋白胶,用Image Lab软件对SDS-PAGE电泳图进行蛋白条带灰度扫描,测定Nanog蛋白表达量,从而对比出最佳发酵条件。
2 结果与分析
2.1 Nanog蛋白表达质粒的构建及验证
按照1.2.1小节的方法构建重组表达质粒pET32a-Nanog,菌落PCR验证重组质粒pET32a-Nanog,结果如图1-a所示,PCR产物在935 bp左右有明显条带,这与Nanog基因大小相一致,测序结果与GenBanK报告的基因完全一致,表明获得了正确的Nanog基因序列。重组质粒用EcoR I和XhoI双酶切鉴定,结果如图1-b所示,得到大小分别为5900和935 bp的条带,分别代表pET32a质粒载体和Nanog基因序列。

a-1,2-重组表达质粒pET32a-Nanog菌落PCR产物; M-DNA Marker; b-1,2-重组表达质粒pET32a-Nanog经EcoR I与Xho I酶切;M-DNA Marker图1 琼脂糖凝胶电泳检测人源Nanog重组载体pET32a-Nanog 和酶切重组表达质粒pET32a-NanogFig.1 Human Nanog recombinant vector pET32a-Nanog and detection of pEF-32a-Nanog by agarose gel electrophoresis
2.2 重组Nanog蛋白在大肠杆菌BL21中的表达与纯化
采用超声破碎法破碎重组大肠杆菌细胞,冷冻离心后将所得上清液进行SDS-PAGE分析,结果如图2所示,所得重组蛋白在60 kDa左右出现明显条带,而将没有Nanog基因的pET32a空载转化到大肠杆菌BL21(DE3)中的发酵上清液中,无法检测到相应大小的蛋白条带,没有经IPTG诱导的重组菌株经培养后也无法检测到相应的蛋白条带。重组载体中融合的硫氧还蛋白标签分子质量大约22 kDa左右,Nanog分子质量约为38 kDa,所以融合Nanog蛋白的分子质量约为60 kDa左右。重组菌所产Nanog蛋白经镍离子柱亲和层析纯化后的蛋白在SDS-PAGE中显示出单一条带,分子质量约为60 kDa,与之前推测的重组Nanog融合蛋白大小相符。
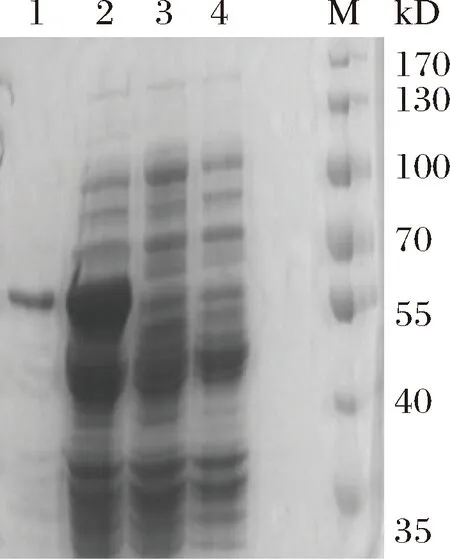
1-纯化后的重组Nanog融合蛋白; 2-IPTG诱导后的重组BL21(DE3)/pE32a-Nanog超声破碎后上清液; 3-未诱导的重组BL21(DE3)/pET32a-Nanog超声波破碎后上清液; 4-IPTG诱导后的BL21(DE3)/pET32a空载超声破碎后上清液; M-蛋白Marker图2 SDS-PAGE电泳分析pET32a-Nanog重组菌的蛋白表达Fig.2 SDS-PAGE analysis pET32a-Nanog recombinant protein expression
2.3 融合蛋白的酶切
纯化后的Nanog 融合蛋白经肠激酶处理后,结果如图3所示,得到大小分别为38 k与22 kDa左右的蛋白,22 kDa为pET32a上的Trx-His(硫氧还蛋白与组氨酸)标签蛋白,38 kDa为重组Nanog蛋白,与预期的Nanog蛋白大小相一致。
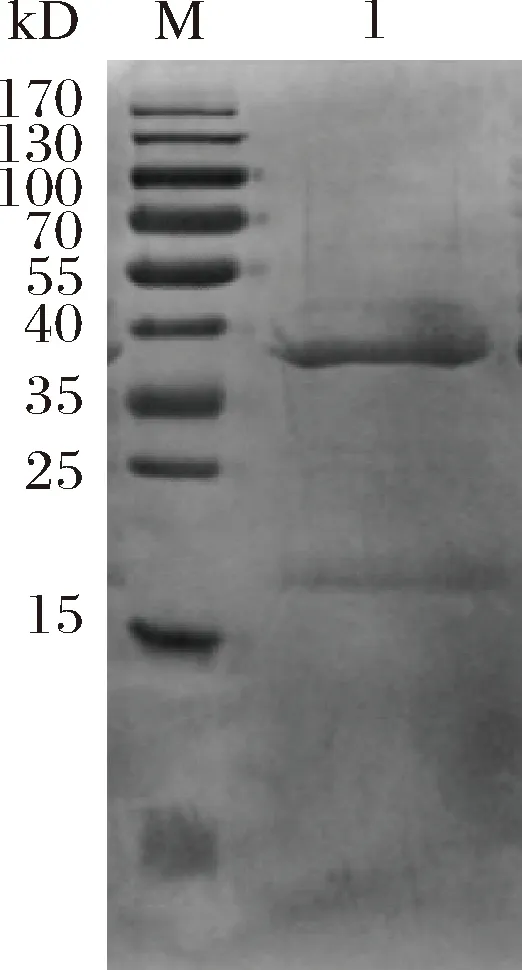
M-蛋白Marker; 1-肠激酶酶切产物图3 融合蛋白的肠激酶切割Fig.3 Fusion protein cleaved by enterokinase
2.4 Nanog的Western blot检测结果
将 SDS-PAGE电泳后的蛋白电转至硝酸纤维素膜, 进行Western blot免疫杂交检测。结果如图4所示,经纯化酶切后的Nanog蛋白与市售Nanog多克隆抗体呈阳性反应,而未经IPTG诱导的重组菌裂解液无特异性蛋白条带,表明制备的Nanog蛋白与Nanog多克隆抗体具有良好的结合特异性。

1-未被IPTG诱导的含重组质粒BL21(DE3)的裂解液; 2,3-经纯化酶切后的IPTG诱导含重组质粒BL21(DE3)的裂解液图4 Western Blotting鉴定Nanog蛋白Fig.4 Western Blotting identify Nanog protein
2.5 发酵条件的优化
2.5.1 诱导温度
将重组菌BL21/pET32a-Nanog进行摇瓶发酵实验,于LB培养基中培养过夜后转接,37 ℃、200 r/min培养2 h后加入0.1 mmol/L的IPTG,保持其他条件一致,分别在25、28、32、37、40 ℃下继续培养12 h,发酵结束后测定菌体量和蛋白浓度,结果如图5所示。随着温度的升高,蛋白表达量逐渐增多,37 ℃时Nanog蛋白表达量达到最高,因此选择37 ℃为最佳诱导温度。

a-菌体生长量和Nanog蛋白表达量; b-Nanog蛋白电泳图 M-蛋白Marker; 1-40 ℃; 2-37 ℃; 3-32 ℃; 4-28 ℃; 5-25 ℃图5 不同温度对菌体量和蛋白表达量的影响Fig.5 The effects of different temperatures on the amount of bacteria and protein expression
2.5.2 诱导剂添加量
重组菌BL21/pET32a-Nanog经 LB培养基培养过夜后转接37 ℃、200 r/min培养2 h,加入不同浓度的IPTG,保持其他条件一致,在不同诱导剂浓度下继续培养12 h,发酵结束后测定菌体量和蛋白浓度,发现IPTG浓度为0.2 mmol/L时对菌体表达外源蛋白最多(图6),因此选用IPTG诱导剂添加量为0.2 mmol/L。
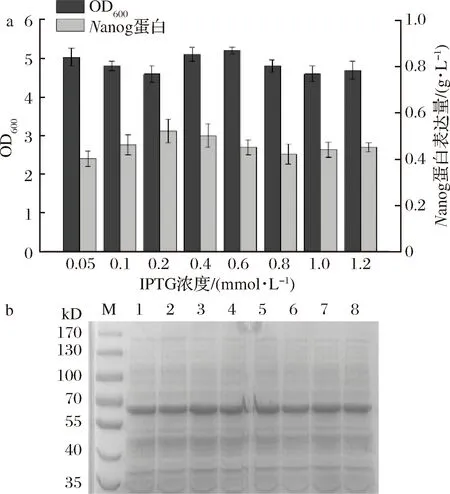
a-菌体生长量和Nanog蛋白表达量; b-Nanog蛋白电泳图; M-蛋白Marker; 1-0.05 mmol/L; 2-0.1 mmol/L; 3-0.2 mmol/L; 4-0.4 mmol/L; 5-0.6 mmol/L; 6-0.8 mmol/L; 7-1.0 mmol/L; 8-1.2 mmol/L图6 不同IPTG浓度对菌体量和蛋白表达量的影响Fig.6 The effects of different IPTG concentrations on bacterial volume and protein expression
2.5.3 不同补料碳源发酵对产Nanog蛋白的影响
以LB培养基为基础发酵培养基,分别添加质量浓度为10 g/L的葡萄糖、乳糖、甘油、可溶性淀粉、麦芽糖,以原始LB培养基作为对照,发酵结束后考察菌体量和Nanog蛋白的可溶性表达量,筛选出最佳碳源。结果如图7所示,葡萄糖的存在会抑制目的蛋白表达,但是菌体生长最好;麦芽糖和甘油也能够促进重组菌生长,但麦芽糖的产蛋白效果明显比甘油差,原因可能是麦芽糖会加快诱导表达速度,使目的蛋白来不及正确折叠,形成包涵体,从而使可溶性Nanog蛋白表达量减少;甘油既有利于重组菌生长又利于产酶,因此综合考虑,前期扩增阶段选择葡萄糖补料,后期诱导选择甘油为补料碳源。
2.6 15 L发酵罐发酵策略
2.6.1 不同溶氧水平对发酵的影响
在种子和发酵条件相同的条件下,在37 ℃、7 h后加终浓度0.2 mmol/L IPTG诱导,考察不同溶氧水平对重组大肠杆菌产Nanog蛋白的影响。结果如表1所示,当DO值在10%、20%、30%时,细胞生物量及Nanog蛋白产量不断增加,30%Nanog蛋白产量达到最大。当DO值在40%时,细胞生物量及Nanog蛋白产量反而减少。综合Nanog蛋白的产量,DO控制在20%~30%较好,其值分别达到873、886 mg/L。

a-菌体生长量和Nanog蛋白表达量; b-Nanog蛋白电泳图;1-对照; 2-甘油; 3-可溶性淀粉; 4-麦芽糖; 5-乳糖; 6-葡萄糖;M-蛋白Marker图7 不同补料碳源对菌体量和蛋白表达量的影响Fig.7 The effects of different feed carbon sources on the amount of bacteria and protein expression
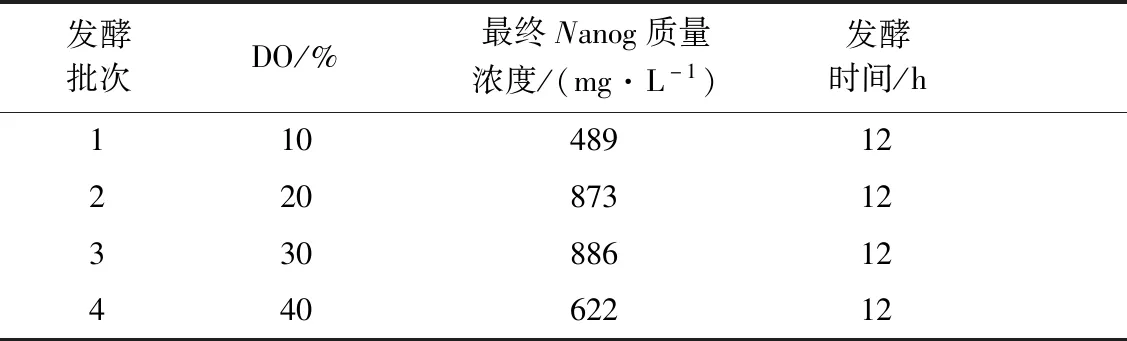
表1 不同溶氧条件下Nanog蛋白的表达水平Table 1 Nanog protein expression level under different dissolved oxygen conditions
2.6.2 不同发酵温度控制方式对Nanog蛋白产量的影响
发酵温度控制分别采用全程37 ℃不变;诱导前37 ℃,诱导后30 ℃;以及诱导前37 ℃,诱导期间30 ℃维持30 min,之后调回37 ℃ 3种方式。结果如表2所示,相比于前2种控温方式,第3种方法的Nanog蛋白产量最高,其发酵温度控制方式的大肠杆菌发酵过程生长、溶氧及补料曲线如图8所示。

表2 不同发酵方式生产Nanog蛋白的性能比较Table 2 Performance comparison of different fermentation methods for producing Nanog protein
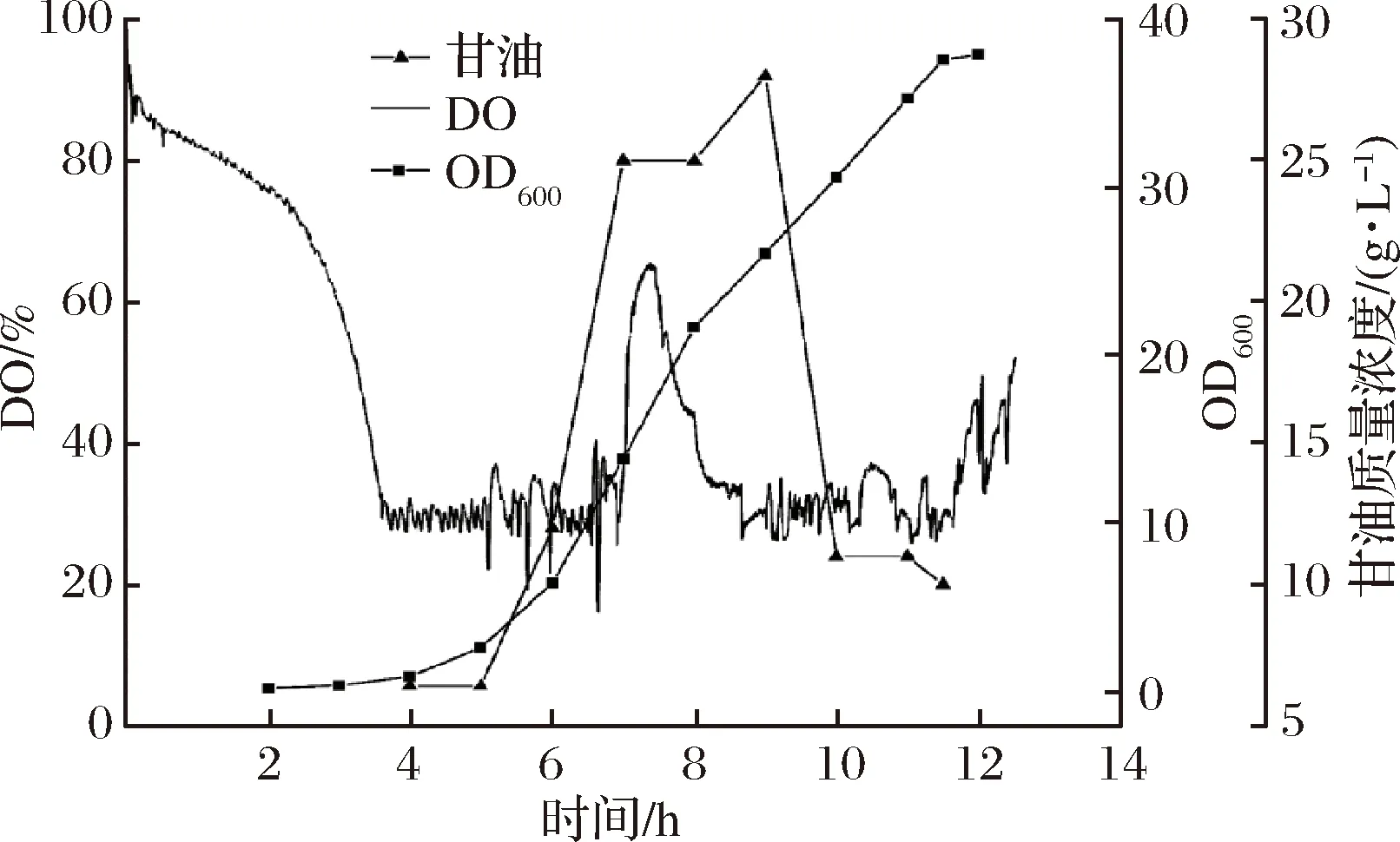
图8 大肠杆菌发酵过程生长及补料曲线Fig.8 Growth and feeding curve of E.coli fermentation
3 讨论
大肠杆菌表达系统具有成本低廉、适宜大规模发酵、条件易于自动化控制等优点,通过大肠杆菌表达重组蛋白是一种高效、经济的方式[13-14]。迄今为止,蛋白质结构数据库中约60%的蛋白质已使用大肠杆菌表达系统生成[15],对于大肠杆菌发酵生产代谢产物来说,DO值的控制直接关系着细胞的生长和代谢产物的形成[16]。
发酵罐控制溶氧的实际过程中,诱导剂添加阶段若维持37 ℃会导致0.5 h后即使通过提高转速或是增大通气量也难以维持其溶氧水平,加之后期维持37 ℃会有大量泡沫产生,加入消泡剂对其真实溶氧水平也有一定影响[17],最后菌体量虽然很高,但后期溶氧<5%,最终Nanog蛋白产量只有886 mg/L。通过提高设定转速到1 200 r/min虽能将溶氧重新控制在30%,但过高搅拌转速产生的剪切力也会对菌体生长产生影响[18-19],最终目的蛋白含量仅有489 mg/L。因此,在诱导前通过短暂地降低温度,配合加入IPTG,从而降低其生长速率,在诱导之后再将温度调回37 ℃,与一直保持37 ℃相比便于后期控制溶氧水平,最终实现重组Nanog蛋白的表达量为1 386.4 mg/L。值得注意的是,后期保持37 ℃诱导培养并不会减少可溶性Nanog融合蛋白的表达量,相较于传统的诱导后维持低温培养目的蛋白产量更高,还能缩短总发酵时间。对比NanogP8在pET28a中以包涵体形式表达,表明pET32a载体自带的硫氧还蛋白可以促进Nanog蛋白的可溶性表达,对比猪源与鼠源Nanog发现,加入硫氧还蛋白后对于不同来源的Nanog,具有81%氨基酸相似度的猪源Nanog也不能实现其可溶性表达[20-21]。另外在优化补料碳源的实验中发现葡萄糖能抑制Nanog的表达,因此在罐上培养时通过前期加入葡萄糖,一方面为重组菌生长提供所需碳源,另一方面也能在发酵前期抑制外源蛋白表达,从而有利于菌体生长。后期补料改用甘油,可以避免添加葡萄糖影响外源蛋白表达[22]。综上所述,大肠杆菌发酵产Nanog蛋白是需氧型的,需要控制一定的溶氧量才能有表达,但也不是越高越好,究其原因可能是氧含量过高容易产生含氧自由基破坏细胞组分,从而严重影响菌体的生长代谢[23-24]。后续研究中改良表达载体,使其能将目的蛋白分泌到细胞外,并对纯化条件进行系统优化,以期提高其蛋白纯度。
4 结论
本研究构建了1株能高效表达Nanog蛋白的重组大肠杆菌,首次实现了人源Nanog蛋白在大肠杆菌中的可溶性表达,通过摇瓶优化及进一步的罐上发酵条件优化使得Nanog蛋白产量达到1 386.4 mg/L,并且在发酵罐上也有效控制了溶氧的稳定性问题,罐上发酵12 h就可稳定得到大量可溶性Nanog蛋白,对后续的大规模发酵生产具有一定的指导作用,也为进一步制备Nanog多克隆抗体,研究Nanog在肿瘤发生中的作用奠定了基础。

