热疗联合顺铂对喉癌Hep-2细胞的影响研究*
(承德市中心医院 耳鼻喉科,河北 承德 067000)
喉癌是头颈部常见的恶性肿瘤,近年全球喉癌的发病率明显升高[1-2]。喉癌主要采取以手术为主的综合治疗[2],尽管目前的治疗手段有所改善,但是预后仍较差[3-4]。目前欧美国家非手术保喉治疗已成为中晚期喉癌患者根治性治疗的一种方式,而非辅助性治疗[5]。单纯的化疗是治疗中晚期喉癌的重要方法之一。顺铂作为喉癌化疗的一线用药,在肿瘤治疗中有着重要作用,但耐药的出现限制其应用,因此寻找能够增敏顺铂的治疗方法有重要临床意义。近年热疗与化疗联合抗癌成为研究热点。研究显示热疗联合化疗在卵巢癌、食管癌、胃癌等的治疗中已广泛开展并获得较好的临床效果[6-8],且热疗相对安全、无毒。本研究拟在体外培养条件下观察热疗联合顺铂对喉癌Hep-2细胞增殖、迁移和侵袭力的影响,旨在为喉癌的治疗提供新思路、新方法,为热疗联合化疗治疗喉癌提供实验依据。
1 材料与方法
1.1 主要试剂
喉癌Hep-2细胞由天津医科大学第二医院提供,RPMI 1640 培养基购自美国Gibco Invitrogen公司,胎牛血清购自天津血液学研究所,胰蛋白酶购自美国Sigma公司,顺铂购自山东齐鲁制药有限公司,MTT 购自武汉华美生物技术有限公司,Transwell 侵袭实验用细胞外基质胶 (ECM) 购自美国Sigma公司,孔径为8 μm的Transwell 小室购自美国Corning公司。
1.2 方法
1.2.1 喉癌Hep-2细胞的培养及其对顺铂的敏感性检测用含10%胎牛血清的RPMI 1640 培养基,在37℃、5%二氧化碳CO2中常规培养、传代喉癌Hep-2细胞。收集处于对数生长期的细胞,实验分6组:①阴性对照组 (培养基不加顺铂) ;②0.004 mg/L组 (顺铂浓度0.004 mg/L) ;③0.040 mg/L组 (顺铂浓度0.040 mg/L) ;④0.400 mg/L组 (顺铂浓度0.400 mg/L) ;⑤4.000 mg/L组 (顺铂浓度4.000 mg/L) ;⑥40.000 mg/L组 (顺铂浓度40.000 mg/L)。以2×105个/ml 密度接种于96孔板,每孔加入100 μl细胞悬液,每组设6个复孔。5% CO2、37℃、饱和湿度条件下孵育24 h后,阴性对照组继续培养24 h;②~⑥组换为含对应浓度顺铂的培养基,继续培养24 h。吸弃各孔内培养基,每孔加入不含血清的RPMI 1640 培养基100 μl,MTT 溶液 (5 mg/ml) 20 μl,继续培养4 h。小心吸去孔内培养液。每孔加入150 μl 二甲基亚砜 (DMSO),低速振荡10 min,使结晶物充分溶解。用酶标仪在波长490 nm处测量各孔的光密度 (optical density,OD) 值,计算顺铂对喉癌Hep-2细胞的IC50。
1.2.2 MTT法检测Hep-2细胞的增殖收集处于对数生长期的细胞,分为4组:①对照组 (置于37℃培养箱) ;②热疗组 (置于43℃培养箱) ;③顺铂组 (置于37℃培养箱并加入顺铂,顺铂的浓度为4.000 mg/L) ;④热疗联合顺铂组 (43℃培养箱并加入顺铂,顺铂的浓度为4.000 mg/L)。以2×105个/ml 密度接种于96孔板,每孔加入100 μl 细胞悬液,每组设6个复孔。37℃、5% CO2饱和湿度条件下孵育24 h后,对照组于37℃继续培养24 h;热疗组于43℃作用2 h后重新置于37℃继续培养22 h;顺铂组于37℃并加入顺铂 (顺铂浓度为4.000 mg/L) 继续培养24 h;热疗联合顺铂组于43℃并加入顺铂 (顺铂浓度为4.000 mg/L),2 h后重新置于37℃继续培养22 h。MTT法同上。用酶标仪在波长490 nm处测量各孔的OD值。按照2×2 析因实验设计,2个因素分别为热疗和顺铂,热疗有2个水平,分别为37和43℃;顺铂有2个水平,分别为顺铂浓度0.000 mg/L和顺铂浓度4.000 mg/L。
1.2.3 Wound-healing划痕实验检测Hep-2细胞的迁移Hep-2细胞按上述分组接种到6孔板,每孔的培养体积为3 ml,细胞数大约为5×105个/ml,37℃、5% CO2饱和湿度条件下孵育12 h。用200 μl 移液器在已经铺满的单层细胞上划痕,磷酸盐缓冲液 (PBS) 清洗3次,洗掉漂浮的细胞。对照组、热疗组用3 ml无血清RPMI 1640 培养基培养,顺铂组、热疗联合顺铂组用3 ml 无血清含4.000 mg/L 顺铂的RPMI 1640培养基培养,在0和24 h 拍照,实验重复3次。
1.2.4 Transwell 侵袭实验检测Hep-2细胞的侵袭力分组同1.2.2,收集处于对数生长期的细胞,随机分为4组,以2×105个/ml的密度接种于30 mm2平皿,37℃、5%CO2饱和湿度条件下孵育24 h后,对照组于37℃继续培养24 h;热疗组于43℃作用2 h后重新置于37℃继续培养22 h;顺铂组于37℃并加入顺铂 (顺铂浓度为4.000 mg/L) 继续培养24 h;热疗联合顺铂组于43℃并加入顺铂 (浓度为4.000 mg/L),2 h后重新置于37℃继续培养22 h。采用Transwell 侵袭实验法[9],将人工细胞外基质胶 (ECM) 按1∶4 比例用无血清的培养基稀释后,每室100 μl 均匀铺于小室膜上,将小室置于24孔板中,上室加入70 μl 无血清培养基,37℃静置30 min,使基质胶水化后吸去剩余培养液。将4组细胞消化并计数,调整密度至2×105个/ml,取细胞悬液200 μl 加入上室。下室加入600 μl 含30%血清的培养基。24 h后取出小室,PBS 清洗2 遍,棉签擦去ECM和上室内的细胞,甲醇固定15 min,苏木精染色,显微镜下观察,随机选择5个视野计数,取每组的平均值为Hep-2细胞的穿膜细胞数。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准差 (±s)表示,比较用单因素方差分析或析因设计方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Hep-2细胞对顺铂的敏感性
6组细胞进行MTT处理,测波长490 nm处OD值分别为 (1.24±0.13) 、 (1.22±0.08) 、 (1.18±0.08),(1.09±0.08) 、 (0.75±0.07) 及 (0.25±0.03),经方差分析,差异有统计学意义 (F=130.925,P=0.000) ;40.000 mg/L组OD值低于其他组 (P<0.05) ;4.000 mg/L组OD值均低于0.400 mg/L组、0.040 mg/L组、0.004 mg/L组和阴性对照组 (P<0.05) ;0.400 mg/L组OD值低于0.004 mg/L组和阴性对照组 (P<0.05),与0.040 mg/L组比较差异无统计学意义 (P>0.05) ;0.040 mg/L组、0.004 mg/L组和阴性对照组OD值比较差异无统计学意义 (P>0.05) (见图1)。顺铂对喉癌Hep-2细胞的IC50为19.555 mg/L。
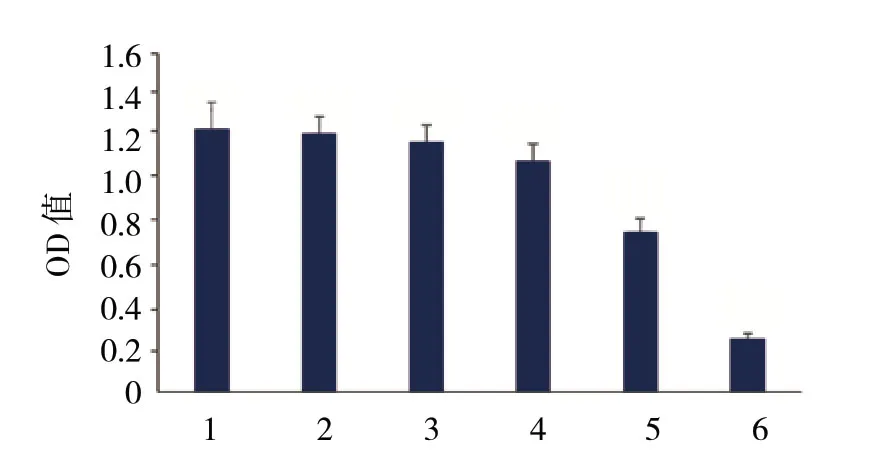
图1 Hep-2细胞对顺铂的敏感性 (±s)
2.2 热疗联合顺铂对Hep-2细胞增殖的影响
4组细胞进行MTT处理,测波长490 nm处OD值分别为 (1.24±0.13) 、 (0.99±0.11) 、 (0.75±0.07) 及 (0.31±0.07),析因分析显示,不同温度热疗在波长490 nm处的OD值有差异 (F=73.665,P=0.000),不同浓度顺铂在波长490 nm处的OD值有差异 (F=213.005,P=0.000),热疗与顺铂对在波长490 nm处的OD值存在交互作用 (F=5.071,P=0.036)。见图2和表1。
2.3 热疗联合顺铂对Hep-2细胞迁移的影响
4组细胞未愈合区百分比分别为 (31.83±1.62) %、 (40.47±1.52) %、 (53.13±2.61) %及 (79.83±0.95) %,析因分析显示,不同温度热疗的未愈合区百分比有差异 (F=296.934,P=0.000),不同浓度顺铂的未愈合区百分比有差异 (F=875.370,P=0.000),热疗与顺铂对未愈合区百分比的影响存在交互作用 (F=77.633,P=0.000)。见表1和图3、4。
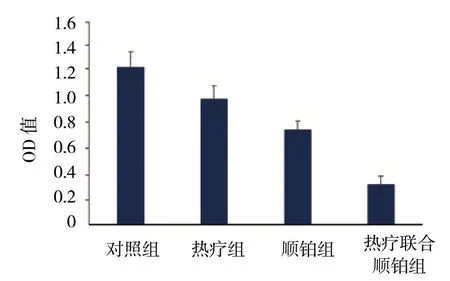
图2 各组Hep-2细胞的OD值比较 (±s)
表1 各组Hep-2细胞的增殖、迁移和侵袭力 (±s)
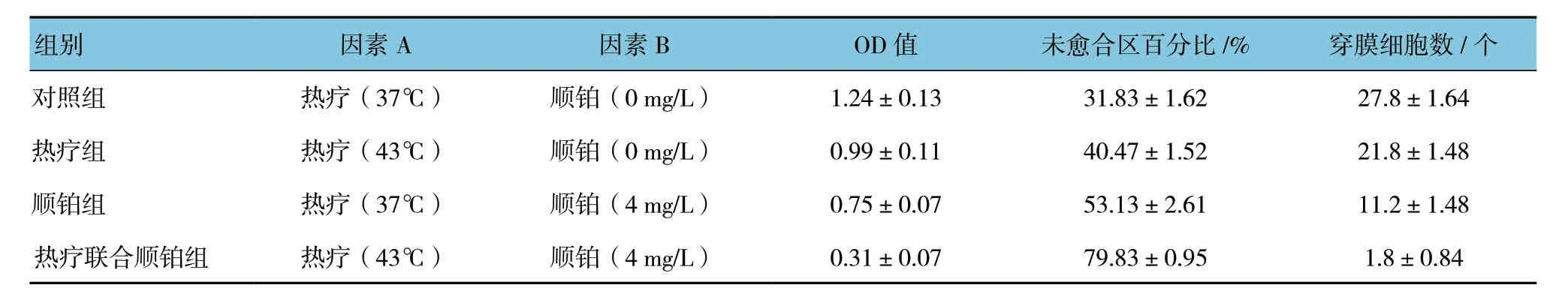
表1 各组Hep-2细胞的增殖、迁移和侵袭力 (±s)
组别 因素A 因素B OD值 未愈合区百分比/% 穿膜细胞数/个对照组 热疗 (37℃) 顺铂 (0 mg/L) 1.24±0.13 31.83±1.62 27.8±1.64热疗组 热疗 (43℃) 顺铂 (0 mg/L) 0.99±0.11 40.47±1.52 21.8±1.48顺铂组 热疗 (37℃) 顺铂 (4 mg/L) 0.75±0.07 53.13±2.61 11.2±1.48热疗联合顺铂组 热疗 (43℃) 顺铂 (4 mg/L) 0.31±0.07 79.83±0.95 1.8±0.84
2.4 热疗联合顺铂对喉癌Hep-2细胞侵袭力的影响
4组细胞穿过Transwell 小室膜的细胞数目分别为 (27.8±1.64) 、 (21.8±1.48) 、 (11.2±1.48) 及 (1.8±0.84) 个,析因分析显示,不同温度热疗的穿膜细胞数有差异 (F=152.026,P=0.000),不同浓度顺铂的穿膜细胞数有差异 (F=858.692,P=0.000),热疗与顺铂对穿膜细胞数的影响存在交互作用 (F=7.410,P=0.015)。见表1和图5、6。

图3 各组Hep-2细胞的迁移 (×100)
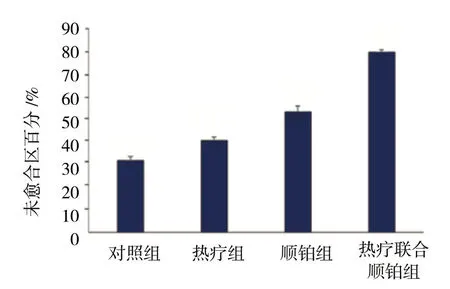
图4 各组Hep-2细胞未愈合区百分比比较 (±s)
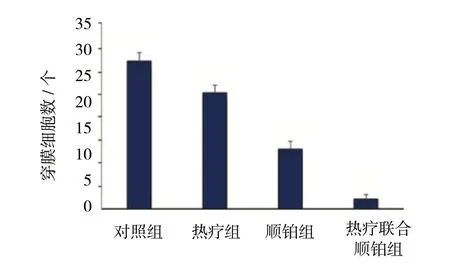
图5 各组Hep-2细胞穿膜细胞数比较 (±s)
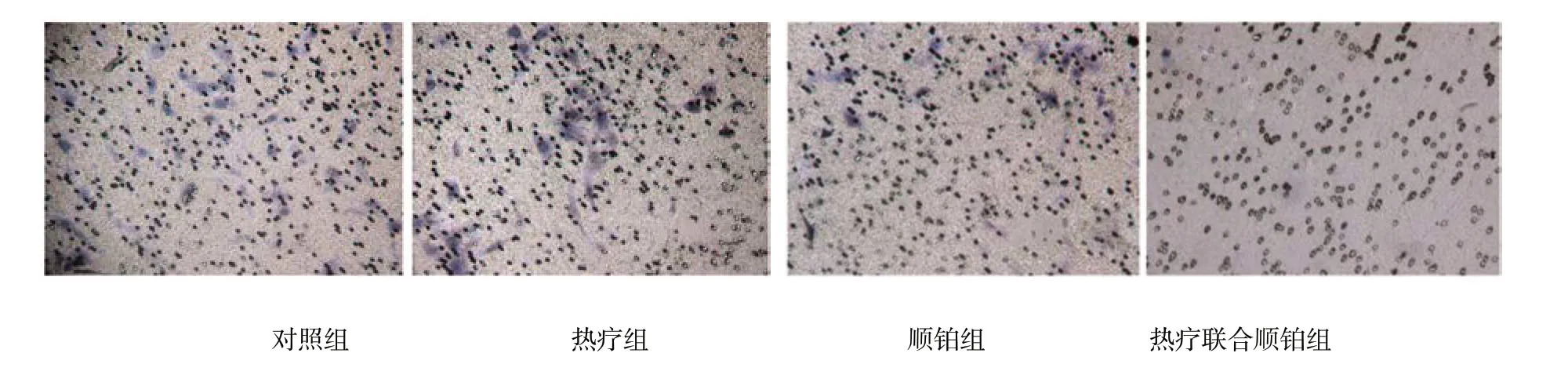
图6 各组Hep-2细胞的侵袭力 (苏木精染色×200)
3 讨论
我国喉癌发病率约为26/10万,占全身恶性肿瘤的0.6%,病死率约为15/10万,占全身肿瘤的0.5%[10]。喉癌容易局部复发和/或远处转移,导致预后不良和治疗失败[10]。顺铂是一种细胞周期非特异性细胞毒性药物,DNA为其主要靶点,通过破坏肿瘤细胞DNA的正常结构,阻止DNA的复制,诱导肿瘤细胞的凋亡[11]。早期对顺铂敏感的肿瘤在长期临床应用中逐渐产生耐药,限制其应用。而高温热疗是利用物理疗法,使组织加热,达到杀灭癌细胞的温度,以治疗恶性肿瘤。被认为是继手术、放疗、化疗、生物免疫疗法之后的第5种肿瘤治疗方法。临床应用无毒、安全,也称为绿色治疗[12]。
本研究采用MTT 比色法研究热疗联合顺铂对喉癌Hep-2细胞增殖的影响。MTT 可以被活细胞线粒体中琥珀酸脱氢酶还原成水不溶性的甲瓒结晶,并沉积在细胞中。结晶溶于DMSO,经酶标仪检测后的OD值可间接反映活细胞数。本实验4组Hep-2细胞进行MTT处理,结果显示:热疗与顺铂均可以抑制Hep-2细胞增殖,热疗与顺铂联合对Hep-2细胞增殖的抑制有交互作用,表明热疗与顺铂联合有协同抗肿瘤作用。由此推测,热疗联合化疗的作用机制有可能是:①热疗通过杀伤处于S期肿瘤细胞的方式抑制肿瘤增殖。②热疗改变肿瘤细胞膜的结构,有利于化疗药物进入肿瘤细胞,进而增加肿瘤细胞内的药物浓度[13],从而增强肿瘤细胞对化疗药物的敏感性。
肿瘤细胞的侵袭是肿瘤发生转移的重要步骤,是恶性肿瘤最本质特征之一,抑制肿瘤的侵袭力可控制或降低肿瘤转移的发生。细胞外基质的降解是恶性肿瘤转移的关键步骤。本研究结果显示,热疗与顺铂均可以降低Hep-2细胞迁移和侵袭能力,热疗与顺铂联合对Hep-2细胞迁移及侵袭的抑制有交互作用,表明热疗与顺铂联合有协同抗肿瘤侵袭作用。有研究显示,热化疗可能通过抑制肿瘤细胞外基质降解,抑制肿瘤源性血管内皮细胞增生和细胞外基质再塑,从而抑制肿瘤细胞的扩散转移[14]。笔者推测其机制可能为:热疗联合顺铂抑制肿瘤细胞,产生某些能够影响细胞外基质形成物质的能力,或者对具有降解细胞外基质功能的蛋白产生抑制作用,从而抑制肿瘤细胞的侵袭力。但具体的机制仍待进一步研究来证实。
综上所述,热疗与顺铂2种治疗方案联合应用有协同作用,热疗可以提高顺铂对Hep-2细胞的敏感性。热疗联合顺铂抑制喉癌Hep-2细胞的增殖,降低Hep-2细胞的迁移及侵袭力,从而为喉癌的临床治疗提供理论基础,但具体机制尚待进一步研究。

