不同纤维源饲粮对四川白鹅肠道微生物菌群结构的影响
程雅婷,鲜凌瑾,武秋申,揭晓蝶,田 旭,陈霈瑶,李开秀,钟 航,章 杰*
(1.西南大学 动物科学学院,重庆 402460;2.乐山职业技术学院,四川 乐山 614000;3.重庆市畜牧科学院,重庆 402460)
饲粮纤维是指植物中固有的、完整的不易被动物小肠消化酶所消化利用,但能被大肠微生物发酵利用的可食碳水化合物和木质素的总称[1]。研究表明,在饲粮中适量添加纤维有利于动物的生长发育。GONZLEZ-ALVARADO等[2]研究显示饲粮中添加燕麦壳和大豆壳可显著提高肉仔鸡日增体质量、平均日采食量、料重比以及有机物、可溶性灰分和脂肪等的消化率。MARGÜENDA等[3]研究指出,饲粮中添加37%中性洗涤纤维水平可提高兔日采食量和胴体产量,降低生长期死亡率。RENAUDEAU等[4]报道在母猪哺乳期饲喂高纤维饲粮(20%中性洗涤纤维)可增加仔猪的生长速度和体质量。此外,研究还发现饲粮中添加不同来源的纤维对动物生长发育具有不同的影响。HE等[5]研究了饲粮中添加玉米秸秆、蒸汽爆破玉米秸秆、蒸汽爆破麦秸和蒸汽爆破稻草对灰鹅生长发育的影响,结果显示饲喂玉米秸秆的平均日采食量和饲料转化率最高。JIMÉNEZ-MORENO等[6]研究了纤维素、甜菜浆、燕麦壳饲粮对肉鸡胃肠道发育和pH值的影响,结果指出甜菜浆和燕麦壳可降低胃肠道的pH值,提高脂肪、灰分和淀粉等营养物质的消化率。反刍动物对饲粮纤维的消化利用主要依靠瘤胃微生物,单胃动物则主要依靠肠道后段内的微生物,而胃肠道微生物是影响宿主营养吸收、能量代谢、免疫平衡和生长繁殖的重要因素之一[7]。因此,研究肠道微生物菌群构成是了解饲粮纤维对宿主生长发育影响的基础。CHEN等[8]研究表明,饲粮中添加豌豆和麦麸可增加肠道有益微生物的浓度来抵抗细胞外病原体数量,进而降低断奶仔猪的发病率。AMERAH等[9]研究指出,不同纤维源会影响回肠微生物菌群特征,从而改变营养物质的消化率。鹅是草食性家禽,具有耐粗饲的特点,可大量利用草和秸秆,对粗纤维的消化率可达40%~50%,是研究动物饲粮纤维理论基础的理想模型[10]。目前,鹅因耗精料少而在中国被大范围养殖,饲养量占全球总量的90%以上[11],但不同来源的纤维饲粮对鹅肠道微生物菌群结构的影响鲜见报道。因此,本试验以四川白鹅为研究对象,探讨了不同纤维源(苜蓿、黑麦、燕麦和花生秧)饲粮对其肠道微生物菌群的影响,为更好地了解四川白鹅对粗纤维的消化利用情况提供科学数据,同时也为生产实际中利用牧草纤维及制定饲粮配方提供科学依据。
1 材料与方法
1.1 试验动物选取体况健康、体质量相近的1日龄四川白鹅120只,随机分为4组,分别为苜蓿组、黑麦组、燕麦组和花生秧组,每个处理3个重复,每个重复10只鹅。试验在西南大学畜牧实训基地进行,采用半开放式鹅舍,地面圈养,自由采食与饮水,每日饲喂4次(7:30,12:30,17:00,21:00)。试验持续时间为70 d,试验饲粮组成及营养成分见表1。试验期环境温度为(28.77±0.11)℃,湿度为(86.78±0.42)%。
1.2 生长性能测定70日龄时进行空腹称体质量(称体质量前禁食6 h),记录并计算平均日增体质量(ADG:average daily gain)、平均日采食量(ADFI:average daily feed intake)和料重比(F/G)。
1.3 肠道微生物采集70日龄时,每组随机选取3只鹅进行屠宰,迅速取出盲肠并结扎,经75%酒精擦拭消毒外表后转移至无菌超净台。将盲肠剪开后用无菌生理盐水冲洗肠道内壁,冲洗干净后,用灭菌手术刀片轻轻刮取肠道黏膜并收集于冻存管中,于-80℃ 保存备用。
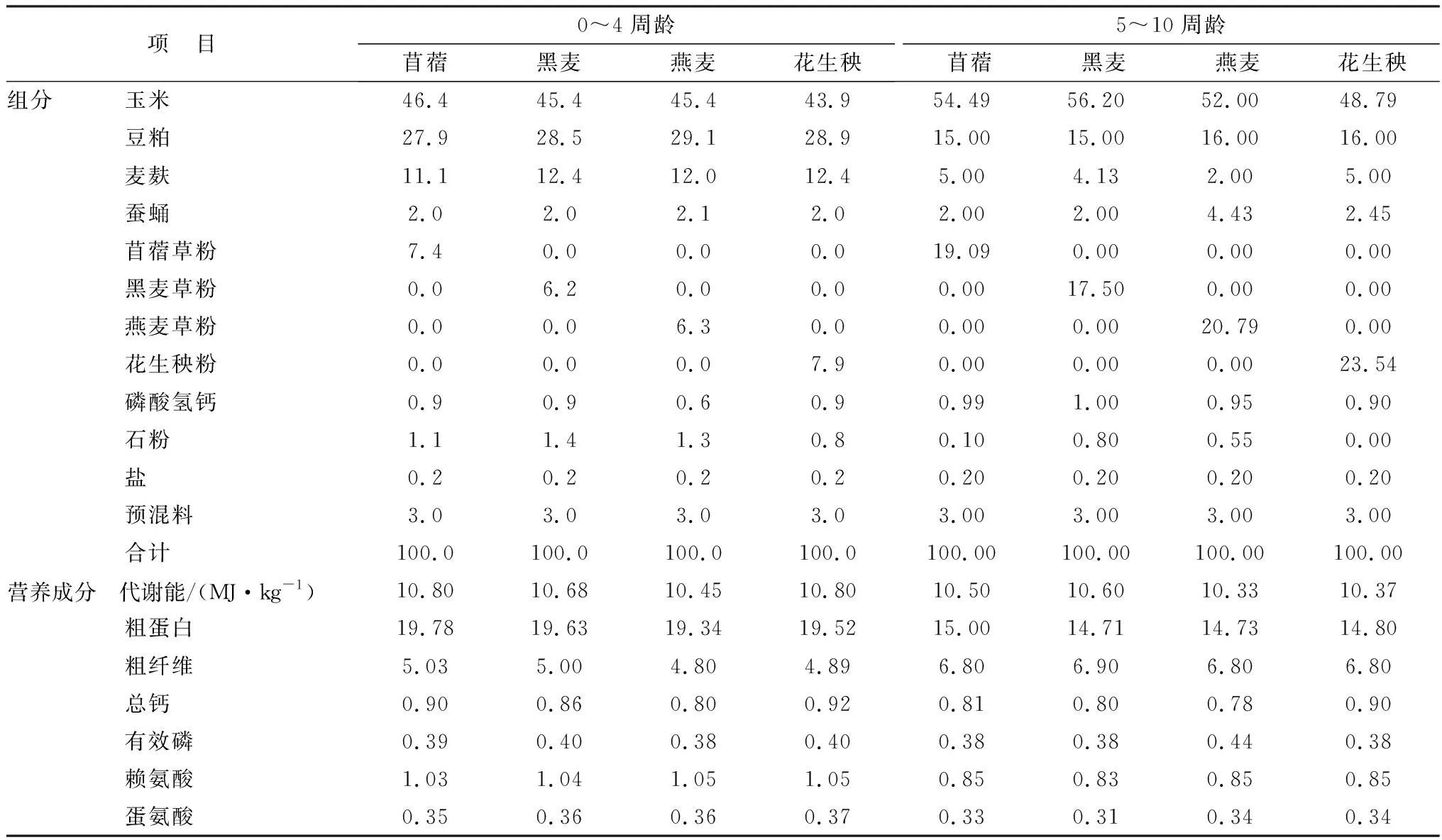
表1 试验饲粮组成及营养水平(风干基础) %
1.4 16S rRNA PCR扩增及测序利用QIAamp DNA Stool Mini Kit(Qiagen,德国)提取微生物总DNA,然后选用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACH VGGGTWTCT AAT-3′)对16S rRNA(V3-V4)区进行PCR扩增,其中引物338F的5′尾端带有条形码标记。PCR反应参数:95℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸90 s,22个循环;最后72℃延伸8 min。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统进行定量检测,之后按照每个样本的测序量要求进行相应比例的混合来构建Miseq文库并进行Miseq测序。
1.5 测序序列处理测序得到双端序列数据,根据PE reads之间的overlap关系,将成对的reads 拼接(merge)成1条序列,允许的最大错配比率为0.2,最小overlap长度为10 bp,筛选掉不合格序列。根据序列首尾两端的barcode和引物区分有效序列,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。同时对reads的质量和merge的效果进行质控,过滤reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于 20,从窗口开始截去后端碱基,并且过滤质控后50 bp以下的reads,去除含N碱基的reads。
1.6 生物信息学分析在97%相似度下通过Usearch(version7.1)软件将序列进行聚类,得到分类操作单元(OTUs)。通过RDP Classifer将OTUs代表序列与数据库Silva进行比对,置信度阈值为0.6[12],进而分析物种多样性指数及群落结构。同时利用序列数量与其所代表的OTU数目来构建稀释曲线,以及利用序列数量在不同测序深度时的微生物多样性指数来构建Shannon-winner曲线。
1.7 多样性分析根据样本OTU数据来估计菌群的α多样性和β多样性。α多样性以物种丰富度指数(Chao和Ace)和多样性指数(Shannon和Simpson)表现。利用β多样性距离矩阵,使用非加权组平均算法构建树状结构,然后使用主成分分析(PCA)和主坐标分析(PCoA)进行可视化展示。
1.8 数据处理采用SAS 8.2软件对数据进行统计分析,数据以“平均值±标准差”表示,采用F检验对数据进行差异显著性分析,P<0.05表示差异显著,P>0.05表示差异不显著,并用Met-astats方法对各处理组间物种差异性进行分析。
2 结果
2.1 生长性能分析由表2可知,不同纤维源饲粮组鹅初始体质量(1日龄)差异不显著(P>0.05),符合随机取样的原则,排除个体差异对结果的影响,表明本研究结果具有代表性。结束体质量(70日龄)和平均日增体质量在不同纤维源饲粮组之间差异显著(P<0.05),其中苜蓿组显著高于黑麦组(P<0.05),与燕麦组和花生秧组无显著性差异(P>0.05),而黑麦组、燕麦组和花生秧组之间差异均不显著(P>0.05);并且两者变化趋势一致,均为苜蓿组>花生秧组>燕麦组>黑麦组。不同纤维源饲粮组平均日采食量和料重比差异不显著(P>0.05),变化趋势均为燕麦组>黑麦组>花生秧组>苜蓿组。上述结果表明,鹅对不同纤维源饲粮在消化利用率上存在差异,暗示对肠道具有调控作用的微生物菌群的差异。

表2 不同纤维源饲粮组鹅生产性能比较
2.2 测序数据质量评估由表3可知,本次12个测序序列文库覆盖率均达到了99.7%以上,共得到803 498条有效序列,335.7 Mp碱基,平均序列长度为438.14 bp,比对得到877个OTUs(苜蓿组:583;黑麦组:478;燕麦组:470;花生秧组:443)。此外,稀释曲线及Shannon-winner曲线均随着测序数据量的增加趋于平坦(图1),说明测序数据量足够大,数据具有代表性和真实性,可以反映样本中微生物菌群信息。

表3 测序数据统计
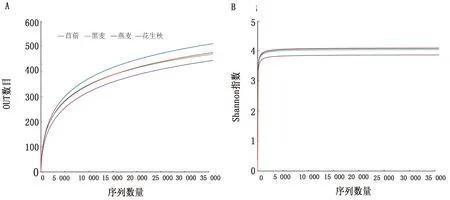
图1 测序数据质量评估 A.稀释曲线;B.Shannon-winner曲线
2.3 肠道微生物菌群α多样性分析如表4所示,Chao、Ace、Shannon和Simpson在不同纤维源饲粮组之间差异均不显著(P>0.05),其中Chao和Ace指数为苜蓿组>花生秧组>黑麦组>燕麦组,说明苜蓿组微生物菌群丰富度较高,而燕麦组微生物菌群丰富度最低。Simpson和Shannon指数在不同纤维源饲粮组之间变化趋势不一致,但研究表明多样性指数区分度越大,其有效性越高[13]。本试验数据显示Shannon指数区分度高于Simpson指数,故本研究采用Shannon指数评估微生物菌群多样性。不同纤维源饲粮组之间Shannon指数为花生秧组>苜蓿组>黑麦组>燕麦组,说明花生秧组微生物菌群多样性较高,而燕麦组最低。
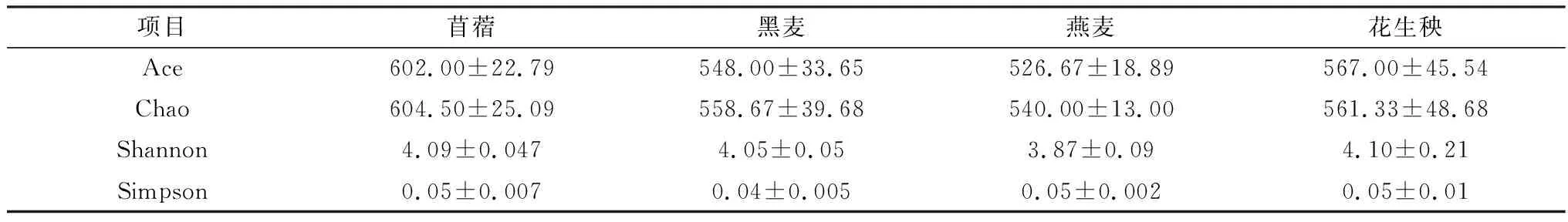
表4 肠道微生物多样性指数
2.4 肠道微生物菌群组成分析
2.4.1门水平上微生物菌群组成分析 如图2A所示,不同纤维源饲粮组在门水平上共得到15种已知细菌(苜蓿组14种,花生秧组12种,黑麦组15种,燕麦组14种),其中12种为共有细菌,说明这12种细菌在维持肠道菌群功能上发挥着重要的作用,不会轻易受饲粮的变化而发生改变。比较细菌相对丰度可知(图2B),不同纤维源饲粮组相对丰度大于0.1% 的优势细菌均为11种共有细菌,其中厚壁菌门(Firmicutes)占到了65.91%~68.05%,拟杆菌门(Bacteroidetes)占到了16.84%~18.17%,变形杆菌门(Proteobacteria)占到了4.58%~5.70%,放线菌门(Actinobacteria)占到了4.45%~4.78%。

图2 门水平菌群组成分析 A.韦恩图;B.门水平上菌群相对丰度分布
2.4.2属水平上微生物菌群组成分析 由图3A可知,不同纤维源饲粮组在属水平上共得到155个已知细菌(苜蓿组138种,花生秧组126种,黑麦组127种,燕麦组124种),其中108种为共有细菌,说明这108种细菌在维持肠道菌群功能上发挥着重要的作用,不会轻易受饲粮的变化而发生改变。此外,有26种细菌为不同纤维源饲粮组所特有(苜蓿组11种、黑麦组5种、燕麦组2种、花生秧组8种),说明这些细菌可能与不同纤维源饲粮有直接联系。比较细菌相对丰度可知(图3B),苜蓿组相对丰度含量大于0.1%的优势菌属有66种,占总丰度的97.64%;黑麦组有67种,占98.20%;燕麦组有63种,占98.11%;花生秧组65种,占97.89%;说明肠道微生物菌群功能的实现主要依靠优势细菌。从单一菌属来看,某些菌属所占比例很高,并且不同纤维源饲粮组之间有所差异,比如苜蓿组Bacteroides(18.76%)、Megamonas(14.88%)、[Ruminococcus]_torques_group(6.67%);黑麦组Bacteroides(18.70%)、Megamonas(10.63%)、[Ruminococcus]_torques_group(6.69%);燕麦组Bacteroides(17.06%)、Megamonas(11.67%)、[Ruminococcus]_torques_group(6.1%);花生秧组Bacteroides(24.37%)、[Ruminococcus]_torques_group(6.3%)、Desulfovibrio(6.1%)。

图3 属水平上菌群组成分析 A.韦恩图;B.属水平上菌群相对丰度分布
2.5 肠道微生物菌群β多样性分析如图4所示,PCA和PCoA分析结果均显示不同纤维源饲粮组在第一轴明显发生了分离(PC1+PC2>50%),且同一纤维源饲粮组的重复之间较为接近,表明饲粮中的纤维来源对鹅肠道微生物菌群有一定的影响。
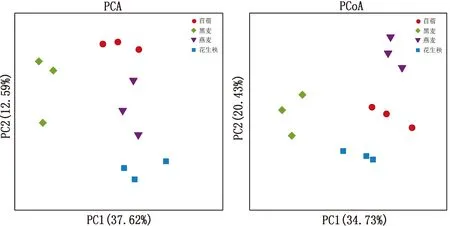
图4 PCA和PCoA分析
2.6 肠道微生物菌群丰度差异性分析对不同纤维源饲粮组之间共有的优势菌群相对丰度分析显示(表5),门水平上仅有黏胶球菌(Lentisphaerae)差异显著(P<0.05),其中燕麦组和苜蓿组显著高于花生秧和黑麦组(P<0.05),而花生秧和黑麦组之间差异不显著(P>0.05)。属水平上有理研菌(Alistipes)、梭菌(Shuttleworthia)、互养菌(Synergistes)、放线菌(Slackia)、真杆菌(Eubacteriumcoprostanoligenes)、多形杆状菌(Bacteroides)、瘤胃菌(Faecalibacterium)、巨单胞菌(Megamonas)和柔嫩梭菌(Subdoligranulum)差异显著(P<0.05),其中花生秧组Alistipes显著高于燕麦组、黑麦组和苜蓿组(P<0.05),且苜蓿组和黑麦组显著高于燕麦组,但两者之间差异不显著(P>0.05);燕麦组Shuttleworthia显著低于苜蓿组、黑麦组及花生秧组(P<0.05),且苜蓿组、黑麦组及花生秧组之间差异不显著(P>0.05);Slackia在苜蓿组和花生秧组之间差异不显著(P>0.05),但均显著低于燕麦草组(P<0.05);Bacteroides在苜蓿组、黑麦组和燕麦组之间差异不显著(P>0.05),且显著低于花生秧组(P<0.05);黑麦组Faecalibacterium显著低于苜蓿组、燕麦组和花生秧组(P<0.05),且苜蓿组显著高于花生秧组(P<0.05),但与燕麦组差异不显著(P>0.05);苜蓿组Megamonas显著高于黑麦组、燕麦组和花生秧组(P<0.05),黑麦组和燕麦组显著高于花生秧组(P<0.05);Subdoligranulum在燕麦组和花生秧组之间差异不显著(P>0.05),但显著低于苜蓿组和黑麦组(P<0.05),且苜蓿组显著高于黑麦组(P<0.05);Eubacteriumcoprostanoligenes在花生秧组和黑麦组之间差异不显著(P>0.05),但显著高于燕麦组(P<0.05)。

表5 肠道微生物菌群丰度差异 %
3 讨论
饲粮是畜禽动物赖以生存的基础,通过肠道消化酶摄取其营养成分如蛋白质、糖类、水分和脂肪等,然后合成机体所需的物质并释放能量来维持生命活动,而将不被消化酶分解的成分(纤维素、木质素等)运送至肠道后段,依靠肠道微生物作用进行消化吸收,为机体提供所需的代谢底物、酶和能量[14]。肠道微生物主要包括保护机体免受伤害及提高机体免疫力的共生微生物和使机体感染或诱发疾病的有害微生物[15],均依附于机体提供的营养物质来生长繁殖,受到饲粮组成成分影响。因此,饲粮纤维源的不同将引起肠道微生物菌群组成的变化[16]。
目前,饲粮纤维的来源主要是干草、秸秆和农副产品等,其选择依据是种植广泛、营养丰富、产量高和适口性好,备受畜禽动物的喜爱[17-20]。因此,本试验选用苜蓿、黑麦、燕麦和花生秧作为纤维源来探讨其对鹅肠道微生物菌群的影响,在此采用了高通量测序法从分子水平来检测微生物菌群种类及数量,并进行了OTU分类、多样性指数及群落结构等统计分析。与前人[21]研究结果相比,该研究的微生物菌群多样性明显提高,优势菌门属种类及相对丰度有所差异,这可能是由于高通量测序法与传统的培养法相比有明显的优势,前者对细菌的覆盖率和准确性更高,错误率较低[22]。此外,所选鹅品种、肠道黏膜发育状态、纤维源类型也可能是造成差异的原因。
本试验结果表明,饲喂苜蓿、燕麦、黑麦和花生秧等4种纤维源饲粮对鹅肠道微生物菌群多样性无显著性影响(P>0.05),表明它们之间的肠道微生物菌群组成基本一致,而肠道微生物菌群组成主要受遗传和环境因素的影响[23],因此,推测不同纤维源对肠道菌群无显著性影响的原因:一是该研究对象为四川白鹅这一品种,其遗传背景一致;二是饲养的外部环境条件完全一样,如温度、湿度、光照等;三是不同饲粮纤维组成相同,均包含中性、酸性和碱性洗涤纤维,区别在于各组分所占比例不同。虽然纤维源对微生物菌群多样性的影响从统计学上来看不显著,但相互之间也存在高低差异,比如花生秧组多样性高于其他组,这主要与花生秧的粗纤维含量高有关,即粗纤维含量越高,相应的降解酶种类需要量越多,其微生物多样性越高[24]。肠道微生物菌群的丰度分析显示各纤维源组的优势菌门主要是Firmicutes和Bacteroidetes,两者占到总丰度的80%以上,此与前人对反刍动物瘤胃及家禽肠道微生物菌群的研究结果基本一致[25-26],但各菌门比例略有不同,这主要与动物种类有关。
DE FILIPPO等[27]研究发现,Bacteroidetes对纤维具有极强的消化能力。DALY等[28]发现,Firmicutes和Bacteroidetes包含有许多纤维分解菌。上述结论以此佐证了本研究中优势菌属(Bacteroides、Ruminococcus、Megamonas)均为杆菌门下菌属的合理性。此外,苜蓿和燕麦组的纤维素分解菌门的数量有所升高,这与PITTA等[29]研究指出的纤维素分解菌门(属)数量与纤维素含量呈正相关的结论一致。
对微生物菌群相对丰度进行差异性分析发现不同的纤维源在门水平上显著影响Lentisphaerae,研究证实Lentisphaerae的丰度与纤维二糖的降解有关[30]。本试验中燕麦组和苜蓿组Lentisphaerae丰度高于黑麦组和花生秧组,可能归因于前者可溶性纤维含量较高,需要更多的Lentisphaerae来进行降解。在属水平上丰度受到显著影响的有Alistipes、Shuttleworthia、Slackia、Eubacteriumcoprostanoligenes、Bacteroides、Faecalibacterium、Megamonas和Subdoligranulum。Bacteroides可通过编码多种糖苷酶来水解并利用宿主摄入的植物性多糖[31],进而促进碳水化合物的代谢,其丰度与饲粮多糖含量有关[32]。本试验中花生秧组Bacteroides显著高于苜蓿、黑麦和燕麦组,可能是花生秧粗纤维含量较高且植物性细胞壁含量多。Subdoligranulum、Faecalibacterium和Megamonas均属于厚壁菌门,Subdoligranulum和Faecalibacterium可表达乙酰/丙酰辅酶A羧化酶,参与丁酸盐的合成,而Megamonas则主要参与丙酸盐的合成[33]。丁酸盐和丙酸盐等短链脂肪酸的合成与细菌的发酵作用有关,饲粮中可溶性多糖越多,需要的细菌的数量越多。Eubacteriumcoprostanoligenes是可降低胆固醇的微生物[34],其在不同纤维源饲粮组的差异性可能与饲粮所含脂质的量有关。Alistipes和Shuttleworthia是致病菌属,TYRRELL等[35]研究指出Alistipes是革兰阴性厌氧杆菌,具有胆汁抗性,主要存在于病畜肠道和腹部。Slackia主要与人类牙周炎有关[36],但在肠道中的作用尚不清楚。MCDONALD等[37]研究表明珍珠大麦中的纤维会增加仔猪肠道病原菌,提高腹泻率。因此,以上与致病、感染等有关的菌属丰度在不同纤维源饲粮间具有显著性差异,可能是纤维源中的抗营养因子(黄酮、单宁、蛋白酶抑制因子和植酸等)的差异所引起的[38]。
本试验通过对四川白鹅饲喂苜蓿、黑麦、燕麦和花生秧4种纤维源饲粮研究纤维源对肠道微生物菌群结构的影响。结果表明,不同纤维源饲粮对肠道微生物菌群多样性无显著性差异(P>0.05),但可影响菌群结构及显著影响Lentisphaerae、Alistipes、Shuttleworthia、Slackia、Eubacteriumcoprostanoligenes、Bacteroides、Faecalibacterium、Megamonas和Subdoligranulum的相对丰度(P<0.05)。

