丛枝菌根真菌与胡萝卜毛状根双重培养体系研究
张金莲 刘金华 包涵 李冬萍 宋娟 黄京华 陈廷速

摘 要:以发根农杆菌(Agrobacterium rhizogenes)K599诱导胡萝卜产生毛状根,接种丛枝菌根(AM)真菌摩西斗管囊霉(Funneliformis mosseae)建立双重培养体系,研究不同消毒方法、超声波、低温预处理和培养基pH对摩西斗管囊霉孢子萌发的影响及其与胡萝卜毛状根建立双重培养体系的最佳条件。研究结果表明:消毒方法3孢子萌发率最高,孢子污染率最低,15 d孢子萌发率达48.88%,而污染率仅为9.98%;超声波处理能降低孢子污染率11.17%~14.53%;低温预处理可有效提高孢子的萌发率,4 ℃低温处理10 d和15 d效果较好,其萌发率分别为70%和65%;AM真菌孢子在水琼脂培养基萌发最佳pH为6.5,萌发率达到48.50%,pH<5.5或pH>8.0均抑制孢子萌发,pH 5.5和pH 8.0的萌发率分别为15.43%和16.06%。消毒孢子先于水琼脂萌发后,再挑取萌发管多,菌丝较长的孢子并将菌丝生长方向正对毛状根方向进行转接,可以提高双重培养的成功率。MSR培养基为双重培养的最优培养基。胡萝卜毛状根与AM真菌双重培养可为菌根真菌繁殖及相关分子机理研究提供可行有效的途径。
关键词:胡萝卜毛状根;发根农杆菌;丛枝菌根真菌;摩西斗管囊霉;双重培养
中图分类号:S154.3 文献标识码:A
Abstract: Agrobacterium rhizogenes K599 was used to induce carrot hair roots. An in vitro dual culturing system with Funneliformis mosseae and carrot hairy roots was then developed, and factors including methods to obtain axenic, supersonic processing, chilling treatment and medium pH that might affect both AM fungal spores germination and dual culturing were optimized. It was found that the third axenic method resulted in the highest germination rate (48.88%) and the lowest contamination rate (9.98%) at 15 days. Supersonic processing helped reduce AM fungal spores contamination by 11.17% to 14.53%, while a chilling pretreatment at 4 ℃ for 10 days and 15 days increased the germination rate of AM fungal spores to 70% and 65%, respectively. In water agar, the highest germination rate was achieved at a pH of 6.5 (48.50%), whereas spore germination was inhibited when pH was lower than 5.5 or higher than 8.0, with germination rate decreased to 15.43% at pH 5.5 and 16.06% at pH 8.0. Furthermore, it was found that the success rate of dual culturing was enhanced when sterilized spores were first germinated on agar medium and long hyphae were then selected for inoculation with their extension direction towards the growth direction of the carrot root. The MSR medium was found to be optimal for dual culture. The successful in vitro dual culture of carrot hairy roots and arbuscula mycorrhizal fungi provides an ideal experimental system to obtain pure AM fungal spores and to conduct future studies on the physiological and molecular mechanism of carrot mycorrhiza.
Keywords: carrot hair roots; Agrobacterium rhizogenes; arbuscular mycorrhizal fungi; Funneliformis mosseae; dual culture
DOI: 10.3969/j.issn.1000-2561.2020.08.005
叢枝菌根(arbuscular mycorrhizal, AM)是自然界中分布最广和最普遍的一种菌根类型,80%以上的陆生植物都具有丛枝菌根[1-2]。AM真菌具有促进植物对土壤中矿质营养吸收,提高植物的产量与质量、在重金属污染修复上的重要作用,在农林业生产上具有广阔的应用前景[3-7]。AM真菌常用活体盆栽繁殖,但大规模繁殖存在成本高,培养周期长等缺点[8],在农林业上的作用受到限制[9]。因此,开展AM真菌的生物学研究,实现AM真菌高效繁殖是AM真菌研究的重要方向[10]。
由于AM真菌不能纯培养,限制了对AM真菌与宿主植物共生机理、AM真菌纯培养及改善宿主植物营养和抗逆性的相关机理研究。利用植物根系或发根农杆菌侵染植物诱导获得的毛状根作为寄主能进行AM真菌的离体培养。由植物根系建立的共生体系生长缓慢,而离体毛状根能够在无激素培养基上快速生长,同时存活时间较植物根系长,也能保持良好的遗传特性,是AM真菌双重培养理想的宿主材料[11],有利于开展AM真菌生物学特性研究[12]。
双重培养体系在胡萝卜[13-14]、人参[15]、番茄[16]、大豆[17]、紫云英[18]和白三叶[19]植物中已经获得成功。但不同发根农杆菌菌株对同一种植物的发根能力有差异,不同AM真菌菌株与不同植物毛状根的亲和力也不相同。利用发根农杆菌A4、LBA9402和R100菌株诱导胡萝卜毛状根,最终LBA9402未能诱导出毛状根,A4诱导能力强于R100[14]。离体条件下的孢子萌发是影响双重培养的主要因素,通过解除AM真菌孢子休眠期来提高孢子萌发率[20]。目前只有一些AM真菌的种能与毛状根建立离体的共培养,也许孢子的表面消毒处理影响了萌发,Rhizoglomus irregulare (syn. Rhizophagus irregularis)是最成功的离体双重培养体系[21]。ATCC 11325菌株能诱导胡萝卜产生毛状根,并与Glomus mosseae建立离体双重培养体系[22];K599菌株成功诱导大豆产生毛状根并与珠状巨孢囊霉(Gigaspora margarita)也建立了双重培养体系共生关系[17]。
甘蔗根际土壤有丰富的AM真菌资源[23-25],大田接种AM真菌能提高甘蔗的产量[26-28]。本研究用发根农杆菌菌株K599诱导胡萝卜肉质根产生毛状根,此毛状根生长速度快,能产生许多分枝,材料易获得。利用分离自广西甘蔗根际土壤的优势菌株摩西斗管囊霉(Funneliformis mosseae)孢子侵染胡萝卜离体毛状根,建立双重培养体系,同时对AM真菌孢子萌发条件以及双重培养体系进行优化,探索利用离体双重培养体系大量生产AM真菌孢子,进行规模化生产AM菌剂,推进菌根甘蔗种苗得到推广应用,也为不同AM真菌菌株与植物毛状根共生关系的建立提供参考。这也将有助于研究AM真菌与胡萝卜根系的共生机制、基因的功能及相关的分子机制;为AM真菌与不同植物之间的共生关系及物质和信息之间的传递及AM真菌的应用提供理论指导。
1 材料与方法
1.1 材料
1.1.1 供试菌株和菌剂 发根农杆菌(Agrobacterium rhizogenes)菌株为K599,由华南农业大学王秀荣老师惠赠。AM真菌菌株为从甘蔗根际土壤单孢分离纯化获得的摩西斗管囊霉(Funneliformis mosseae),由广西农业科学院微生物研究所土壤微生物研究室保藏。
1.1.2 植物材料 供试胡萝卜为新鲜胡萝卜(采摘不超过5 d),商品名称为‘韩红六寸参,市售。
1.1.3 所用抗生素、生长素及孢子消毒剂 羧苄青霉素(carbenicillin,Car),乙酰丁香酮(acetosyringone,AS),维生素C(ascorbic acid),头孢噻肟(cefotaxime sodium),氯胺T(源叶生物),链霉素(源叶生物),硫酸庆大霉素(源叶生物)和吐温20。
1.1.4 培养基 (1)农杆菌活化YEP培养基:牛肉浸膏5 g/L+酵母膏1 g/L+蛋白胨5 g/L+蔗糖5 g/L+NaCl 5 g/L+MgSO4·7H2O 4 g/L,pH 7.0;(2)农杆菌预处理培养基:MS液体培养基,pH 5.5;(3)外植体与发根农杆菌共培养的培养基:1%水琼脂+维生素C(500 mg/L)+乙酰丁香酮(100 mg/L),pH 5.5;(4)除菌培养基Ⅰ:1%水琼脂+维生素C(500 mg/L)+乙酰丁香酮(100 mg/L)+羧苄青霉素(500 mg/L),pH 5.5;(5)除菌培养基Ⅱ:MM培养基(0.3%琼脂)+头孢噻肟(500 mg/L),pH 5.5;(6)孢子萌发培养基:0.8%水琼脂培养基;(7)毛状根继代及双重培养的培养基:MM、MSR培养基,pH 5.5。
1.2 方法
1.2.1 胡蘿卜毛状根诱导
(1)发根农杆菌感染菌液的制备。农杆菌活化后,挑取单菌落于YEP液体培养基中28 ℃黑暗培养1 d,200 r/min。用移液枪吸取1 mL摇好的菌液加入MS液体培养基中,震荡培养5 h。当OD600值约为0.6~0.8时,制备成感染菌液。
(2)毛状根的诱导。新鲜的胡萝卜用清水清洗干净后,削去其外表皮,75%酒精浸泡10 s,1%次氯酸钠溶液20 min,无菌水冲洗4~5次后,将胡萝卜横切成约1 cm厚的圆片,分别摆放于12 cm培养皿中的共培养基上,每皿放1片。将活化的菌液滴1~2滴在胡萝卜切片的中心处。25 ℃暗培养3 d后,用无菌水冲洗2~3次,转接到除菌培养基Ⅰ中继续暗培养。期间注意观察、拍照记录胡萝卜切片的变化。每3 d重复转接1次。
(3)毛状根的继代培养。当胡萝卜片形成层产生的毛状根长度为3 cm左右时,无菌操作将毛状根剪下转接到除菌培养基Ⅱ中暗培养(25 ℃),每3 d转接1次,直至细菌除尽,将其转接到不含任何抗生素和激素的MM培养基中进行继代培养。每月转接1次,实现毛状根的扩繁。
1.2.2 摩西斗管囊霉-胡萝卜毛状根双重培养体系建立
(1)无菌AM真菌孢子制备。①AM真菌孢子的超声波处理:采用湿筛倾析法筛选大小、颜色均匀饱满的AM真菌孢子。用超声波震荡法去除孢子表面杂质,具体方法为将挑选的AM真菌孢子放入1.5 mL离心管中,加入0.1 mL无菌水,用封口膜封紧盖口后,放入KQ3200DE型超声波清洗器中超声波处理(功率为40 W,时间2 min)。然后在显微镜下挑取质地均匀,颜色相近,无破损,有活力的孢子。②AM真菌孢子的低温处理:将已进行超声波处理的AM真菌孢子放入4 ℃冰箱中低温处理。时间梯度设计为5、10、15和20 d,同时将只进行超声波处理不做低温处理的AM真菌孢子设置为对照组。③AM真菌孢子的表面消毒:a. 方法1:消毒液为2%(w/v)氯胺T+200 mg/L链霉素+100 mg/L硫酸庆大霉素+2滴吐温20,混匀后过0.22 m滤膜。将AM真菌孢子浸泡在消毒液10 min,无菌水冲洗孢子3~5次后挑入1.5 mL离心管中,于28 ℃下培养3 d后重复消毒1次,待用。b. 方法2:消毒液为5%(w/v)氯胺T+0.04%链霉素+2滴吐温20,混匀后过0.22 m滤膜。将AM真菌孢子浸泡在消毒液10 min,无菌水冲洗3~5次,待用。c. 方法3:消毒液A为2%(w/v)氯胺T和2滴吐温20,混匀后过0.22 m滤膜;消毒液B为200 mg/L链霉素+100 mg/L硫酸庆大霉素混合液。将AM真菌孢子浸泡在消毒液A中10 min,无菌水冲洗3~5次后转入消毒液B中浸泡10 min,无菌水冲洗3~5次,待用。
(2)pH对AM真菌孢子萌发的影响。将消毒的AM真菌孢子接种于pH为5.5、6.0、6.5、7.0、7.5和8.0的孢子萌发培养基中培养,统计孢子的萌发率和污染率,比较培养基不同pH值对孢子萌发的影响。
(3)AM真菌孢子的接种和培养。①方法1:挑取已萌发的孢子转接预先接种了毛状根的MM和MSR培养基中。具体方法:用已灭菌的直径0.5 cm的打孔器把胡萝卜毛状根根尖附近的培养基切下一块并将其移除。同时将相同大小的带有已萌发孢子的培养基块填入到挖空的培养基中,尽量将孢子靠近毛状根,缩短菌丝和毛状根相接触的时间。②方法2:用移液枪将消毒的AM真菌孢子(约20个/皿)接入毛状根附近(直径约2 cm范围内)。
用上述2种方法接种完成后,用医用封口膜密封培养皿,置于25 ℃暗培养。期间,每隔3 d用显微镜观察孢子是否萌发,菌丝能否与毛状根接触建立双重培养。
(4)毛状根菌根侵染检测。毛状根的菌根染色主要参考文献[29]和[30]的方法,在处理时间上略有改动。
1.3 数据分析
采用Excel 2007和SPSS Statistics 20.0软件对数据进行统计分析。运用ANOVA单因素方差分析和Duncan多重比较法进行差异显著性检验。
2 结果与分析
2.1 胡萝卜毛状根的诱导
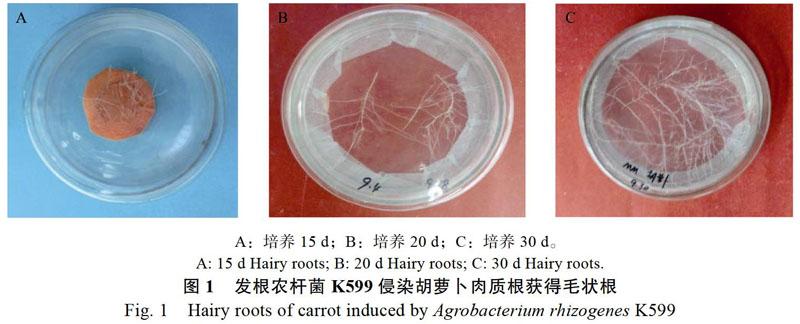
发根农杆菌菌株K599侵染胡萝卜肉质根后,
约15 d长出3~4 cm的毛状根(图1A)。转接入除菌培养基Ⅱ后,20 d毛状根开始分枝迅速生长(图1B)。3次除菌后转入无激素和抗生素的MM培养基,毛状根生长迅速,30 d可长满直径为12 cm的培养皿(图1C)。新长出的毛状根具有多分支、向上或沿培养基生长及无向地性,在不含任何激素的MM培养基中生长迅速等典型特征,可作为宿主用于AM真菌侵染。
2.2 AM真菌孢子萌发条件的优化
2.2.1 不同消毒方法对AM真菌孢子萌发率和污染率的影响 为获得有活力且没有杂菌污染的孢子,从孢子萌发率和污染率来比较3种不同消毒方法的消毒效果。消毒方法1消毒时间长,消毒方法繁琐,从孢子萌发率和污染率来看,消毒效果居中;方法2孢子污染率最高,15 d污染率达31.02%,孢子萌发率为35.94%,萌发率在3种方法中最低,效果最差;方法3既可以获得更多无污染的孢子,且萌发率最高,15 d孢子萌发率达48.88%,而污染率仅为9.98%(表1)。
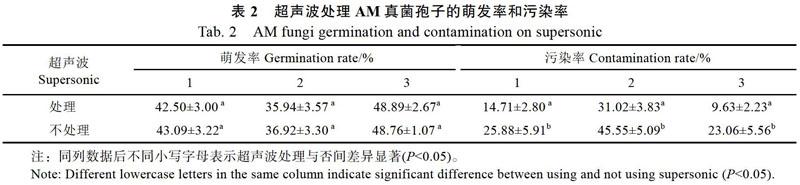
2.2.2 超声波对AM真菌孢子萌发的影响 孢子消毒前是否进行超声波处理,对AM真菌孢子的萌发率没有显著影响,但可以显著降低孢子的污染率。消毒方法1超声波处理比不处理污染率降低11.17%;方法2超声波处理能降低污染率14.53%;方法3超声波处理能降低污染率13.43%(表2)。说明超声波处理在不影响孢子萌发率的同时可进一步减少孢子杂质,利于孢子的彻底消毒。
2.2.3 低温处理对AM真菌孢子萌发的影响 经过低温处理的孢子萌发率均显著高于未经低温处理的孢子。其中,4 ℃低温处理10 d孢子萌发率最高70%,低温处理15 d孢子萌发率最高65%;其次为低温处理5 d和20 d,二者差异不显著。萌发率最低的为未经低温处理的孢子(图2)。
2.2.4 培养基的pH对AM真菌孢子萌发的影响 將已消毒的孢子分别接种于pH 5.5、6.0、6.5、7.0、7.5和8.0的水琼脂培养基。培养第18天,孢子在pH 6.5的水琼脂上萌发率为48.49%,显著高于其他pH的培养基。pH<5.5或pH>8.0时,均会一定程度抑制孢子的萌发,pH 5.5和8.0的萌发率分别为15.43%和16.06%(表3)。
2.3 胡萝卜毛状根与摩西斗管囊霉双重培养
萌发的摩西斗管囊霉(F. mosseae)孢子接入MSR培养基中的毛状根附近后,3~7 d菌丝即与毛状根接触,此后,菌丝生长速度加快,菌丝分枝的数量增多(图3A、图3B)。30~40 d陆续有新的AM真菌菌丝伸出,菌丝相互交错形成菌丝网,继续侵染其它毛状根(图3C、图3D)。未接触到根段的菌丝可分化成3~4级的分枝吸收结构(branched absorbing structures, BAS)(图3C)。50~70 d后,幼嫩的新生孢子开始形成(图3D),培养100~120 d,新生的孢子成熟,形态上与母孢子无明显的差别(图3E、图3F)。
采用Boss蓝黑墨水将侵染后60 d的胡萝卜毛状根染色后,在显微镜下可观察到菌丝进入皮层,并在细胞间隙中延伸,在皮层内形成了大量的根内菌丝,但显微镜下未观察到泡囊和丛枝结构(图3G、图3H)。这可能是由于取样时间的选取问题,丛枝结构已降解而泡囊还未形成。
培养基成分对F. mosseae与胡萝卜毛状根双重培养体系的建立和孢子的形成具有重要影响。萌发的孢子分别接入MM和MSR培养基后发现,MSR培养基更有利于促进孢子的菌丝和根相接触,3~5 d即可与毛状根接触(图3A、图3B);50~70 d后开始有新生孢子产生(图3D)。接入MM培养基的孢子生长速度相对较慢,5~7 d可与毛状根接触,大部分孢子的菌丝未接触毛状根就停止生长。MM培养基中AM真菌不能与胡萝卜毛状根建立双重培养。
3 讨论
利用发根农杆菌K599菌株成功诱导胡萝卜产生毛状根,在无激素和抗生素的MM和MSR培养基中生长良好,30 d可长满直径为12 cm的培养皿。新长出的毛状根具有多分支、向上或沿培养基生长、无向地性和在不含任何激素的MM培养基中生长迅速等典型特征。
溫莉莉, 梁淑娟, 宋 鸽. 丛枝菌根(AM)真菌扩繁方法的研究进展[J]. 东北林业大学学报, 2009, 37(6): 92-96.
Mohammad A, Khan A G, Kuek C. Improved a eroponic culture of inocula of arbuscular mycorrhizal fungi[J]. Mycorrhiza, 2000, 9(6): 165-170.
Vosátka M, Látr A, Gianinazzi S, et al. Development of arbuscular mycorrhizal biotechnology and industry: current achievements and bottlenecks[J]. Symbiosis, 2012, 58(1-3): 29-37.
Kuzovkina I N, Vdovitchenko M Y. Genetically transformed roots as a model system for studying physiological and biochemical processes in intact roots[J]. Russian Journal of Plant Physiology, 2011, 58(5): 941-948.
冉海燕, 江 龙. AM真菌离体双重培养研究进展[J]. 山地农业生物学报, 2016, 35(2): 62-67.
毕银丽, 汪洪钢, 李晓林. VA菌根真菌对转移Ri T-DNA胡萝卜根器官的侵染[J]. 植物营养与肥料学报, 1999, 5(1): 76-80.
马 伟, 李晓玉, 苗位云, 等. 胡萝卜毛状根的诱导及条件优化[J]. 激光生物学报, 2010, 19(6): 843-847.
邢晓科, 李 玉, 王 义, 等. 人参VA菌根真菌双重培养体系的建立[J]. 吉林农业大学学报, 2003, 25(2): 154-157.
王晶晶, 孙淑斌, 徐国华. 丛枝菌根真菌侵染番茄离体毛状根双重培养体系的建立[J]. 菌物学报, 2010, 29(1): 68-74.
李欣欣, 赵 静, 廖 红. 大豆毛状根-VA菌根真菌双重培养体系的建立[J]. 植物生理学报, 2011, 47(5): 475-480.
曹 玲, 赵 斌. AM真菌与紫云英RiT-DNA转化根双重培养体系的建立[J]. 土壤学报, 2011, 48(1): 212-216.
邵菊芳, 朱红威, 杨晓红, 等. AM真菌孢子萌发及其与白三叶草双重培养研究初报[J]. 中国农学通报, 2008, 24(8): 287-291.
Kokkoris V, Miles T, Hart M M. The role of in vitro cultivation on asymbiotic trait variation in a single species of arbuscular mycorrhizal fungus[J]. Fungal Biology, 2019, 123(4): 307-317.
Rosikiewicz P, Bonvin J, Sanders I R. Cost-effiicient production of in vitro Rhizophagus irregularis[J]. Mycorrhiza, 2017, 27(5): 477-486.
肖 翔, 王玉娟, 刘竞男, 等. 丛枝菌根真菌Glomus mosseae单寄主培养体系的建立[J]. 植物病理学报, 2007, 37(3): 325-328.
张金莲, 黄振瑞, 车江旅, 等. AM菌剂对大田甘蔗根际土壤AM真菌种群影响研究[J]. 西南农业学报, 2015, 28(1): 269-273.
陈廷速, 张金莲, 龙艳艳, 著. 广西甘蔗根际土壤AM真菌形态图谱[M]. 南宁: 广西科学技术出版社, 2015.
覃晓娟, 廖 楠, 张金莲, 等. 广西红壤区甘蔗根际土壤丛枝菌根真菌种类的18S rDNA基因序列分析鉴定及多样性分析[J]. 热带作物学报, 2018, 39(11): 2241-2249.
伍荣冬, 谭彩丽, 李廷化, 等. 大田接种丛枝菌根真菌对甘蔗品种“福农41号”生长的影响[J]. 甘蔗糖业, 2015(4): 20-23.
卢李威, 卢文祥, 汪 茜, 等. AM菌剂对甘蔗新品系“柳城07-500”的大田生长效应分析[J]. 中国糖料, 2016, 38(2): 5-7.
伍荣冬, 韦金凡, 龙艳艳, 等. 丛枝菌根真菌对宿根蔗生长的影响[J]. 西南农业学报, 2016, 29(11): 2648-2652.
廖 楠, 张金莲, 李冬萍, 等. 甘蔗根系内生真菌染色方法探讨[J]. 西南农业学报, 2016, 29(4): 814-819.
汪 茜, 龙艳艳, 李冬萍, 等. 5种染色剂对生姜根系丛枝菌根(AM)真菌的染色效果比较[J]. 南方农业学报, 2015, 46(8): 1425-1429.
赵腊梅, 刁亚楠, 金海如. 丛枝菌根真菌孢子最适消毒方法及最佳培养基的研究[J]. 湖南农业科学, 2013(19): 24- 27.
Declerck S, Strullu D G, Plenchette C. In vitro mass- production of the arbuscular mycorrhizal fungus, Glomus versiforme, associated with Ri T-DNA transformed carrot roots[J]. Mycological Research, 1996, 100(10): 1237-1242.
Plenchette C, Declerck S, Diop T A. Infectivity of monoaxenic subcultures of the arbuscular mycorrhizal fungus Glomus versiforme associated with Ri-T-DNA-transformed carrot root[J]. Applied Microbiology & Biotechnology, 1996, 46(5-6): 545-548.
David D. Douds Jr. A procedure for the establishment of Glomus mosseae in dual culture with Ri T-DNA-transformed carrot roots[J]. Mycorrhiza, 1997, 7(2): 57-61.

