针铁矿对羟基磷灰石溶解的影响
范玉超 李如艳 曹勇


摘 要:如今,磷基钝化材料已被广泛应用于重金属污染土壤的治理与修复中,但南方红壤中含有的大量铁氧化物能够与磷结合,会影响磷基材料的溶解特性。以磷基材料羟基磷灰石(HAP)和针铁矿(GTT)为研究对象,考察不同用量的GTT对HAP在溶液中的溶解动力学以及不同pH对HAP溶解的影响。结果表明,HAP的溶解是一个缓慢的过程。期间,溶液pH与磷酸盐表现为先增加,进而趋于平缓,并再次出现增加的趋势。随着针铁矿用量的增加,磷酸盐含量显著降低,但未显著影响溶液pH。提高溶液pH,降低了HAP溶解释放的磷酸盐,且同一pH下,高用量的GTT更利于溶液pH的增加和磷酸盐含量的降低。由此可见,针铁矿能够有效吸附固定磷酸盐,促进羟基磷灰石的溶解。
关键词:羟基磷灰石;针铁矿;溶解
中图分类号 X53 文献标识码 A文章编号 1007-7731(2020)17-0120-03
Effects of Goethite on the Dissolution of Hydroxyapatite
FAN Yuchao et al.
(School of Earth and Environment, Anhui University of Science and Technology, Huainan 232001, China)
Abstract: Phosphorus-based materials are widely used in remediation of heavy metals contaminated soil, but a large number of iron oxides in red soil in southern China may combine with phosphorus, which may affect the solubility characteristics of phosphorus-based materials. The effects of goethite (GTT) on the dissolution kinetics of hydroxyapatite (HAP)in solution under various dosage and pHconditionswere investigated in this paper. The results showed that the dissolution of HAP was a slow process.Solution pH and phosphate content increased first, then maintained stable level and increased again during the dissolution process. With the increase of GTT dosages, the phosphate content decreased significantly, but did not significantly affect the solution pH. Increasing the solution pH reduces the phosphate released by HAP dissolution.Moreover, high dosage of GTT is more effective to increase solution pH and to decrease the phosphate content under the same pH. The above results show that goethite can effectively adsorb and fix phosphate and promote the dissolution of HAP.
Key words: Hydroxyapatite; Goethite; Dissolution
1 研究背景
羥基磷灰石(HAP)是人类骨骼及牙齿的主要组成部分。由于HAP呈弱碱性,难溶于水,具有较高的比表面积、高反应活性等特点,使得其对重金属具有较强的吸附固定能力,被广泛应用于水体和土壤等重金属污染修复[1-3]。此外,与常规磷肥相比,HAP具有磷素释放缓慢、含有大量羟基、淋出率低等优点,并且在减缓土壤酸化、降低水体富营养化风险等方面具有更好的效果[4]。
在我国南方地区分布着大量的红壤,低磷是限制红壤区作物高产的主要因子,同时,该地区也是我国主要的重金属污染集中区。因此,在南方重金属污染红壤区添加HAP,既有利于降低重金属生物活性,又可以促进作物生长。然而,在此过程中,HAP不可避免地会与红壤中的重要组分铁氧化物发生一定的交互作用。研究表明,我国红壤中铁氧化物的含量大多在2%~17%[5-6]。针铁矿(GTT)是红壤中分布广泛的铁氧化物之一,其对磷具有较强的吸附固定能力[7],极有可能会影响对磷的吸附固定,促进羟基磷灰石的溶解。基于此,本研究通过向羟基磷灰石中添加不同含量的针铁矿,考察针铁矿对羟基磷灰石溶解动力学及不同pH的影响,评价铁氧化物对羟基磷灰石溶解的影响,旨在为羟基磷灰石在我国红壤区土壤重金属污染修复的应用提供参考。
2 材料与方法
2.1 材料制备 试验所用HAP纯度>96%,pH=7.2,购自南京埃普瑞纳米材料有限公司。GTT的制备参考Brigante等[8]的方法:向Fe(NO3)3·9H2O溶液中加入的KOH溶液,使其产生红色胶体。进一步烘箱中老化24h后,将沉淀用透析袋陈化,离心分离,真空干燥后,研磨备用。
2.2 试验设计 (1)溶解动力学影响试验:首先,配制一定浓度的HAP母液,按照GTT∶HAP为1∶2、1∶1和2∶1的质量比向50mL离心管中分别添加15mL的HAP和15mL GTT悬液,均以0.01mol/L NaNO3为电解质,处理分别记为:LGH、MGH和HGH,同时设置不加GTT的处理,记为HAP。将离心管25℃恒温水浴下120r/mi震荡,分别在第1~72h和7~21d间歇取样。(2)溶液pH对HAP溶解的影响试验:用HNO3或NaOH调节HAP、LGH、MGH和HGH溶液pH至4.5、5.5和6.5,将离心管25℃恒温水浴下120r/min震荡24h后,离心过滤。
2.3 分析方法 溶液pH采用玻璃电极法测定,溶液中磷酸盐含量采用钼锑抗分光光度法测定[9]。
2.4 统计分析 溶液pH和磷酸盐含量采用均值和标准差表达,单因素方差分析采用SPSS 20.0处理。
3 结果与分析
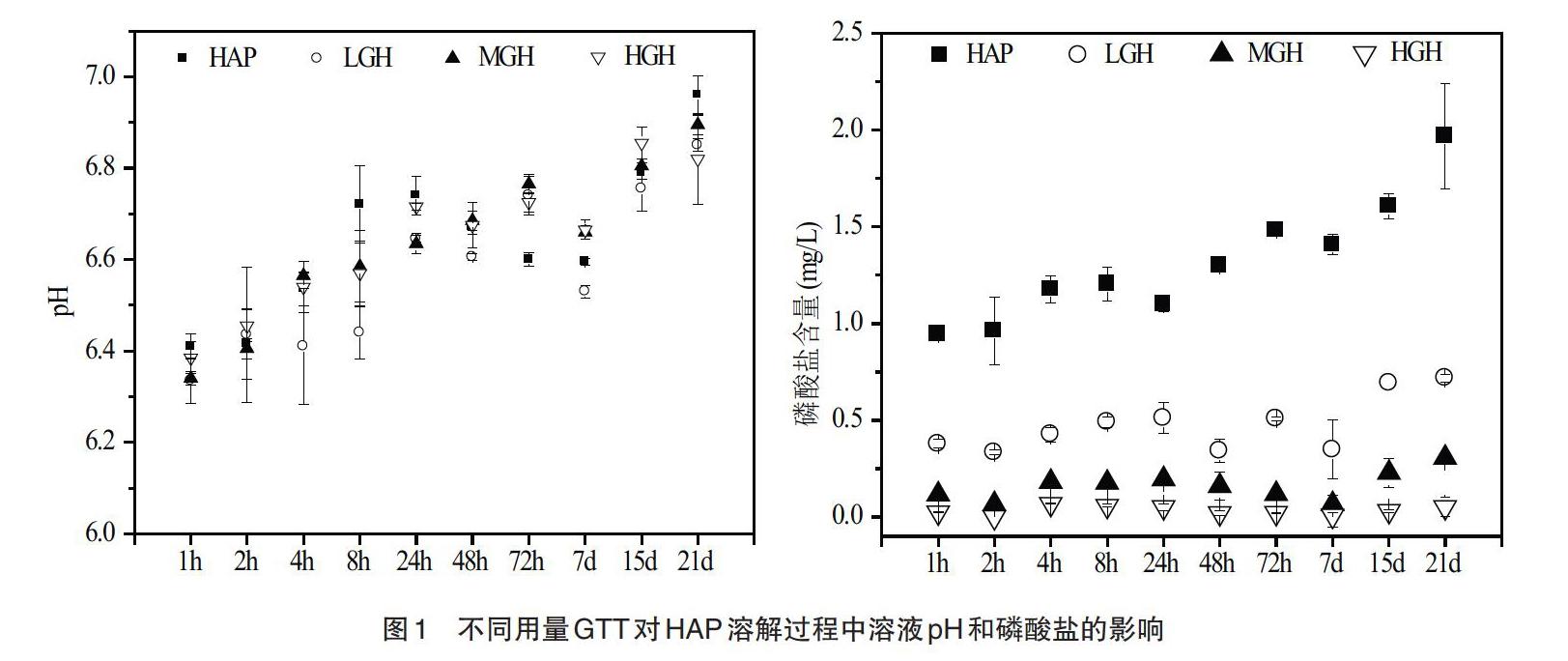
3.1 针铁矿对HAP溶解的影响 由图1可知,在HAP溶解过程中,溶液pH逐渐增加,且不同用量GTT处理未显著改变溶液pH。其中,HAP、LGH、MGH和HGH处理溶液pH从1h的6.41、6.34、6.34和6.39逐渐增加到21d时的6.96、6.85、6.90和6.82,pH分别提高了0.55、0.51、0.56和0.43个单位。HAP处理溶液磷酸盐含量随时间的变化表现出逐渐增加的趋势,其磷酸盐含量从1~24h的0.95~1.10 mg/L缓慢增加到21d时的1.97mg/L。然而,磷酸盐含量随着GTT用量的增加而显著降低,总体上磷酸盐含量大小表现为:HAP>LGH>MGH>HGH。另外,LGH和MGH处理中磷酸盐含量在1h~7d过程中未有显著变化,分别维持在0.38~0.51mg/L和0.07~0.20mg/L,然后在15~21d分别增加到0.72mg/L和0.31mg/L。但是HGH处理溶液磷酸盐含量一直维持在0.01~0.07mg/L。
溶液pH的增加主要是由于HAP本身显碱性,其在溶解过程中会不断释放OH-和H2PO4-,促进体系pH的提高(公式1)。针铁矿零电点在7.4~9.6,自然条件下(pH=4~7时)显正电,因此可以强烈吸附带负电的磷酸盐(公式2~4)。例如,Ioannou等[10]研究表明,针铁矿对磷酸盐的吸附能力最高达到80mmol/kg,且随着溶液pH的降低显著增加。Luengo等[11]证实针铁矿即便显示负电荷时,仍能够强烈吸附磷酸盐,形成非质子化双齿络合物(FeO)2PO2,单齿络合物(FeO)PO3和(FeO)(OH)PO。
相关计算公式如下:
[Ca10(PO4)6(OH)2][+14H+][→][10Ca2+][+6H2PO-4][+2H2O] (1)
[≡Fe-OH+H2PO4-→≡Fe-PO42-+H++H2O] (2)
[≡Fe-OH+H2PO4-→≡Fe-HPO4-+H2O] (3)
[≡Fe-OH+H2PO4-+H+→≡Fe-H2PO4+H2O] (4)
3.2 不同pH溶液的GTT对HAP溶解的影响 如图2所示,在pH4.5时,随着针铁矿用量的增加,溶液pH微弱增加;在pH5.5和6.5时,随着GTT用量的增加,溶液pH显著增加。如pH5.5时,MGH和HGH处理溶液pH较HAP处理分别增加0.18和0.56个单位。另外,对于同一处理,溶液pH与初始溶液pH大小相一致;而且相较于初始pH(4.5、5.5和6.5),溶液pH在初始pH為4.5时提高幅度显著高于pH为5.5和6.5时的增加幅度,这可能是由于低pH下,更能够促进HAP的溶解,消耗大量的H+(公式1)。此外,在pH4.5下,HAP处理磷酸盐含量最高,达到75.1mg/L,且随着溶液pH的增加到6.5,溶液中磷酸盐含量显著降低到4.16mg/L。随着GTT用量的增加,溶液中磷酸盐含量显著降低,其中pH5.5时,HGH处理较HAP处理溶液磷酸盐含量降低88.9%。同样,在LGH、MGH和HGH处理中,磷酸盐含量也随着溶液pH的增加而降低,其中HGH处理磷酸盐含量从pH4.5时的61.8mg/L降低到pH6.5时的0.05mg/L。
本试验中,随着GTT用量的增加,溶液pH增加的原因是GTT呈微碱性,其在溶液中可以形成≡Fe-OH基团(公式5),消耗H+[12-14]。同时,增加GTT用量能够更有效地降低体系磷酸盐,促进HAP溶解,释放更多的OH-。与不同用量GTT对HAP溶解的影响试验结果一致,增加GTT用量有助于溶液磷酸盐含量的显著降低,这有助于降低HAP在环境中的磷释放风险。尤其是HAP处理中磷酸盐含量最低达到4.16mg/L(pH=6.5),是《地表水环境质量标准GB3838-2002》中的Ⅴ类水总磷含量0.4mg/L高出10.4倍,然而HGH处理使磷酸盐含量削减到0.05mg/L,低于Ⅰ类水标准。因此,当HAP应用到红壤中时,由于土壤中大量的铁氧化物存在可以显著降低磷释放导致的水体富营养化风险。
[≡Fe-OH + H+= ≡Fe-OH2+] (5)
由此可见,GTT的存在能够与HAP发生显著的交互作用,尤其是能够强烈吸附磷酸盐。因此,后期有必要考虑不同铁氧化物在土壤中对HAP钝化土壤重金属活性的影响,进一步评估铁氧化物的存在是否影响HAP在土壤中的钝化效果及其可能的环境风险。
4 结论
HAP的溶解是一个缓慢的过程,且随着时间的增加,溶液pH和磷酸盐均逐渐增加;随着GTT用量的增加,能够通过吸附作用显著降低溶液磷酸盐浓度。低pH条件利于HAP的溶解,高用量的GTT促进了溶液pH的增加和体系磷酸盐含量的降低,能够显著降低HAP释放导致的磷释放风险。
参考文献
[1]Mar SS,Okazaki M. Investigation of Cd contents in several phosphate rocks used for the production of fertilizer[J]. Microchemical Journal,2012,104:17-21.
[2]Corami A,Mignardi S,Ferrini V. Cadmium removal from single- and multi-metal (Cd plus Pb plus Zn plus Cu) solutions by sorption on hydroxyapatite[J]. Journal of Colloid and Interface Science,2008,317(2):402-408.
[3]Barka N,Ouzaouit K,Abdennouri M,et al. Kinetics and equilibrium of cadmium removal from aqueous solutions by sorption onto synthesized hydroxyapatite[J]. Desalination and Water Treatment,2012, 43(1-3):8-16.
[4]Liu R,Lal R. Potentials of engineered nanoparticles as fertilizers for increasing agronomic productions[J]. Science of the Total Environment,2015,514:131-139.
[5]Yu HY,Li FB,Liu CS,et al. Iron Redox Cycling coupled to transformation and immobilization of heavy metals: Implications for paddy rice safety in the red soil of south China[J].Advances in Agronomy,2016,137:279-317.
[6]Li JY, Xu RK, Zhang H. Iron oxides serve as natural anti-acidification agents in highly weathered soils[J]. Journal of soil and sediments,2012,12(6):876-887.
[7]Wang D,Jin Y,Jaisi DP. Effect of size-selective retention on the cotransport of hydroxyapatite and goethite nanoparticles in saturated porous media[J]. Environmental Science and Technology,2015,49(14):8461-8470.
[8]Brigante M,Zanini G,Avena M. Effect of humic acids on the adsorption of paraquat by goethite[J]. Journal of Hazardous Materials, 2010, 184(1-3):241-247.
[9]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法(第四版)[M]. 北京:中国环境科学出版社,2002.
[10]Ioannou Z, Dimirkou A, IoannouA. Phosphate adsorption from aqueous solutions onto goethite,bentonite, and bentonite-goethite system[J]. Water Air and Soil Pollution, 2013, 224(3):1-14.
[11]Luengo C,Brigante M,Antelo J,et al. Kinetics of phosphate adsorption on goethite: Comparing batch adsorption and ATR-IR measurements[J]. Journal of Colloid and Interface science,2006,300(2):511-518.
[12]Li XC, Yang ZZ,Zhang C,et al. Effects of different crystalline iron oxides on immobilization and bioavailability of Cd in contaminated sediment[J]. Chemical Engineering Journal,2019,373:307-317.
[13]Zhang C,Yu ZG, Zeng GM, et al. Effects of sediment geochemical properties on heavy metal bioavailability[J]. Environment International, 2014, 73:270-281.
[14]Zhang C, Yu ZG, Zeng GM,et al. Phase transformation of crystalline iron oxides and their adsorption abilities for Pb and Cd[J]. Chemical Engineering Journal,2015,284:247-259.
(責编:张宏民)

