不同Ca2+浓度下猪肉肌球蛋白的热聚集体机制研究
潘 腾 陈 星 沈清武 张 炎 罗 洁
(1.新希望六和股份有限公司, 北京 100102; 2.农业农村部饲料及畜禽产品质量安全控制重点实验室,北京 100102; 3.湖南农业大学食品科学技术学院, 长沙 410128; 4.中国农业大学食品科学与营养工程学院, 北京 100083)
0 引言
肌球蛋白是肌肉组织中的重要蛋白质,占盐溶性蛋白组分的55%~60%[1],其热诱导凝胶特性不仅影响肉制品硬度、黏度等质构特性,同时对肉制品中水分、脂肪及风味物质的保持也有显著影响[2]。近年来,随着消费者健康意识的增强,低脂肉制品的开发成为肉品工业的发展方向。不少学者利用肌球蛋白凝胶构建低脂肉制品模拟体系,通过研究肌球蛋白凝胶机制,探索低脂肉制品品质的改善方法[3-4]。
肌球蛋白的凝胶过程实质上是肌球蛋白的变性与聚集[5]。研究发现,肌球蛋白的变性速率与聚集速率决定了肌球蛋白凝胶的特性。当变性速率小于聚集速率时,肌球蛋白未充分展开,功能基团未充分暴露,多形成粗糙、无序的凝胶网络;当变性速率大于聚集速率时,蛋白结构充分展开,分子间结合充分,可形成均一、有序的凝胶网络。另外,蛋白质聚集体结构与形成的方式显著影响蛋白质凝胶体的形成能力和凝胶特性[6-7]。蛋白质聚集速率主要取决于加热温度,聚集体结构的改变主要取决于蛋白质溶液体系中的离子种类以及溶液pH值[8]。
溶液中Ca2+的存在主要促进疏水性氨基酸基团的暴露,影响蛋白质聚集行为的发生程度[9]。研究发现[10-11], Ca2+浓度较低时,可以形成适宜的蛋白交联程度,凝胶体质构等凝胶特性得到提高;Ca2+浓度较高时,引起蛋白质二级结构发生显著改变,蛋白质聚集体稳定结构被打破,形成大的聚集体,导致蛋白凝胶性能降低。目前,相关研究多针对兔肉、鸡肉以及鱼肉中提取的肌球蛋白,且多集中在对蛋白凝胶形成特性的影响方面。探究Ca2+浓度对猪肉肌球蛋白热聚集过程中聚集体结构改变的影响机制,有利于实现对猪肉肌球蛋白热聚集行为的调控,从而达到良好的蛋白凝胶状态。
本文以猪肉肌球蛋白为研究对象,通过测定肌球蛋白浊度、粒径、变性率、蛋白结构稳定性、Ca2+-ATP酶活、聚集体形态以及凝胶强度,研究不同Ca2+浓度下猪肉肌球蛋白的热聚集行为,及其在热聚集过程中聚集体结构的改变,以揭示猪肉肌球蛋白热聚集形成机制。
1 材料与方法
1.1 材料与试剂
猪通脊肉:北京资源亚太食品有限公司,猪宰后立即取样液氮冷冻,于-80℃冻藏备用。
蛋白Marker(#26630),美国Thermo公司;三磷酸腺苷二钠(ATP·Na2)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(EGTA)等均购于美国Amresco公司;氯化钾、焦磷酸钠、氯化镁、氯化钾等均为国产分析纯。
1.2 仪器与设备
Prometheus NT.48型差示荧光扫描仪,美国 Quantum Design 公司;HT7700型透射电子显微镜,日本日立公司;Zetasizer Nano ZS型纳米粒度分析仪,英国马尔文仪器有限公司;LabRam HR800型显微激光共聚焦拉曼光谱仪,法国 HORIBA JobinYvon 公司;UV-2102PC型紫外可见分光光度计,上海UNICO公司;DELTA 320型酸度计,瑞士梅特勒-托利多公司;Tecan M200 PRO型酶标仪,瑞士Tecan公司。
1.3 试验方法
1.3.1样品制备
肌球蛋白提取:取刚宰杀猪的通脊肉,剔除脂肪和结缔组织,绞碎,用液氮速冻,之后放于-80℃冰箱贮存备用。肌球蛋白的解离纯化参照文献[12-13]的方法。
试验样品制备:将所得肌球蛋白沉淀溶于0.02 mol/L Tris-HCl缓冲液(pH值 6.5)中,并以此缓冲液作为透析液透析24 h,中间透析液更换两次。将透析所得蛋白溶液7等分,各组均加入氯化钠与氯化钙使蛋白溶液中氯化钠浓度均为0.6 mol/L,氯化钙浓度分别为0.01、0.02、0.03、0.04、0.05、0.075、0.1 mol/L,同时配置含有相应氯化钠浓度和氯化钙浓度的0.02 mol/L Tris-HCl缓冲液(pH值6.5),将蛋白溶液中蛋白质量浓度调至20 mg/mL,放于0~4℃贮存,7 d内完成指标测定。
1.3.2浊度的测定
参照文献[8]的方法,将蛋白溶液稀释到2 mg/mL,由20℃升温至80℃,每10℃收集样品一次,以其320 nm处的吸光度来表示蛋白质溶液的浊度。每个样品测定3次平行,取平均值。
1.3.3粒径的测定
参照文献[14]的方法,将蛋白溶液稀释到0.5 mg/mL,由20℃升温至80℃,每10℃收集样品一次,放于1 cm光程的石英比色皿中,散射角为173°。将样品放入纳米粒度分析仪,采用He-Ne激光在633 nm波长条件下进行测定,并用仪器自带软件进行数据分析。每个样品测定3次平行,取平均值。
1.3.4变性率测定及热变性动力学描述
参照文献[15]的方法,将蛋白溶液稀释到5 mg/mL,分别置于30、40、50、60、70、80℃条件下水浴加热1、2、5、10、20、30 min,取出后迅速冰浴放于4℃贮存。取热处理后的样品10 000 r/min离心10 min,取上清液,测定上清液中蛋白浓度,每个样品测定3次平行,取平均值。肌球蛋白热变性率计算公式为
A=(B-C)/B×100%
式中B——热处理前溶液中蛋白质量浓度,mg/mL
C——热处理后样品上清液中蛋白质量浓度,mg/mL
以不同温度、不同时间下肌球蛋白的热变性率为试验数据,进行肌球蛋白热变性动力学描述。
1.3.5蛋白结构稳定性分析
参照文献[16]的方法,利用差示荧光扫描仪进行蛋白结构稳定性的测定,将蛋白溶液稀释到0.5 mg/mL,各组样品10 μL吸入毛细管进行测定,温度范围20~80℃,升温速率1℃/min,测定升温过程中蛋白溶液F350 nm/F330 nm(F350 nm、F330 nm分别表示350、330 nm处的荧光强度)的变化,利用仪器自带软件分析蛋白升温过程中变性温度Tm。
1.3.6Ca2+-ATP酶活测定
参照文献[17-18]的方法,略做修改。将蛋白溶液调至4 mg/mL,分别选取4、20、30、40、50、60、70℃进行样品收集,按照表1配置反应混合液,配置时先将除ATP以外的溶液加入混匀,将反应混合液放于25℃水浴锅中恒温。之后加入ATP溶液,立即开始计时。反应进行3 min,加入2 mL 15%TCA(三氯乙酸)终止反应,之后10 000g离心2 min,取上清。空白组首先加入TCA,之后加入ATP。吸取4 mL上清液,分别加入3 mL 0.05 mol/L Tris-马来酸缓冲液(pH值7.0),振荡混匀,之后加入3 mL定磷试剂(20%维生素c,3 mmol/L H2SO4,3%钼酸铵以等体积混合),放于45℃水浴锅中恒温30 min,取出冷却,测定各组溶液640 nm波长处吸光度。每个样品测定3次平行,通过磷酸标准曲线计算无机磷酸量,取平均值。
Ca2+-ATP酶活性定义为1 mg酶蛋白在1 min内生成的无机磷酸量(μmol)。

表1 反应混合液的配置组成Tab.1 Components of mixed reaction solution
1.3.7肌球蛋白聚集体的形态观察
参照文献[14,19]的方法,利用负染透射电镜技术观察蛋白聚集体形态。将蛋白溶液稀释到0.5 mg/mL,用于负染透射电镜的样品制备。吸取5 μL 热处理后蛋白样品滴于镀碳膜铜网,静置1 min,之后超纯水冲洗3次,滤纸吸干。吸取3.5 μL乙酸铀染液滴于铜网,预染两次,滤纸吸干,之后染色45 s,滤纸吸干,干燥后用于透射电镜观察(加速电压:80 kV)。
1.3.8凝胶强度测定
对经过不同Ca2+浓度处理后的肌球蛋白溶液进行加热处理,选取加热温度60、70、80℃条件下制得的蛋白凝胶进行凝胶强度的测定,将凝胶样品分切为直径2 cm、高1 cm的圆柱体,采用P/50型探头进行两次压缩,压缩比为50%,压缩速度1.0 mm/s。每个处理测定6个平行,记录样品的硬度。
1.4 数据统计与分析
结果表示为平均数±标准差。统计分析均采用软件SPSS 17.0进行。各组间的数值用ANOVA和Duncan多重比较分析,当p<0.05认为具有显著性差异。
2 结果与分析
2.1 肌球蛋白热聚集过程中浊度的改变
浊度的改变可以用于监测溶液中蛋白质聚集的程度,聚集程度越高,光散射越强,溶液吸光度越高,即溶液的浊度越大[15]。氯化钙浓度对肌球蛋白加热过程中浊度的影响如图1所示。研究发现,在20℃时,氯化钙并未对肌球蛋白浊度产生显著影响(p>0.05)。随着温度逐渐升高,各处理组浊度均逐渐上升,各组趋势一致。其中,相同温度条件下氯化钙浓度0.05、0.075、0.1 mol/L处理组浊度高于其他处理组。氯化钙处理条件下,肌球蛋白浊度均在60℃时升高幅度最为显著。当温度升至80℃时,氯化钙浓度0.075 mol/L与0.1 mol/L处理组中肌球蛋白浊度显著高于其他处理组(p<0.05)。文献[9]的研究也表明了不同氯化钙浓度引起体系浊度的改变。
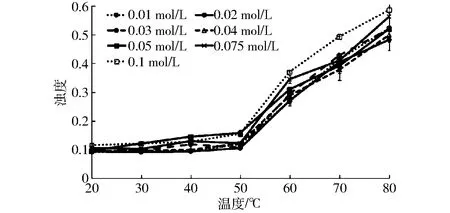
图1 不同氯化钙浓度条件下肌球蛋白加热过程中浊度的改变Fig.1 Effects of CaCl2 concentrations on turbility of porcine myosin during heating
2.2 肌球蛋白聚集体的粒度表征
马尔文粒度分析仪利用动态光散射技术通过测量样品散射光强度起伏的变化得出样品颗粒大小[20],可用于表征蛋白聚集程度。如图2所示,初始温度时,各处理组间平均粒径无显著差异(p>0.05)。随着温度升高,各处理组粒径均逐步上升,氯化钙浓度0.05、0.075、0.1 mol/L处理组平均粒径在升温过程中均高于其他氯化钙处理组。当温度为70~80℃时,氯化钙浓度0.01、0.02、0.03 mol/L处理组平均粒径变化不显著,但是氯化钙浓度0.04、0.05、0.075、0.1 mol/L处理组平均粒径仍在升高,最终粒径分布为1 300~1 400 nm。

图3 不同氯化钙浓度下热处理对肌球蛋白变性率的影响Fig.3 Effects of heat treatment on denaturation rate of porcine myosin with different CaCl2 concentrations

图2 不同氯化钙浓度条件下肌球蛋白加热过程中粒径的改变Fig.2 Effects of CaCl2 concentrations on particle size of porcine myosin during heating
2.3 肌球蛋白热变性动力学分析
对蛋白质热变性动力学进行分析可以明确蛋白受热变化规律,从而更好地利用其热变机能,有利于凝胶制备与品质提升。选取浓度为0.02、0.05 mol/L氯化钙处理组进行肌球蛋白热变性动力学分析。
如图3a所示,0.02 mol/L氯化钙处理下,不同温度处理组随着加热时间的延长,热变性率上升速率均先升高后趋于平缓,当加热时间达到10 min时,随着加热时间的延长,各组热变性率上升速率变化不显著(p>0.05)。当加热时间达到30 min时,70℃与80℃处理组肌球蛋白变性率均达到98%,加热温度60℃处理组肌球蛋白变性率达到89%,加热温度30℃和40℃处理组中蛋白变性率显著低于其他处理组(p<0.05)。0.05 mol/L 氯化钙处理下,肌球蛋白变性率随着加热温度和加热时间的变化趋势与0.02 mol/L 氯化钙条件下变化规律类似。但是,肌球蛋白热变性率升高速率高于0.02 mol/L氯化钙处理组,其中,加热温度80℃条件下,加热时间5 min时肌球蛋白蛋白热变性率即已经达到95%,显著高于其他温度处理组(p<0.05)。0.1 mol/L 氯化钙条件下,各组肌球蛋白变性率上升速率高于0.02 mol/L 氯化钙处理组,其中,加热温度70℃条件下,加热时间5 min变性率即已经达到75%,高于其他氯化钙处理组。加热温度50℃条件下,当加热时间达到10 min后,变性率上升速率高于相同条件下0.02 mol/L 氯化钙处理组。因此,氯化钙浓度升高,肌球蛋白变性率升高速率逐步提高。
D值表征某一恒定温度下90%肌球蛋白变性所需的时间,以某一温度下热处理时间t时刻时蛋白质浓度Ct的对数为纵坐标,以热处理时间t为横坐标,进行作图,所得拟合直线回归方程的斜率取负倒数可得D值[21]。Z值作为一个温差值,表征D值降低90%时温度的变化,可以得出温度对D值的影响,是体现蛋白质热稳定性的重要指标[22]。同样,以某一温度下的D值取对数为纵坐标,以该温度所对应的绝对温度T为横坐标作图,所得拟合直线回归方程的斜率取负倒数可得Z值。不同氯化钙浓度条件下热处理对肌球蛋白热变性的影响如图4,根据所得拟合直线回归方程计算D值,之后肌球蛋白的lgD-T曲线如图5,并根据所得拟合直线回归方程计算Z值,计算所得D值如表2所示,CaCl2浓度0.02、0.05、0.10 mol/L所对应的Z值分别为29.94、29.94、29.07℃。

图4 不同氯化钙浓度条件下热处理对肌球蛋白热变性的影响Fig.4 Effects of heat treatment on thermal denaturation of porcine myosin with different CaCl2 concentrations

图5 肌球蛋白lgD-T曲线Fig.5 lgD-T curves of porcine myosin
氯化钙的加入造成肌球蛋白D值降低,本研究中氯化钙浓度0.02 mol/L与0.05 mol/L处理组间D值无显著差异,但是氯化钙浓度达到0.10 mol/L时,肌球蛋白D值显著小于其他氯化钙处理组,说明随着氯化钙浓度的升高,在0.10 mol/L的氯化钙浓度下,降低了肌球蛋白的热稳定性。因此,氯化钙的加入降低了肌球蛋白的热稳定性。该结果与文献[23]的研究相一致。

表2 不同处理条件下肌球蛋白热变性反应的D值Tab.2 Thermal denaturation D values of porcine myosin with different CaCl2 concentrations s
2.4 肌球蛋白热聚集过程中蛋白结构稳定性分析
对加热过程中肌球蛋白在350 nm与330 nm波长处荧光强度的比值进行测定绘图后,对其曲线进行一阶导数计算,确定肌球蛋白热处理过程中的变性温度Tm,从而可以判断热处理过程中肌球蛋白不同结构域变性行为的发生,确定不同结构域的变性温度,对比不同处理条件下肌球蛋白结构热稳定性。
从图6和表3可知,在钙离子存在条件下肌球蛋白热处理过程中主要有两个结构域发生了解折叠行为,并且两个结构域解折叠行为发生温度不同。研究发现,随着氯化钙浓度的升高,Tm1与Tm2均逐渐下降,其中,当氯化钙浓度由0.01 mol/L升高至0.1 mol/L时,Tm1由40.2℃降至36.5℃,Tm2由52.4℃降至50.8℃,Tm1下降程度大于Tm2,说明Ca2+的加入主要对肌球蛋白中首先发生解折叠行为的结构域产生影响。因此,氯化钙的加入降低了肌球蛋白结构的稳定性,使得肌球蛋白在35~40℃即开始出现第1个结构域解折叠行为,温度高于50℃时,肌球蛋白出现第2个结构域的解折叠行为。

表3 氯化钙对肌球蛋白变性温度Tm的影响Tab.3 Effects of CaCl2 on thermal denaturation temperature of porcine myosin

图8 不同氯化钙浓度下热处理过程中肌球蛋白的透射电镜图(×200 000)Fig.8 Transmission electron microscope of myosin with different CaCl2 concentrations during heating
2.5 肌球蛋白热聚集过程中Ca2+-ATP酶活的变化
Ca2+-ATP酶活性位点位于肌球蛋白头部,可以通过测定肌球蛋白的Ca2+-ATP酶活性变化,来反映肌球蛋白的变性情况[24-25]。Ca2+是激活Ca2+-ATP酶活性的关键因素之一[26],如图7所示,初始温度4℃时,氯化钙0.1 mol/L处理组Ca2+-ATP酶活高于其他氯化钙处理组,说明Ca2+浓度的升高可以激活Ca2+-ATP酶的活性。文献[27]也报道了CaCl2(<50 mmol/L)增加了Ca2+-ATPase活性。随着加热温度的逐渐上升,Ca2+-ATP酶活性逐步下降,其中,温度30~40℃时,Ca2+-ATP酶活下降速率明显。当温度达到50℃时,氯化钙处理组Ca2+-ATP酶活均降为0。因此,Ca2+的加入可以激活Ca2+-ATP酶的活性,同时也促进了蛋白解折叠行为的进行,导致肌球蛋白头部之间更易结合,降低了肌球蛋白热聚集行为的发生温度。
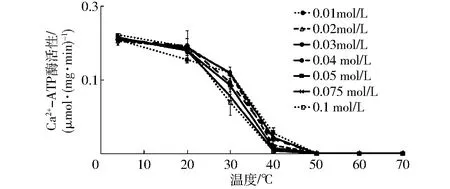
图7 氯化钙对肌球蛋白热变性的Ca2+-ATP酶活性影响Fig.7 Effects of CaCl2 on Ca2+-ATPase activity of porcine myosin during heating
2.6 肌球蛋白聚集体的形态观察
根据不同处理组间蛋白粒径及蛋白结构稳定性的差异,选取具有代表性的氯化钙浓度0.03 mol/L和0.1 mol/L分别在20、50、80℃温度条件下,对蛋白聚集体的形态进行观察。
氯化钙浓度0.03、0.1 mol/L处理组在加热温度20、50、80℃条件下蛋白形态如图8。研究发现,在同一氯化钙浓度条件下,随着温度的升高,蛋白逐渐聚集。氯化钙浓度0.03 mol/L处理组中,在20℃时,肌球蛋白分散于盐溶液中,蛋白之间未发生聚集现象,温度达到50℃时,蛋白之间互相聚集,大部分蛋白头部聚集在一起,尾部向外散射,当温度达到80℃时,蛋白小的聚集体利用向外散射的尾部进一步聚集,形成大的聚集体。氯化钙浓度0.1 mol/L处理组中,在20℃时,肌球蛋白形态与氯化钙浓度0.03 mol/L处理组无显著差异,当温度升高至50℃时,蛋白聚集程度高于氯化钙浓度0.03 mol/L处理组,蛋白除了头部互相聚集,形成聚集体,蛋白尾部也已经开始互相结合,部分蛋白结合成聚集体颗粒链,当温度达到80℃时,蛋白发生团聚,聚集体体积显著增大。
2.7 肌球蛋白热诱导凝胶强度的差异
凝胶强度是表征蛋白凝胶特性的重要指标之一,与肉制品质构品质密切相关,凝胶强度反映蛋白凝胶网络的结构质量,凝胶强度与蛋白聚集体大小及蛋白聚集程度密切相关[28]。
不同氯化钙条件下,肌球蛋白加热过程中凝胶强度的变化如图9。研究发现,同一氯化钙浓度条件下,随着加热温度的升高,肌球蛋白凝胶强度逐渐提高。相同温度条件下,随着氯化钙浓度的升高,蛋白凝胶强度逐渐提高,当加热温度达到80℃时,氯化钙浓度0.1 mol/L处理组凝胶强度显著高于其他处理组,氯化钙浓度由0.01 mol/L升高至0.1 mol/L,凝胶强度由4.58 N升至5.28 N。分析认为,Ca2+

图9 不同氯化钙浓度条件下肌球蛋白加热过程中凝胶强度的改变Fig.9 Effects of CaCl2 concentrations on gel strength of porcine myosin gels during heating
可以促进ε-(γ-谷氨酰基)赖氨酸交联的形成,促进蛋白结构伸展,主要通过增强疏水性相互作用力的方式促进蛋白聚集体的形成,氯化钙浓度的提高使得蛋白聚集体体积增大,使得蛋白凝胶网络粗糙同时硬度增大。
3 结束语
以猪背最长肌中提取的肌球蛋白为研究对象,通过添加不同浓度氯化钙(0.01、0.02、0.03、0.04、0.05、0.075、0.1 mol/L),研究了不同Ca2+浓度下肌球蛋白的热聚集行为。对肌球蛋白进行热变性动力学分析,研究加热过程中聚集体形态结构的变化。结果表明,随着温度的升高、氯化钙浓度的增加,肌球蛋白浊度、粒度、变性率逐步增大;Ca2+浓度增加,降低了肌球蛋白的热稳定性,在温度高于50℃时,肌球蛋白出现第2个结构域的解折叠行为;显著提高肌球蛋白初始状态的Ca2+-ATP酶活性;随着Ca2+浓度的增加,聚集速率加快,形成大体积无序聚集体;随着温度升高、氯化钙浓度增加,凝胶强度增加。

