茵陈苓桂剂对非酒精性脂肪肝病大鼠脂代谢及氧化—抗氧化系统的影响
吴迪 杨晋翔 谢春娥 李峰 李军祥 薛晓轩 王允亮 袁亚利 王乾皓 焦瑶
非酒精性脂肪肝病(non alcoholic fatty liver disease,NAFLD)是指患者在无过量饮酒史的情况下,肝脏出现以肝细胞脂肪变性和炎症反应为主要特征的病理变化,包含多个病变过程,可由单纯性脂肪肝发展为脂肪性肝炎甚至是肝纤维化、肝硬化及肝癌[1]。在世界上,NAFLD的患病率约25%[2],而目前中国患病率在12.5%~35.4%[3],引起大家的格外注意。由于NAFLD是多因素所导致的疾病,其发病机制尚未完全明确,目前得到大家广泛认可的是“二次打击学说”,其中氧化应激和脂质过氧化是“第二次打击”的核心机制[4]。治疗上,单种药物治疗机制比较单一,甚至还具有一定的副作用,中药可多方面进行调节,作用于不同的靶点。茵陈苓桂剂以温运清利法为治疗大法,临床研究[5]发现其对痰浊内阻、湿热瘀结者具有很好的治疗效果,因此本研究通过观察不同剂量的茵陈苓桂剂对NAFLD模型大鼠脂代谢、氧化应激指标的影响,探讨茵陈苓桂剂治疗NAFLD的作用机制,为其进一步应用提供可靠的理论依据。
1 材料与方法
1.1 实验动物与饲料
SPF级雄性SD大鼠60只,体重(200±20)g,均购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。高脂饲料配方为:78.8%基础饲料+10%蛋黄粉+10%猪油+1%胆固醇+0.2%胆酸钠,由斯贝福(北京)生物技术有限公司生产,许可证号:SCXK(京)2015-0015。
1.2 主要药物与试剂
茵陈苓桂剂(茵陈18 g、栀子9 g、大黄6 g、茯苓12 g、桂枝9 g、白术6 g、甘草6 g、绞股蓝15 g、水飞蓟12 g)采用中药配方颗粒,购于北京中医药大学东方医院。阳性对照药为:多烯磷脂酰胆碱,赛诺菲安万特(北京)制药有限公司,批号:国药准字H20059010。
血清天门冬氨酸基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC),ELISA测定血清及肝组织丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、超氧化物歧化酶(super oxide dismutase,SOD)试剂盒均购自南京建成。
1.3 主要仪器
Rm-2235石蜡切片机(德国莱卡公司)、OLYMPUS光学显微镜、全自动生化分析仪(日立,7600)、EG1150H包埋机(德国莱卡公司)、酶标仪(Thermo Scientific)、3K18离心机(sigma)、Multiskan MK3等。
1.4 动物分组、造模与给药
60只大鼠适应性喂养1周后,随机分为正常组10只,造模组50只,正常组给予普通饲料喂养,造模组给予高脂饲料建立非酒精性脂肪肝大鼠模型,所有大鼠均自由摄食、饮水。第8周末,随机处死造模组大鼠2只,取肝组织做病理切片提示造模成功。将造模组大鼠随机分为中药高、中、低剂量组及西药组,每组10只,剩余为模型组。饲养8周后开始药物灌胃干预治疗,给药剂量根据大鼠与人的体表面积等效剂量比值进行折算,中药组给予茵陈苓桂剂,其中低剂量治疗组为4.9 g/kg、中剂量治疗组为9.8 g/kg、高剂量治疗组为19.6 g/kg,西药组予以多烯磷脂酰胆碱0.15 g/kg,正常组和模型组给予等体积的蒸馏水,每日1次,连续4周。
1.5 标本采集与观察指标
末次给药后禁食24小时,次日腹腔注射10%的水合氯醛麻醉,其中茵陈苓桂剂中剂量组的2只大鼠因不耐受麻醉而死亡。腹主动脉取血,经3000 r/min离心15分钟后,分离出血清,并于-80℃下保存。取出肝脏,将肝组织分出2小块,1块置于4%的多聚甲醛液中固定,另1块-80℃冰冻保存备用。
1.5.1 大鼠一般情况 每天观察并记录大鼠的精神状况、饮食及活动度、毛发光泽度等一般情况,在自由进食和饮水情况下,每周固定称量大鼠体重1次。
1.5.2 检测指标 取肝组织于4%多聚甲醛浸泡固定,常规脱水、透明、包埋、切片,常规HE免疫组织化学染色,在200倍光学显微镜下观察肝组织的病理变化情况,NAFLD活动度积分(NAFLD activity score,NAS)参考《中国非酒精性脂肪性肝病诊疗指南(2010年修订版)》[6]。NAS积分(0~8分):肝细胞脂肪变:0分(<5%);1分(5%~33%);2分(34%~66%);3分(>66%);数据统计时,百分数四舍五入以整数计算方式。小叶内炎症(20倍镜计数坏死灶):0分,无;1分(<2个);2分(2~4个);3分(>4个)。肝细胞气球样变:0分,无;1分,少见;2分,多见。NAS积分为三者之和,小于3分可排除非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),大于4分则可诊断NASH,3~4分为NASH可能。取离心后的血清,使用全自动生化仪检测大鼠肝酶以及血脂水平,将肝组织匀浆后,按照ELISA试剂盒的说明书测定各组大鼠的血清及肝组织MDA、SOD、GSH-PX的含量。
1.6 统计学处理
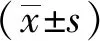
2 结果
2.1 各组NAFLD大鼠的一般情况
正常组大鼠进食正常,活动灵敏,毛发有光泽。模型组大鼠精神萎靡、活动迟缓,毛发颜色较深、光泽感较差,饮食正常,排泄正常,体重增长较快。与模型组比较,西药组、中药各剂量组大鼠精神状态、活动量、毛发光泽度及体重增长情况均有所改善。
2.2 各组NAFLD大鼠肝组织病理观察
正常组大鼠肝组织结构、肝小叶、肝细胞未见明显异常;模型组大鼠肝细胞内存在脂肪变、气球样变,胞质内可见圆形空泡,肝小叶结构被破坏、炎细胞浸润、少许点状坏死;中药各剂量组及西药组大鼠肝细胞脂肪变、脂肪空泡、肝小叶结构及炎细胞浸润均较模型组有不同程度的改善,见图1。与正常组相比,模型组大鼠肝组织脂肪变性情况、NAS积分明显升高(P<0.01);与模型组相比,中药各剂量组和西药组大鼠NAS积分均下降(P<0.05或P<0.01),见表1。

表1 茵陈苓桂剂对各组大鼠肝组织脂肪变性及NAS的影响
2.3 各组NAFLD大鼠肝酶及脂代谢情况
模型组大鼠血清ALT、AST、TC、TG水平明显高于正常组(P<0.01)。与模型组比较,西药组与中药高、中剂量组大鼠血清ALT、AST、TC、TG水平均降低(P<0.05或P<0.01),中药低剂量组大鼠血清AST、TC显著降低(P<0.05或P<0.01),见表2。
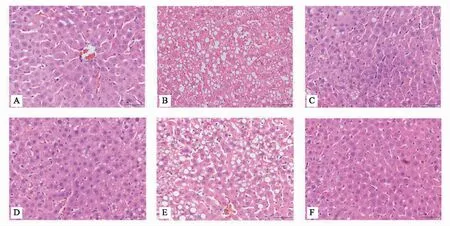
注:A正常组;B模型组;C中药高剂量组;D中药中剂量组;E中药低剂量组;F西药组
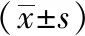
表2 各组NAFLD大鼠血清酶学及血脂水平比较
2.4 各组NAFLD大鼠血清SOD、GSH-PX、MDA的比较
与正常组比较,模型组大鼠血清SOD、GSH-PX水平显著降低(P<0.01),而MDA水平显著升高(P<0.01)。与模型组比较,西药组与中药高、低剂量组SOD、GSH-PX均升高(P<0.05,P<0.01),中药中剂量组GSH-PX显著升高(P<0.01),中药高剂量组MDA降低(P<0.05)。与西药组比较,中药高剂量组GSH-PX显著升高(P<0.01),见表3。

表3 各组NAFLD大鼠血清SOD、GSH-PX、MDA水平比较
2.5 各组NAFLD大鼠肝组织SOD、GSH-PX、MDA的比较
与正常组比较,模型组大鼠肝组织SOD、GSH-PX水平降低(P<0.05),而MDA水平升高(P<0.05)。与模型组比较,西药组与中药高、中、低剂量组GSH-PX均显著升高(P<0.01),西药组与中药高剂量组SOD水平升高(P<0.01),而只有中药高剂量组MDA水平降低(P<0.05)。与西药组比较,中药高剂量组GSH-PX水平升高(P<0.05),见表4。

表4 各组NAFLD大鼠肝组织SOD、GSH-PX、MDA水平比较
3 讨论
人体脂质代谢在肝脏内最为活跃,而脂肪肝是肝脏易发疾病,防治脂肪肝不仅仅对肝脏有益,而且对心血管也极为重要。在发病机制中,氧化应激与脂质过氧化是NAFLD“第二次打击”中主要影响因素,肥胖、代谢紊乱、药物等各种原因导致脂代谢异常,使过多脂质在肝细胞内堆积形成脂肪性病变,在此基础上引起氧化应激,出现脂质过氧化和肝脏抗氧化能力失常。氧化应激过程中可产生更多的活性氧自由基,活性氧自由基对肝细胞膜的脂质及蛋白质进一步氧化,改变肝细胞结构,加重肝细胞的炎症渗出和坏死,使NAFLD进一步恶化[7-8]。
脂质过氧化的最终产物之一是脂质过氧化物(如MDA),其水平的高低与脂质过氧化程度成正比,MDA可以引起炎症,又可以促进活性氧自由基的形成。在机体抗氧化防御系统中,SOD与GSH-PX具有重要作用,均可有效的分解过氧化物、脂质过氧化物,中止脂质过氧化反应,二者水平的高低代表着机体清除氧自由基的能力[9]。SOD、GSH-PX与MDA在机体内保持平衡,若机体的氧自由基产生和消除失衡,便可导致活性氧在体内蓄积,当MDA异常升高时,便超出了SOD及GSH-PX的清除能力,不能保护肝细胞免受损伤,便发生肝细胞脂质过度氧化,损伤线粒体、溶酶体,最终加重肝细胞脂肪变、炎症坏死,加速了向肝纤维化、肝硬化的转变[10-12]。
中医将NAFLD归属为“癥瘕”“积聚”“肝痞”“胁痛”“痰浊”“肥气”等范畴。其病因病机多与外感寒邪、过食肥甘、劳逸失常,情志失调,肝肾亏虚等有关。根据中医理论,认为本病病位在肝,与脾肾有关,肝失疏泄、脾运化障碍,日久伤肾,导致气血运行受阻、痰湿不化,因此形成病理产物痰、湿、热、瘀相互搏结于肝脏,主要病机关键为痰浊内阻、湿热瘀结[13-14]。茵陈苓桂剂由茵陈蒿、栀子、大黄、茯苓、桂枝、白术、甘草、绞股蓝等组成,方中茵陈蒿清热祛湿、疏肝利胆;茯苓、白术健脾祛湿;绞股蓝、栀子、水飞蓟利湿化痰、清热解毒、疏利肝胆;桂枝温阳化气利水;大黄泻热逐瘀;甘草益气和中、调和诸药。全方既有温补,又有清泄,共凑温化痰浊、清利湿热、祛除瘀结之效,使脾气健旺,肝胆疏泄,气血调畅,阳气得运,化痰湿,祛瘀阻[15-16]。
本研究结果显示,模型组大鼠血清AST、ALT、TC、TG水平较正常组显著升高(P<0.01),与模型组比较,西药组与中药高、中剂量组大鼠血清ALT、AST、TC、TG水平均降低,中药低剂量组大鼠血清AST、TC显著降低(P<0.05或P<0.01)。氧化应激指标方面,与正常组比较,模型组大鼠血清、肝组织SOD、GSH-PX水平降低,而MDA水平均显著升高(P<0.05或P<0.01);与模型组比较,西药组与中药中、低剂量组血清与肝组织GSH-PX均升高(P<0.01),西药组与中药低剂量组血清SOD升高(P<0.05),而西药组肝组织SOD升高(P<0.01),中药高剂量组血清、肝组织MDA降低,GSH-PX及SOD水平升高(P<0.05或P<0.01)。与西药组比较,中药高剂量组血清、肝组织GSH-PX显著升高(P<0.01)。肝组织病理结果发现,与模型组相比,各给药组肝组织脂肪变、炎细胞浸润、肝小叶结构均有所改善,NAS积分降低(P<0.05或P<0.01)。
由此可见,茵陈苓桂剂可有效调节NAFLD大鼠的血脂和肝酶,降低大鼠血清、肝组织MDA水平,提高SOD、GSH-PX活性,因此能保护肝功能,调节脂代谢,改善肝脏病理损伤,减少脂质过氧化物的产生,增强抗氧化能力,提示其调节氧化-抗氧化系统的能力可能是茵陈苓桂剂治疗NAFLD的作用机制之一,临床上的治疗效果可能与上述作用有关。

