用于改善认知障碍的靶向α7型尼古丁乙酰胆碱受体正向变构调节剂的研发现状
王佳杰,王新童,李远恒,焦文宣,肖浩然,孙崎*,王克威,3**
(1.北京大学药学院 天然药物与仿生药物国家重点实验室,北京 100191;2.北京大学药学院分子细胞与药理学系,北京 100191;3.青岛大学药学院药理学系,山东 青岛 266021)
1 阿尔茨海默病的临床表现及治疗困境
阿尔茨海默病(Alzheimer's disease,AD),即老年痴呆症,是一种进行性发展的神经退行性疾病。其主要临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,并伴有各种神经精神症状和行为障碍。随着人口老龄化加剧,中国AD致死人数由2005年的第8位上升到2017年第5位,达到45万人左右。2005—2017年的13年间,从死因死亡数变化看,AD致死率增长了62.4%[1]。2018年9月,国际AD协会在官网上发布了2018年年度报告[2],2018年的主题为“3秒钟”,旨在提醒人们每3秒将新增1名痴呆患者。到2030年,预计罹患AD的全球人数将超过7 000万人,治疗花费将高达2万亿美元并成为首位的医疗负担。目前,临床一线使用药物为旨在增加内源性乙酰胆碱神经递质的乙酰胆碱酯酶抑制剂,如他克林、多奈哌齐、加兰他敏等,以及N-甲基-D-天门冬氨酸受体阻滞剂美金刚。遗憾的是这两类药物只能缓解轻微AD患者的病情,同时还会导致较为严重的副作用,如患者容易产生幻觉、意识混沌、头晕、头痛以及疲倦等不良反应;加兰他敏甚至可以导致Stevens-Johnson综合征、急性全身发疹性脓疱病和其他较严重的皮肤反应(如多形性红斑)。此外,脑细胞代谢激活剂、脑血循环促进剂等也仅用于其临床的辅助治疗。
2003—2014年的12年间,几乎所有的新药研发都是靶向剪切β-淀粉样前体蛋白(β-amyloid precursor protein,APP)而产生 Aβ1-42短肽的β-和γ-分泌酶[3-4]。许多在早期研发阶段表现出极具潜力的候选药物在Ⅲ期临床均惨遭失败,其中包括辉瑞/强生和礼来各自投资超过10亿美元的单抗药物bapineuzumab和solanezumab以及罗氏研发的单抗gantenerumab。这些实验性药物虽然可以延缓或阻止β-淀粉样蛋白(amyloid β-protein,Aβ)的聚集,但对患者的认知或者记忆并无益处。有关AD的 Aβ假说也因此受到质疑[5]。一项发表于2016年的研究提示从源头上减少Aβ似乎并不能有效地治疗AD,该研究发现,Aβ是大脑感染后的免疫应激反应;Aβ在大脑细胞组织中扮演有益的角色,而非破坏者;Aβ将入侵大脑的病毒、细菌和真菌等包裹起来,并将有害的病原体聚集成块儿,防止它们感染伤害大脑[6]。
2 阿尔茨海默病的治疗新学说及临床药物研究进展
近5年来,出现了AD的多种致病学说或治疗策略,给处于“严冬”中的AD治疗药物研发带来了机遇和一线希望。这些学说包括:1)tau蛋白磷酸化[7]。研究提示,tau蛋白磷酸化起初对神经元具有保护作用,而Aβ攻击tau蛋白的保护功能直到其功能逐渐丧失。研究人员发现,激酶p38γ的蛋白协助tau蛋白发生保护性的磷酸化修饰和干扰Aβ产生的毒性。2)基因突变学说。在TREM2[8]和CD33[9]基因突变的基础上,科学家还发现早发型AD与21号染色体上的基因有关,特别是APP基因和位于1号、14号上的PS1和PS2(早老素)基因[10]。3)脑膜淋巴管功能障碍[11]。AD小鼠中发现了脑膜淋巴管障碍,因此,脑膜淋巴管有望成为预防和治疗AD的理想靶标之一。4)病毒感染学说[12]。Dudley教授团队在AD患者大脑样本中发现,人类疱疹病毒(HHV)6A和7的水平明显上升,且与AD呈正相关。5)细菌感染学说[13]。加州大学旧金山分校的Stephen Dominy博士领导的团队发现,引起牙周炎的牙龈卟啉菌同样会导致AD。在该研究中,研究者先是在AD患者的大脑中检测到了牙龈卟啉菌的存在,又通过小鼠实验证实牙龈卟啉菌进入大脑后释放牙龈蛋白酶。牙龈蛋白酶具有帮助细菌定植、压制宿主免疫系统以及破坏组织等多种作用,并对很多细胞具有毒性。6)运动学说[14-15]。科学家们通过研究鉴别出了一种运动相关的激素——鸢尾素(irisin)。研究者表示,鸢尾素是一种因运动/锻炼而产生的机体激素,其在大脑功能上扮演着关键角色,AD患者机体中携带的鸢尾素水平较低,该激素或能帮助有效减缓AD的进展。7)Aβ堵塞细胞间隙诱发AD[16]。科学家通过磁示踪成像技术研究发现,Aβ的聚集可导致脑部神经元周围微环境阻塞,诱发其细胞间隙内的类淋巴液流动困难,致使代谢废物、激素、营养物质等无法顺利在细胞周围进行交换,失去应有的功能,从而造成深层海马神经元死亡,空间记忆缺失。同时研究还证实,应用纳米红光粉碎在脑中由Aβ沉积而成的老年斑,可再次疏通细胞外间隙,恢复细胞间液的流动,从而挽救受损的记忆。8)肠道菌群紊乱导致的老年痴呆[17]。研究人员发现,AD模型小鼠的肠道细菌组成明显不同于健康小鼠,调节肠道菌群极有可能成为预防和延缓AD的新方法。9)小胶质细胞参与引起免疫系统失衡而导致的慢性神经炎症[18]。小胶质细胞是胚胎造血起源的中枢神经系统常驻髓细胞。与大多数组织巨噬细胞一样,小胶质细胞会寻找大脑中的病原体,并支持中枢神经系统的稳态和可塑性。截至目前,有证据表明小胶质细胞在AD发病机制中既可发挥有益作用也会带来有害作用。在AD早期,它们可以监控并清除死细胞及具有毒性的β-样淀粉斑和tau结,但到了AD后期,慢性发炎的小胶质细胞可能在清除碎屑方面变得失去效力,反而喷出有害的细胞因子来破坏附近的神经元,这无疑会加重AD的症状[19]。
相对于其他新的学说,调节肠道菌群治疗AD的药物研发取得了突破性的进展。2018年7月,由中国海洋大学管华诗院士团队、中国科学院上海药物研究所耿美玉教授团队和上海绿谷制药联合研发的甘露寡糖二酸(GV-971)在中国完成了Ⅲ期临床试验,其可以通过调节肠道菌群失衡、重塑机体免疫稳态,进而降低脑内神经炎症,阻止AD病程进展[20]。2019年下半年,GV-971虽在中国获批上市,但其疗效仍需进行长时间临床观察和统计。此外,目前处于美国Ⅱ、Ⅲ期临床的多个小分子药物,如色甘酸-布洛芬的组合(ALZT-OP1)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、 米 诺 环 素(minocycline)、VX-745(neflamapimod)、吡格列酮(pioglitazone)、沙利度胺(thalidomide)等,其抗AD活性均与抑制神经炎症的作用机制相关。
目前,从Ⅱ、Ⅲ期临床试验阶段的药物的作用机制看,提高认知症状是AD治疗药物研发的活跃领域(见图1紫色部分)。
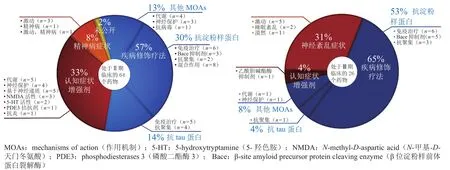
图 1 目前Ⅱ、Ⅲ期临床试验阶段治疗阿尔茨海默病药物的作用机制[21]Figure 1 Mechanisms of action of agents for treatment of Alzheimer's disease in phases II and III clinical trials [21]
3 α7型尼古丁乙酰胆碱受体变构调节剂及其改善认知障碍作用
3.1 α7型尼古丁乙酰胆碱受体特点及调节剂的类型
α7型尼古丁乙酰胆碱受体(α7 nAChR)是同源五聚体跨膜蛋白组成的配体门控离子通道超家族的成员,该超家族类似的受体还包括5-羟色胺(5-HT3)受体和GABAA等受体[22]。α7受体具有高钙离子通透性(PCa∶PNa 约为10),调节钙的活化和乙酰胆碱递质的释放,直接影响认知和记忆功能。α7 nAChR分布在海马和相关皮层,敲除α7 nAChR会导致小鼠注意力不集中和学习能力下降等现象[23]。
基于AD致病机制的胆碱能缺陷假说,提高胆碱能神经系统的功能仍是目前抗AD药物研发的主要策略,体现在增强胆碱能神经系统的功能靶向α7 nAChR的新型激动剂和正向变构调节剂的研发。
EVP-6124是选择性部分激动α7 nAChR的最具代表性化合物[24],其在大鼠模型中能很好地透过血脑屏障,在其治疗精神分裂症的Ⅱ期临床试验中显示了明显改善认知功能和阴性症状(如感情淡漠、思维混乱等)的功效[25]。但Ⅲ期临床试验结果表明,EVP-6124在提高试验对象的认知水平方面并未表现出比安慰剂更好的效果。2015年9月FDA在对其治疗AD的Ⅲ期临床试验中报告了胃肠道副作用[26],2016年3月24日,FORUM Pharmaceuticals公司正式宣布其Ⅲ期临床试验失败,研发终止[27]。
研究人员于1965年初次提出了变构调节的概念,用来解释抑制剂不是底物空间类似物时特定酶在代谢途径活性的反馈抑制[28-30]。1965年,科学家们发现可以将Monod-Wyman-Changeux(MWC)模型(见图2[31])应用于神经递质受体[32]。从药理学角度来看,受体可被认为具有3个关键的结合位点(见图2[31]):1)内源或合成激动剂、竞争性拮抗剂结合的正构位点(orthosteric sites);2)生物活性位点;3)变构位点(allosteric sites)。
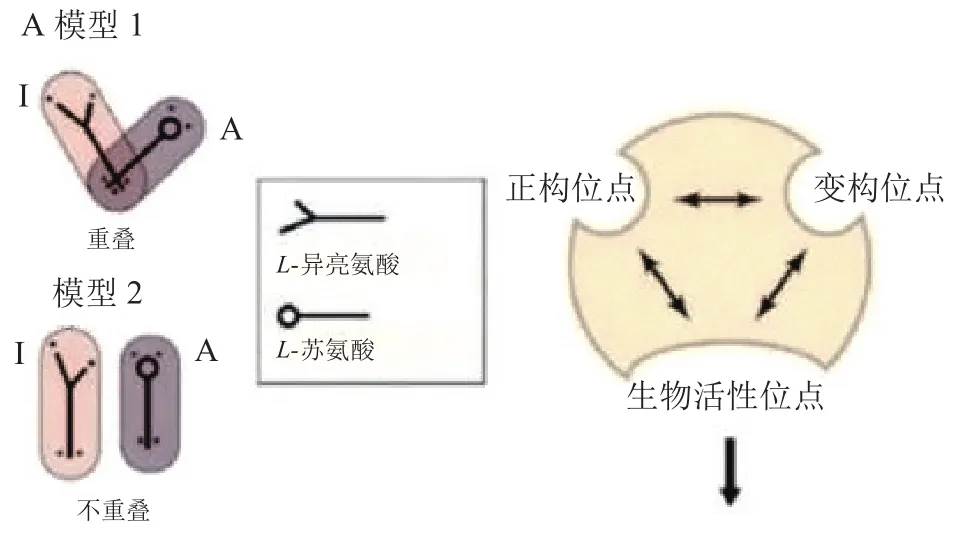
图 2 Monod-Wyman-Changeux模型[31]Figure 2 Monod-Wyman-Changeux model [31]
对于α7 nAChR,正构位点区别于变构位点,激动剂或部分激动剂必须与受体结合且使受体产生离子传导的构象;与变构位点结合的配体则不能单独激活受体,而是通过改变与功能构象相关的能量屏障来调节激动剂诱发的反应[33]。即变构调节剂与受体结合后不会使通道开放,而在激动剂存在的情况下会调节受体的开放程度,表现在电生理上即对激动剂引发的电流大小产生影响。根据影响的方向可将变构调节剂分为正向变构调节剂(positive allosteric modulator,PAM)、负向变构调节剂(negative allosteric modulator,NAM,即非竞争性抑制剂)和沉默变构调节剂(silence allosteric modulator,SAM)[34]。SAM本身对激动剂的电流没有调节作用,但是由于和PAM、NAM等竞争变构调节位点,因此可以减弱或屏蔽PAM、NAM的变构调节作用。此处只介绍α7 nAChR正向变构调节剂(α7 nAChR PAMs)。
不同于激动剂,α7 nAChR PAMs通过内源性递质提高受体的功能表达。由于其不直接作用于受体,不易产生脱敏现象,潜在的毒副作用也会大大下降[33,35]。根据文献,α7 nAChR PAMs具有增加学习记忆的作用[36]。实验表明:缺乏α7 nAChR亚基的小鼠与含有该亚基小鼠的对照组相比,在水迷宫实验中学习记忆能力降低。
根据目前的文献报道,α7 nAChR PAMs可分为Ⅰ型和Ⅱ型两类。Ⅰ型PAM只会增大α7电流的峰值,并不会影响通道的脱敏速度;而Ⅱ型PAM不仅会增大α7电流峰值,还会减缓α7 nAChR脱敏速度,延长通道的开放时间(见图3[37])。Ⅱ型PAM呈现缓慢的反应衰减动力学特征,甚至能够激动已被高浓度激动剂作用脱敏的受体。目前能进入临床研究阶段的基本都是Ⅰ型PAM,Ⅱ型PAM由于导致α7 nAChR过度开放而产生神经细胞毒性,因而很难进入临床研究阶段。另外,随着不断的探索,目前还确定了作用效果介于二者之间的PAM[38-39]。
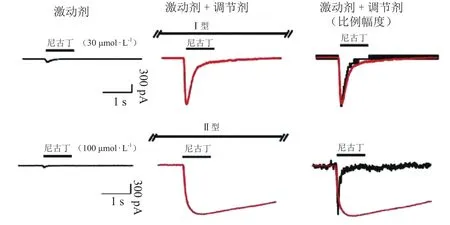
图 3 Ⅰ型和Ⅱ型正向变构调节剂对α7型尼古丁乙酰胆碱受体电流失活动力学影响的差异Figure 3 Comparison between types I and II positive allosteric modulators on desensitization kinetics of α7 nAChR currents
目前对于PAM的变构调节机制有很多种解释,其中一种解释是,PAM降低了α7 nAChR关闭态和开放态之间的能垒,因此通道更容易从关闭态进入开放态,即α7 nAChR对ACh更敏感,图4中实线和虚线分别代表无PAM和有PAM作用下α7 nAChR的关闭态和开放态之间的能垒。大圆点代表激动剂,小圆点表示通道通透的阳离子。另一种解释是,如图5所示,PAM可以使α7 nAChR的脱敏态时的构象变得不稳定,因此通道更倾向于处于开放态的构象[36-37,40]。
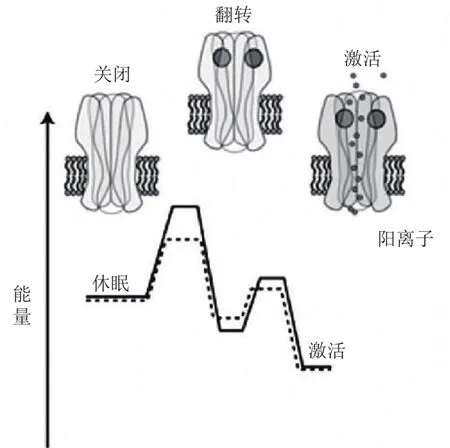
图 4 正向变构调节剂对于α7型尼古丁乙酰胆碱受体关闭态和开放态之间能垒的影响[37]Figure 4 Effects of positive allosteric modulator on the energy barrier between closed and open states of α7 nAChR [37]
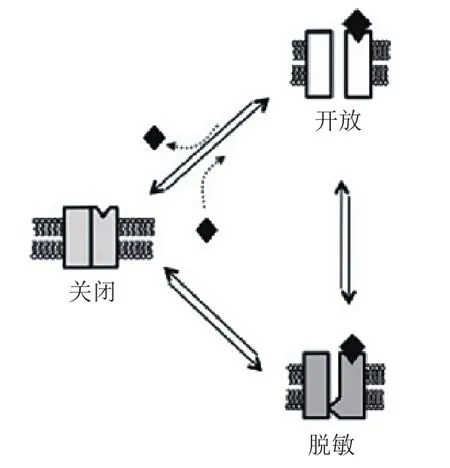
图 5 α7型尼古丁乙酰胆碱受体的关闭态、开放态和脱敏态之间的相互转换[37]Figure 5 Interchange between closed, open and desensitized states of α7 nAChR [37]
3.2 α7型尼古丁乙酰胆碱受体参与的神经抗炎机制研究
α7 nAChR也分布于中枢神经的免疫细胞中,其中包括小胶质细胞。小胶质细胞是中枢神经系统中主要的免疫效应细胞和数量最多的“巨噬细胞”,具有内源性免疫防御功能,约占脑内所有胶质细胞的5% ~ 20%(见图6[41])。小胶质细胞具有分泌炎性因子、细胞因子和神经营养因子等作用,参与脑内的先天性免疫应答,是中枢神经系统抵御外界刺激的第一道防线[42-43]。活化的小神经胶质细胞可以通过释放自由基、细胞因子和毒性因子引起神经元直接或间接损伤,从而加重了炎症反应的强度[44]。Tracey[45]最早系统阐明了关于α7 nAChR在炎症中的作用,提出了胆碱能抗炎途径是免疫系统和神经系统之间的潜在联系(见图7[46])。激动α7 nAChR的活性可以抑制神经炎症,靶向神经炎症中的免疫机制通路可能成为未来治疗或预防AD的策略[47]。
3.3 α7型尼古丁乙酰胆碱受体正向变构调节剂的结构及活性
近年来,科研工作者们致力于探寻活性高且毒性低的α7 nAChR PAMs,最初发现的I型α7 nAChR PAM多来源于现有的、具有其他活性和机制的化合物(1a ~ 1d,见图8),抗寄生虫药1a(伊维菌素,IVM)是首个被定义为α7 nAChR PAM的化合物,其可增强ACh的最大电流并稍稍减少脱敏时长[48]。随后乙酰胆碱酯酶抑制剂1b(加兰他敏)被报道可以增强ACh对α7 nAChR的效应电流[49]。“第1代”α7 nAChR PAM普遍缺少理想的效能、作用强度及选择性。例如,IVM无受体亚型选择性[50];加兰他敏仅有较弱的PAM作用且无选择性[51],并且通过抑制乙酰胆碱酯酶发挥的双重机制发挥改善认知的作用;化合物1c(5-羟色胺)PAM作用较弱且需要较高的浓度(1 ~ 20 mmol · L-1)来增强激动剂电流,并同时调节5-HT3受体;黄酮类酪氨酸激酶抑制剂1d(金雀异黄素)的选择性与活性也并不理想[52]。
为改善“第1代”PAM的不足,越来越多的具有不同作用强度和选择性的小分子被相继报道(2aa ~ 2ak,见表 1)。

图 6 神经炎症和阿尔茨海默病的关系Figure 6 The relationship between neuroinflammation and Alzheimer's disease
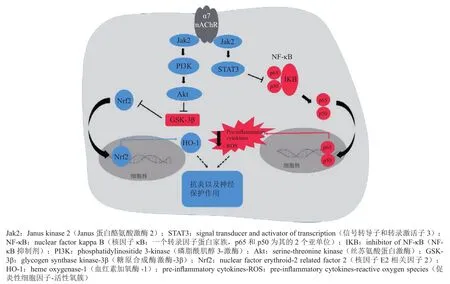
图 7 α7型尼古丁乙酰胆碱受体激活的抗炎级联反应Figure 7 Anti-inflammatory cascade activated by α7 nAChR
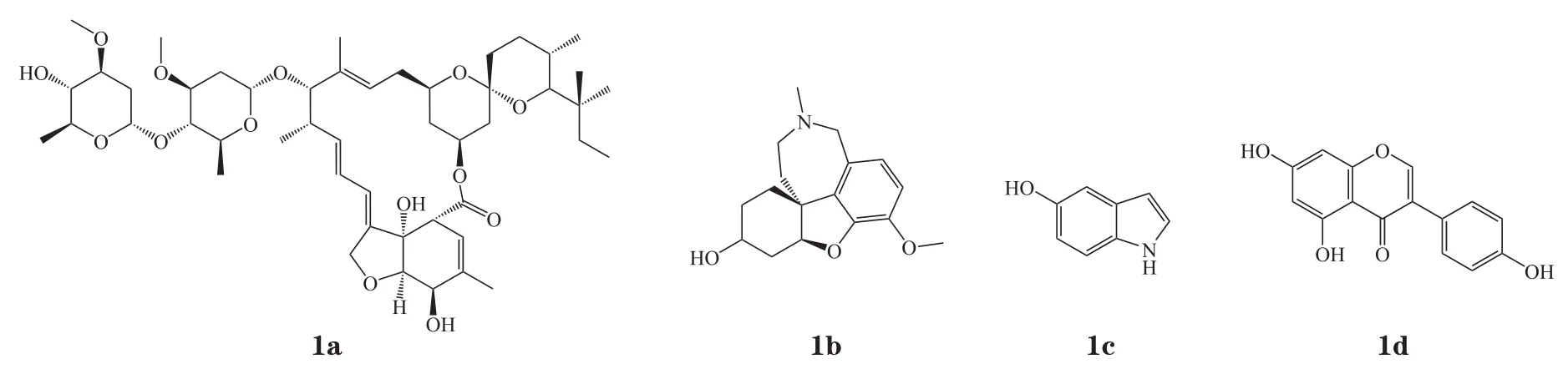
图 8 典型的I型α7型尼古丁乙酰胆碱受体正向变构调节剂Figure 8 Typical type I α7 nAChR positive allosteric modulators
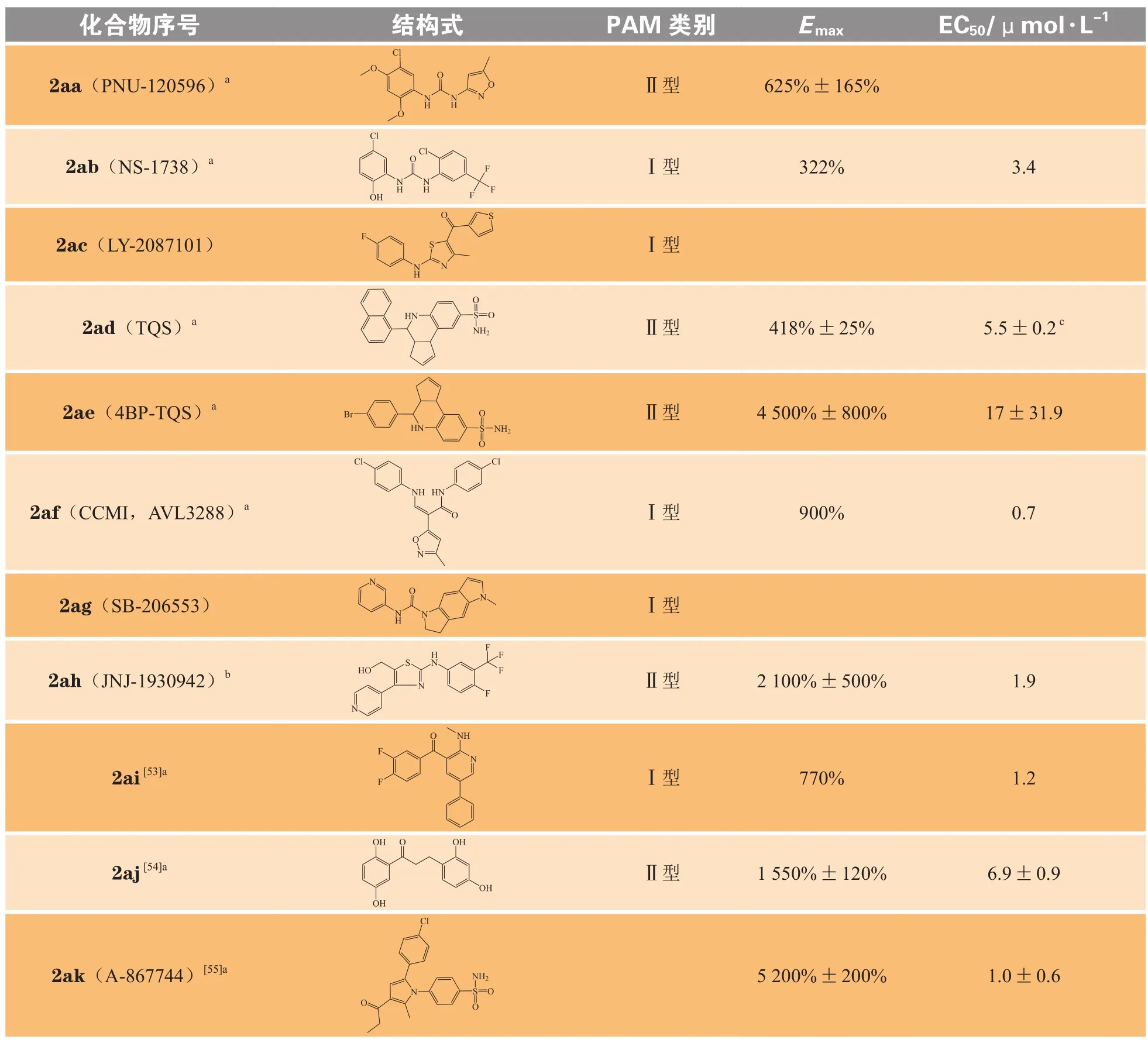
表 1 文献报道的重要α7型尼古丁乙酰胆碱受体正向变构调节剂的结构与活性Table 1 Structure and activity of important α7 nAChR positive allosteric modulators reported in literature
化合物2aa(PNU-120596)是目前研究较充分的首个选择性脲类Ⅱ型α7 nAChR PAM,由辉瑞公司开发,Emax为625% ± 165%[56]。体内研究显示,该化合物可以改善由苯丙胺诱发的大鼠感觉门控障碍,改善在啮齿类短期认知记忆模型中的表现,并且增加cAMP反应元件结合蛋白的磷酸化(cAMP response element-binding protein,CREB),这一生化过程被公认为与学习和记忆有关[57]。然而,通过实验结果可以看出尽管PNU-120596增强了乙酰胆碱酯酶抑制剂在啮齿类动物和非人类灵长类动物中的认知作用,但由于钙离子流入过多而导致其具有潜在的毒性作用,因此无法进入临床试验。
Timmermann等[58]针对是否具有α7 nAChR的变构调节活性,对几千个化合物进行筛选,得到化合物2ab(NS-1738), 其 EC50为 3.4 μmol · L-1;Emax为322%,是一个典型的双芳基脲类衍生物,对α7 nAChR表现为I型PAM。化合物2aa与2ab同为脲类衍生物,但与化合物2aa不同的是,化合物2ab对α7 nAChR的脱敏动力学仅展现出边缘的影响,表明这些分子可能有不同的作用机制或位点,同时化合物2ab 在缓解东莨菪碱引起的认知功能障碍时可增强激动剂效力。2-氨基-5酮噻唑类衍生物2ac(LY-2087101)为I型PAM[59];四氢喹啉类衍生物2ad(TQS)与化合物2aa同为Ⅱ型PAM,其pEC50为5.5,Emax为418% ± 25%[52]。但是将化合物2ad中的萘基转变为4-溴-苯基后得到的化合物2ae(4BP-TQS),其 EC50为 17 μmol · L-1,Emax为 4 500% ± 800%[60],说明取代基的体积大小对于PAM活性具有一定的影响,体积小的取代基对于α7 nAchR 的亲和力更强,活性更强,这为今后的结构修饰提供了思路。
来自加利福尼亚大学欧文分校的研究人员从一个GABAA受体PAM类似物的小型化合物库中筛选出了具有高度选择性的I型PAM——化合物2af(CCMI或AVL3288),通过双电极电压钳测得其EC50为0.7 μmol · L-1,Emax为 900%[61],并且在啮齿类动物模型中,该化合物可以在存在或不存在激动剂的情况下使用,不仅能纠正感觉缺陷而且还能改善认知能力。2017年,化合物2af进入针对精神分裂症的I期临床试验,这表明I型PAM可以安全地应用于人类,并且对神经认知产生潜在的积极作用。文献报道的其他PAM还包括:1)化合物2ag(SB-206553),其最初作为5-HT2B和5-HT2C的拮抗剂被研究,后来发现其能通过I型PAM的机制逆转由地卓西平(dizocilpine,MK-801)诱导的前脉冲抑制(PPI)听觉门控缺陷[38];2)化合物2ah(JNJ-1930942,Ⅱ型PAM),其EC50为 1.9 μmol · L-1;Emax为 2 100% ± 500%[39]。
化合物2aa(Ⅱ型PAM)与化合物2ab(I型PAM)同属于脲类α7 nAChR PAM,但作用类型不同,这种现象也体现在2-芳氨基噻唑类化合物2ac(I型PAM)和2ah(Ⅱ型PAM)上。说明I型和Ⅱ型PAM的作用位点结构非常类似,保持相同母核而改变不同取代基,可以开发不同类型的变构调节剂,作用类型可通过电生理信号或单通道膜片钳记录来确定。此外,表1中化合物2ak(A-867744)于2009年被发现,起初研究人员只是单纯地认为其是Ⅱ型PAM,但随着近年不断地深入研究,发现其在长时间使用时表现为Ⅱ型PAM,但同时其也能像I型PAM那样,以毫秒级的精确度跟踪短暂的激动剂释放脉冲。从治疗角度看,化合物2ak的特殊性似乎很有利,因为其具有一定I型PAM的性质使其在安全性方面比起常规的Ⅱ型PAM要高,但是科研工作者随后证明了在激动剂浓度的生理时空模式下Ⅱ型PAM的作用可能存在很大差异,也就是说,当利用α7 nAChR的PAM作为前瞻性药物进行开发时,有必要对作用机制进行更详细的研究[62]。
尽管这些“第2代”PAM在大体上提供了一定的效用和疗效,但是一些PAMs依然缺少α7受体选择性。例如,化合物2af来自GABA化合物库,2ag是5-HT2B或5-HT2C受体拮抗剂,2ac同时也是α4β2 nAChR 和 α4β4 nAChR 的 PAM;此外,化合物 2ab、2ad、2ak 展现出对 α4β2 nAChR 和 α3β4 nAChR的抑制作用。增加PAM对α7 nAChR的选择性也将成为未来研究的主要方向之一。
4 笔者课题组在α7型尼古丁乙酰胆碱受体正向变构调节剂研发方面的进展
笔者利用课题组发展的10余个新颖的多组分反应[63-65]和金属催化偶联反应[66-72],合成了结构新颖的噻唑并杂环类化合物等。对噻唑环及环上2-位的烷硫基简单修饰之后,构建了一定种类和数量的化合物库。随后经离子通道靶点平台筛选,发现结构新颖的苗头化合物3aa(LD486),并在其具有α7 nAChR PAM活性的基础上,以噻唑[4,5-d]嘧啶-7(6H)-酮为母核进行了结构优化,合成了多个系列近百个衍生物(见图9)。利用双电极电压钳的实验手段,将人源α7 nAChR表达于非洲爪蟾卵母细胞中,以 100 μmol · L-1的乙酰胆碱(ACh)溶液激活α7受体,统计给予 10 μmol · L-1待筛选化合物溶液前后,α7受体尖端电流(即α7电流最大信号)的变化百分比,由此评估待筛选化合物的α7 nAChR的PAM活性强弱。其中化合物3ea(JWX-A1223)在 ACh 浓度为 100 μmol · L-1时的最大电流信号增加1 633% ± 87%(n= 5,见图10A),该化合物的EC50为(1.26 ± 0.18) μmol · L-1(n= 5),Hill 系数(nH)为1.85 ± 0.24(n= 5,见表2)。
靶点选择性研究发现,化合物3ea对其他亚型α3β4 nAChR、α4β2 nAChR 和 5-HT3A无 结合( 见图10B),具有专一性强的优点。另外,初步毒性研究发现,该化合物无明显的心脏hERG(human Ether-a-go-go-Related-Gene,一种表达于心肌细胞的、具有快速激活延迟整流特性的钾离子通道,在心肌动作电位复极过程中发挥重要作用)通道抑制作用。药动学和血脑屏障透过实验发现,其脑组织分布浓度是血浆中的2倍以上。精神分裂症模型小鼠的PPI实验表明,化合物3ea可以浓度依赖性地(剂量为 0.1 ~ 1.0 mg · kg-1)恢复 0.1 mg · kg-1MK-801 所造成的听觉门控失调(见图11)。化合物3ea作为α7 nAChR的PAM,活性好、专一性好、作用部位集中,无明显针对hERG的心脏安全性风险,且在动物实验中也展现了针对小鼠精神分裂症模型较好的恢复作用,这对于后续该母核的进一步结构改造以及靶向α7 nAChR的正向变构调节剂类药物的研究都有着重要的意义。目前该研究结果已发表在权威药物化学杂志JournalofMedicinalChemistry上,并在其2019年第1期专刊——“变构调节剂”上发表[73]。此外,笔者课题组还对候选药物3ea进行了成药性评价,申请了中国专利和国际PCT专利并获美国专利授权。
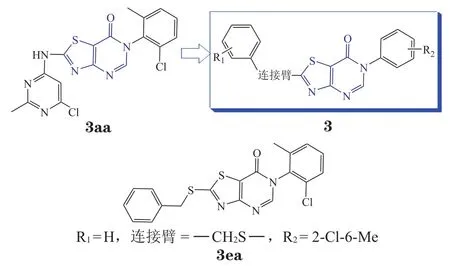
图 9 以噻唑[4,5-d]嘧啶-7(6H)-酮为母核的结构优化[73]Figure 9 Structural optimization of thiazolo [4,5-d]pyrimidin-7 (6H)-ones[73]
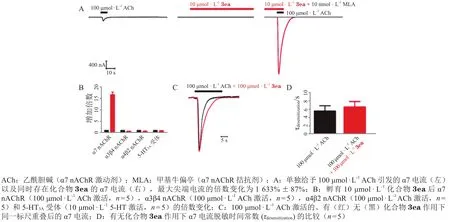
图 10 化合物3ea对爪蟾卵母细胞中表达的人源α7型尼古丁乙酰胆碱受体功能的选择性增强作用[73]Figure 10 Selective enhancement of human α7 nAChR expressed in Xenopus oocytes by compound 3ea [73]
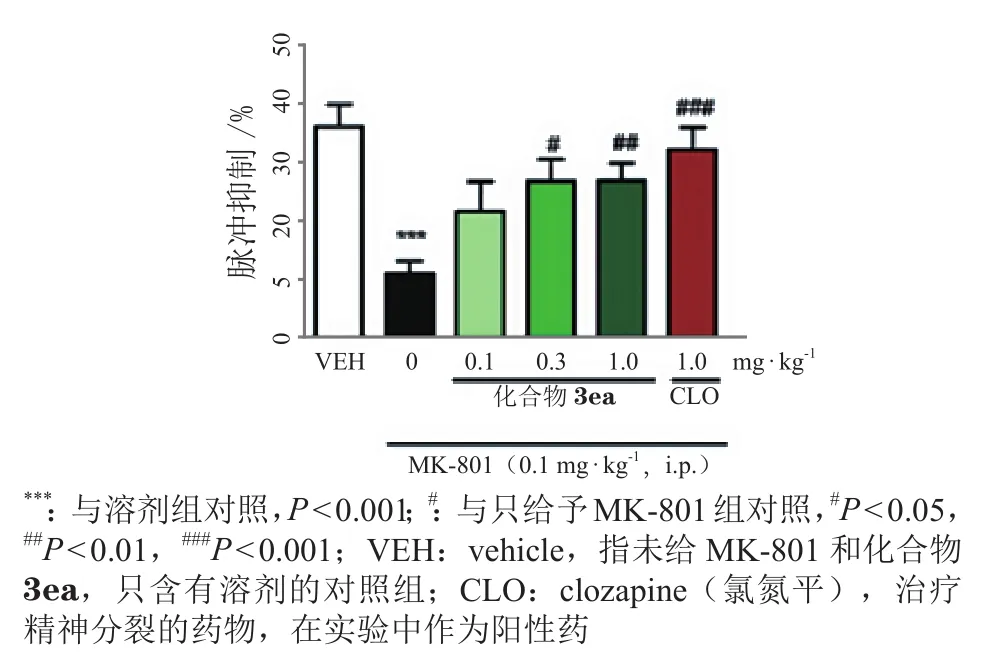
图 11 化合物3ea对于前脉冲抑制损伤的小鼠的逆转效果[73]Figure 11 Reversion of compound 3ea on the prepulse inhibition impairment in mice [73]
此外,笔者课题组最初对苗头化合物4进行修饰,发现将母核换为吡啶环时化合物5的PAM活性显著提高,而这种结构又是烟酰胺类似物6(维生素B3酰胺化后的形式),通过对其结构修饰,开发了一系列新的化合物7;利用相同的双电极电压钳手段评价后发现,该系列化合物为α7 nAChR的I型PAM(见图12)。其中化合物7ai活性较强[EC50=(3.34±1.13)μmol · L-1],在 100 μmol · L-1Ach作用下,α7电流的最大电流信号为1 474%±246%(见图13及表2);相对于其他nAChR和5-HT3A受体亚型,其对α7 nAChR具有高度特异性(见图13B)。综上所述,通过对不同的苗头化合物进行深入的分析和母核改造,笔者课题组得到了以化合物3ea和7ai为代表的两类不同母核的α7 nAChR的Ⅰ型PAM。除化合物3ea系列的噻唑[4,5-d]嘧啶-7(6H)-酮母核外,活性好、作用受体单一的化合物7ai也为笔者课题组后续对于靶向于α7 nAChR的吡啶并嘧啶酮类母核的研发提供了新的思路。目前该研究结果已发表在Bioorganic&Medicinal ChemistryLetters上[74]。

图 12 α7型尼古丁乙酰胆碱受体正向变构调节剂的结构优化及代表化合物7ai [74]Figure 12 Structural optimization of α7 nAChR positive allosteric modulators and the representative compound 7ai [74]
5 结语与展望
老年痴呆病的发病学说和新药研发是当前研究热点并充满挑战。近年来,靶向于α7 nAChR提高学习认知能力、改善老年痴呆病症状,已逐渐成为新的研发共识。
鉴于胆碱受体-神经抗炎通路对抗老年痴呆病的协同作用和笔者课题组对此研究领域的深入认识,笔者课题组未来的工作将集中在以下2个方面:1)系统确证α7 nAChR正向变构调节剂是否发挥既能增强学习记忆能力又降低神经炎症的作用,而成为治疗老年痴呆的一种有效策略或方案;2)完成1 ~ 2个新型噻唑[4,5-d]嘧啶-7(6H)-酮类小分子候选化合物的临床前研究,并推动进入临床试验用于改善老年痴呆症的认知障碍功能。
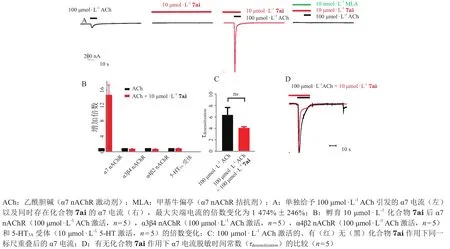
图 13 化合物7ai对爪蟾卵母细胞中表达的人源α7型尼古丁乙酰胆碱受体功能的选择性增强作用[74]Figure 13 Selective enhancement of human α7 nAChR expressed in Xenopus oocytes by compound 7ai [74]

表 2 代表化合物3ea和7ai作用于α7型尼古丁乙酰胆碱受体的正向变构调节活性参数Table 2 The α7 nAChR positive allosteric modulation parameters of representative compounds 3ea and 7ai

