菩提树组培扩繁技术研究

摘要: 以MS为基本培养基,分别加入不同浓度的生长调节物质6-BA、NAA和IBA的组合,对菩提树当年生长健壮的带侧芽茎段进行组织培养,最后筛选出菩提树初代培养的最适培养基为MS+6-BA 0.8 mg/L+NAA 0.10 mg/L +蔗糖30 g/L +琼脂8 g/L;继代增殖的最适培养基为MS+6-BA 1.2 mg/L+NAA 0.05 mg/L +蔗糖30 g/L +琼脂8 g/L;生根阶段的最适培养基为1/2MS+NAA 0.05 mg/L +IBA 1.0 mg/L +蔗糖30 g/L +琼脂8 g/L。同时还筛选出草炭土、细河沙、 壤土以3∶5∶2的比例混合是菩提树组培苗移栽成活率最高的移栽基质,为73.2%。
关键词: 菩提树; 组培扩繁
中图分类号: S 723. 1 + 32, S 687 文献标识码: A 文章编号:1001 - 9499(2020)02 - 0023 - 03
菩提树(Ficus religiosa)为桑科榕属的高大乔木,树高可达20 m。树干挺拔健壮,树冠卵圆形或倒卵形。叶互生,深绿色具光泽,革质,全缘。叶长8~16 cm,叶宽6~12 cm,基部圆形或微心形,在尖端处常有长尾。花期3~4月,果期5~6月。果球形,成熟时红色,表面光滑。菩提树分枝扩展,树形高大,枝繁叶茂,冠幅广展,是优良的观赏树种,还宜作庭院、行道的绿化树种。另外,该树对氢氟酸有较强抗性,还宜作污染区绿化树种。
菩提树种子繁殖需选10年以上的健壮母树,因种子、穗材难得,故常规繁殖手段难以在短时间内繁殖出大量苗木来满足市场需求。故本试验以菩提树当年生长健壮的带侧芽茎段为外植体进行不定芽诱导,筛选出初代培养、继代增殖、生根阶段的最适培养基,同时也筛选出成活率最高的移栽基质,以期完善菩提树组培技术流程,为菩提树组培快繁及实现工厂化育苗奠定理论基础。
1 试验材料
辽西生态试验林场生产科提供的菩提树当年生长健壮的带侧芽茎段。
细胞分裂素6-BA(国药集团)、生长素NAA(国药司集团)、IBA(国药集团)、糖(辽宁省建平县三家糖厂)、琼脂(福建金燕海洋生物)、Hcl(国药集团)、NaOH(国药集团)、高压灭菌设备(上海博讯)。
2 试验方法
2. 1 外植体的选取与处理
于晴天上午,采集生长健壮、无病虫害的菩提树幼嫩枝条作为外植体,除去茎段上的叶片带回试验室,先用自来水冲洗外植体表面的灰尘,再放入洗涤剂溶液中浸泡2~5 min,最后用自来水冲洗干净。将清洗干净的外植体剪成长4 ~5 cm的具1~2个饱满、未萌发芽茎段,并置于超净工作台(已开机、灭菌20 min以上)中进行表面消毒灭菌,先用75%酒精浸泡30 s,无菌水冲洗2~3次,然后按材料的木质化程度,分别用0.1%HgCl2浸泡6~8 min,最后用无菌水冲洗5~6次。
2. 2 培养基及移栽基质的配置
以MS为基本培养基,在高温灭菌前给各阶段培养基分别加入不同质量的细胞分裂素6-BA、生长素NAA和IBA的组合,蔗糖30 g/L,琼脂8 g/L,用0.1 mol/L Hcl或0.1 mol/L NaOH调解pH值至5.5~5.8,高压灭菌压力保持在0.105~0.12 MPa(注意压力不要高于0.14 MPa),时间为20 min。
2. 2. 1 初代培养
以MS为基本培养基,将表面消毒的外植体切去两端,切成1~2 cm长单芽,按照正常生长方向接种到添加了不同质量的细胞分裂素6-BA和生长素NAA的初代培养基中进行不定芽诱导,6-BA设置0.8、1.6、2.4 mg/L 3个浓度梯度,NAA设置0.1、0.2 mg/L 2个浓度梯度,采用完全随机组合,共6个处理(表1)。每处理接种20瓶,每瓶接种1个外植体,30天后观察6个处理对外植体不定芽的诱导率及芽生长状况,确定最佳初代培养基。
2. 2. 2 继代增殖
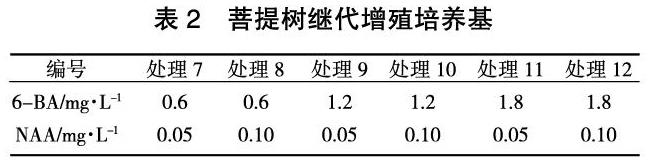
当初代诱导的不定芽高长到1.5 cm及以上时,将萌发的幼芽从基部切下,去掉茎尖,接种到添加不同浓度的细胞分裂素6-BA和生长素NAA的继代增殖培养基中,进行不定芽的增殖培养,6-BA设置0.6、1.2、1.8 mg/L 3个浓度梯度,NAA设置0.05、0.10 mg/L 2个浓度梯度,采用完全随机组合,共6个处理(表2)。每处理接种20瓶,每瓶5个嫩芽,观察培养物生长情况,40天后统计增殖倍数,确定最适继代增殖培养基。
2. 2. 3 生根培养
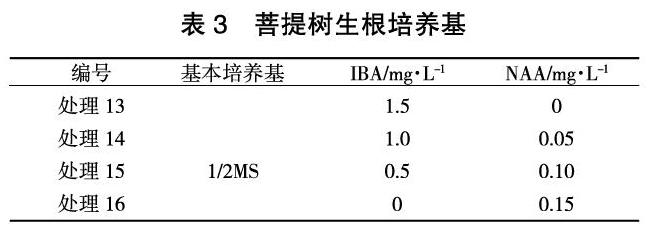
将继代次数已超过4次、高1.5 cm以上、生长健壮的丛生芽切成具2~3片叶片的单芽,接种在以1/2 MS为基本培养基,添加不同质量的生长素NAA、IBA的生根培养基中进行生根培养,生根培养基采取IBA、NAA单独配制及IBA和NAA混合配制的4个配方(表3)。30天后统计平均生根条数、生根率,确定最佳生根培养基。
2. 3 培养条件
在组织培养过程中,温度和光照是重要的环境条件,对生长、分化、生根皆有很大影响。培养室温度设定为25±2 ℃,光照强度为2 500~3 000 Lux,光照时间为14~16 h/天,该条件适用于菩提树各组培阶段组培苗的培养。
2. 4 移 栽
生根培养30~35天,当不定根长至1 cm时,移栽组培苗。移栽基质为以下3种,即細河沙、草炭土∶细河沙(1∶1)、草炭土∶细河沙∶壤土(3∶5∶2),每种基质移栽100株,30天后统计生根条数与生根率。基质混合过程中,需喷洒0.2%代森锰锌水溶液消毒,混匀后堆沤覆膜、压严,灭菌3天,防止菌类的滋生。在移栽的过程中也要防止菌类的滋生,确保适当的光照、温度、水分,尽可能地创造适宜于它生存的环境,帮助其尽快由异养型过渡到自养型,保证成活。
3 试验结果分析
3. 1 初代培养
由不同激素组合对不定芽诱导的影响(表4)可知:在不定芽诱导过程中,不同的激素组合对其影响不同。低浓度的6-BA可促进不定芽的分化,随着浓度增加,虽可促进芽的增殖,但会抑制植物的节间伸长,导致愈伤组织生长过旺。综合来看,处理1,即MS+6-BA 0.8 mg/L+NAA 0.10 mg/L+蔗糖30 g/L+瓊脂8 g/L的萌芽率为53%,芽生长状况也最好,是最适初代培养基。
3. 2 继代增殖
由不同激素组合对不定芽继代增殖的影响(表5)可知:在继代培养过程中,随着BA浓度的增加,不定芽的增殖倍数也随之增加,但当6-BA达到1.8 mg/L时,组培苗开始大量长出愈伤组织,增殖芽部分畸形,增殖倍数降低,影响组培苗的正常生长。综合来看,处理9,即MS+BA 1.2 mg/L+NAA 0.05 mg/L+蔗糖30 g/L+琼脂8 g/L的苗分化多,平均增殖倍数为7.4,分化苗生长健壮、叶色绿,为继代培养最适培养基。
3. 3 生根培养
由不同生长素配比对组培苗生根的影响(表6)可知: NAA和IBA均可以诱导组培苗生根,2种激素配合使用生根效果更好。因此组培苗最适生根培养基配方为处理14,即1/2MS+NAA 0.05 mg/L +IBA 1.0 mg/L +蔗糖30 g/L +琼脂8 g/L,平均生根数5.5条,生根率为93%。
3. 4 移栽基质的确定
由不同基质炼苗成活率及组培苗生长情况调查(表7)可知:不同的移栽基质对菩提树组培苗移栽成活率的影响不同。单独用沙子或草炭土不利于保水,虽然熟表土可促进根的生长,但通透性不好,容易板结,移栽成活率低。因此熟表土中加入草炭土、细河沙,不仅可以提供给幼苗所需的营养物质,还能提高基质的透气性。将草炭土、细河沙、 壤土以3∶5∶2的比例混合应用,移栽成活率最高,为73.2%。
4 结论与讨论
4. 1 菩提树组织培养过程中,植物生长调节物质6-BA、NAA、IBA是培养基中的关键物质,对外植体不定芽诱导、不定芽继代增殖、组培苗生根起着重要、明显的调节作用。
4. 2 在初代培养阶段,培养基中加入NAA和6-BA,可诱导愈伤组织的形成;在继代增殖培养阶段,6-BA和NAA的影响达极显著水平。说明6-BA作为影响菩提组培苗增殖的最主要因素,它可促进细胞分裂和分化,延迟组织衰老,增强蛋白质合成,抑制顶端优势,促进侧芽显著生长,而NAA能够促进增殖组培苗的高生长,并与6-BA存在交互作用,进而影响菩提组培苗的增殖效果。但是当6-BA达到1.8 mg/L时,组培苗开始大量长出愈伤组织,增殖芽部分畸形,增殖倍数降低,影响组培苗的正常生长,继代增殖阶段6-BA的使用浓度不能高于1.8 mg/L。在生根培养阶段,单纯使用生长素NAA和IBA即能诱导根的形成。
4. 3 菩提树组培扩繁技术研究的成功为菩提树的快速繁殖开辟了一条新途径,解决了常规的繁殖手段难以满足生产需要的矛盾,为菩提树的规模化人工种植奠定了基础。
参考文献
[1] 曹孜义, 刘国民. 实用植物组织培养技术教程[M]. 甘肃科学技术出版社, 1999
[2] 邓正正, 李超峰, 王立华. 菩提树的组织培养及快速繁殖[J]. 植物生理学通讯, 2005(6): 795.
第1作者简介: 黄立华(1971-), 女, 本科, 高级工程师, 主要从事植物组织培养研究。
收稿日期: 2019 - 12 - 21
(责任编辑: 李 丹)

