超声造影引导下单极射频消融与无接触多极射频消融治疗肝肿瘤的对比研究
陈 萍 唐春霖 陈凯旋 谭 鹰 马宽生 夏 锋 冯 凯 柴跃龙 郭燕丽
超声引导下射频消融(radiofrequency ablation,RFA)是目前微创治疗肝肿瘤的常用方法,具有实时、无辐射、创伤小等优点[1]。传统的单极射频消融(MRFA)因肿瘤治疗边缘不足或无足够的坏死体积,容易引起残留。无接触多极射频消融(No-touch RFA)是近年提出的治疗肝肿瘤的新方法[2],其使用多根电极针置于肿瘤周边进行治疗,不直接穿刺肿瘤,要求引导RFA 治疗的超声医师准确测量病灶大小并定位肿瘤的边缘位置。术中使用超声造影引导RFA 治疗能够实现精准定位,实时显示穿刺进针过程,确保穿刺的准确性和安全性,有助于临床制定消融计划,提高RFA 治疗成功率[3]。本研究回顾性分析在我院肝胆外科行超声造影引导下M-RFA 和No-touch RFA 治疗肝肿瘤患者的病历资料,分析两种治疗方法的疗效,比较其临床应用价值。
资料与方法
一、研究对象
选取2015 年2 月至2017 年5 月在我院肝胆外科行超声造影引导下M-RFA 和No-touch RFA 治疗肝肿瘤的患者94例,其中M-RFA组44例,男39例,女5例,年龄24~76 岁,平均(54.0±11.9)岁,病灶平均直径(16.45±4.44)mm,有乙肝病史者43例;No-touch RFA组50 例,男46 例,女4 例,年龄33~76 岁,平均(51.4±10.4)岁,病灶平均直径(19.65±4.94)mm,有乙肝病史者47 例,丙肝病史者1 例,酒精性肝病患者1 例;两组术前病灶大小比较差异无统计学意义。纳入标准:术前均经影像学检查发现肝肿瘤,均为单发病灶,肿瘤直径<25 mm;无腹水,无严重的心、肝、肺等重要器官功能障碍;术前凝血功能、血常规及肝肾功能检查结果均正常。本研究经我院医学伦理委员会批准,患者或家属均签署知情同意书。
二、仪器与方法
1.仪器与试剂:使用西门子Acuson Sequoia 512 和迈瑞Resona 7 彩色多普勒超声诊断仪,探头频率4.5~5.0 MHz;配备实时造影匹配成像技术,机械指数0.04~0.06。RFA 使用四川绵阳立德电子股份有限公司生产的LDRF-120S 型多极射频消融仪。超声造影剂为意大利Bracco 公司生产的注射用六氟化硫微泡(SonoVue®),加入5.0 ml 生理盐水振荡均匀配制成造影剂混悬液备用。
2.方法:RFA 治疗前1 周行超声造影、肝肿瘤特异性MRI 或增强CT 两种以上影像学检查,确定肿瘤位置、大小、数量、血供及周边毗邻情况。治疗时采用超声造影实时引导,于患者肘静脉团注超声造影剂混悬液2.0 ml~2.5 ml,再次确定肿瘤范围、边界及其毗邻关系。患者于全身麻醉下行RFA 手术,选取最佳进针路径,避开大血管、胆管及周边重要脏器,确定射频电极针的数量及消融时间,穿刺点作体表标记,于超声造影引导下行穿刺活检,然后将射频电极针经皮穿刺进入肝内。M-RFA 组采用一根电极针直接穿刺肿瘤,电极针置于肿瘤的中心位置(图1A);No-touch RFA 组则采用无瘤原则,将两根电极针置于肿瘤周边(图1B),电极针不接触肿瘤,两根针同时进行消融。超声造影实时监控消融治疗,评估灭活范围,确认一过性强回声的范围超过肿瘤大小后,拔出消融针,退针过程中常规对针道进行消融,退针后超声观察消融区域、周边及肝周,记录有无出血、气胸等并发症。
3.疗效评价:RFA 术后3 d 内复查超声造影,比较两组肿瘤灭活情况,并检查患者肝功能、血小板、甲胎蛋白(AFP)等实验室指标,记录有无并发症发生。随访24个月,于RFA术后3个月、6个月、12个月、18个月及24 个月复查超声造影、肝肿瘤特异性MRI 或增强CT。超声造影评价疗效指标:动脉相原病灶区域消融灭活范围大于原病灶大小,呈无增强区,无残留的增强活性区。
三、统计学处理
应用SPSS 22.0 统计软件,计量资料以x±s 表示,组间比较行t 检验;计数资料以例或百分比表示,行χ2检验。生存分析采用Kaplan-Meier 生存曲线表示,组间比较行Log-Rank 检验。P<0.05 为差异有统计学意义。
结 果
一、两组治疗后肿瘤灭活情况比较
RFA 治疗结束时,病灶区域呈气化强回声区(图2A),术后3 d内复查超声造影,原病灶区域呈无增强区(图2B)。M-RFA组44例患者经RFA治疗后超声造影测量肿瘤灭活范围平均值为38.36 mm×31.31 mm,其中4例患者肿瘤残存少许活性增强区,消融不完全,肿瘤完全灭活率为90.90%(40/44);No-touch RFA 组50 例患者经RFA 治疗后超声造影测量肿瘤灭活范围平均值为46.70 mm×35.82 mm,其中1例患者肿瘤消融不完全,残存少许活性增强区,肿瘤完全灭活率为98.00%(49/50)。两组肿瘤完全灭活率比较差异有统计学意义(P<0.05)。
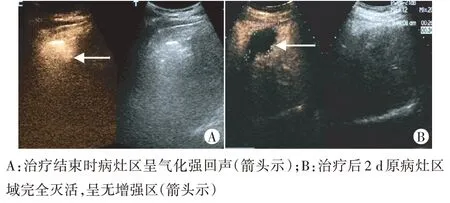
图2 M-RFA组同一患者RFA治疗结束时及治疗后2 d超声造影图
二、两组治疗前后实验室检查指标比较
M-RFA组AFP阳性患者21例,术后1个月9例明显下降,12例转阴;No-touch RFA组AFP阳性患者20例,术后1 个月6 例明显下降,14 例转阴,两组术前术后AFP 水平比较差异均有统计学意义(均P<0.001)。两组患者术后碱性磷酸酶水平较均术前略有上升,但差异无统计学意义;其余实验室检查指标比较差异均无统计学意义。见表1。
表1 两组治疗前后实验室检查指标比较(±s)
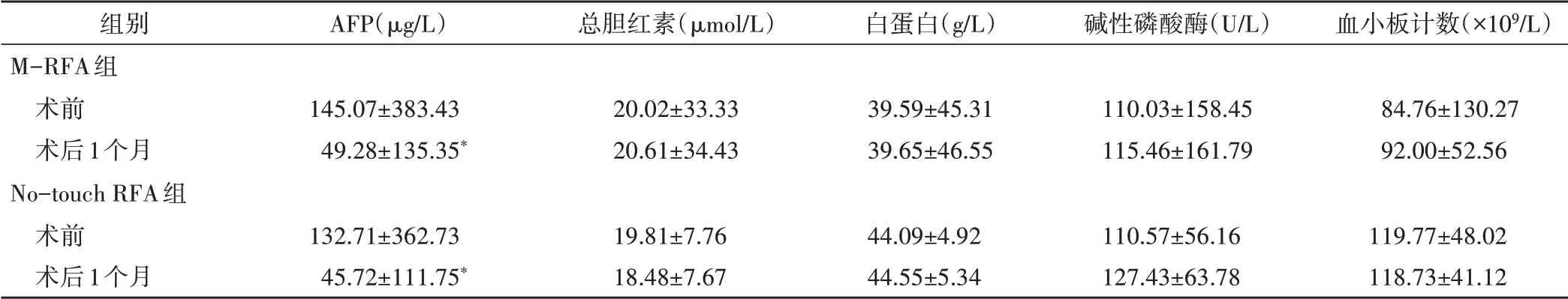
表1 两组治疗前后实验室检查指标比较(±s)
与同组术前比较,*P<0.001。AFP:甲胎蛋白
组别M-RFA组术前术后1个月No-touch RFA组术前术后1个月AFP(μg/L)145.07±383.43 49.28±135.35*132.71±362.73 45.72±111.75*总胆红素(μmol/L)20.02±33.33 20.61±34.43 19.81±7.76 18.48±7.67白蛋白(g/L)39.59±45.31 39.65±46.55 44.09±4.92 44.55±5.34碱性磷酸酶(U/L)110.03±158.45 115.46±161.79 110.57±56.16 127.43±63.78血小板计数(×109/L)84.76±130.27 92.00±52.56 119.77±48.02 118.73±41.12
三、两组术后随访情况比较
两组患者均于RFA治疗后3个月、6个月、12个月、18 个月、24 个月复查超声造影、肝肿瘤特异性MRI、增强CT,两组无瘤生存率情况见图3。术后随访24个月,No-touch RFA 组无瘤生存率为68.00%(34/50),MRFA组无瘤生存率为47.73%(21/44),差异有统计学意义(P=0.041)。

图3 两组RFA治疗后无瘤生存曲线图
四、并发症
两组RFA 术后均未出现严重并发症,M-RFA 组出现少量反应性胸腔积液3 例,少量出血1 例;Notouch RFA 组出现少量反应性胸腔积液2 例,少量出血2 例;两组并发症发生情况比较差异无统计学意义。
讨 论
研究[4]证实,超声引导下RFA是治疗最大径<3 cm肝肿瘤应用最广泛、最有效的治疗方法之一,可作为手术治疗的替代方法。RFA 是通过高频电磁波产生生物能源,形成>60°C 的温度造成热损伤,导致肿瘤细胞蛋白质变性和组织凝固性坏死。消融治疗的目标是一次性完全消融,因此,消融治疗前准确检出病灶、测量其大小、明确肿瘤边界及术中实时监测并精准定位是成功消融的关键,但如何提高术中定位的准确性仍然是一个难题[5]。目前,通常使用常规超声实时引导RFA 治疗,但由于常规超声对肿瘤边界判断不够准确,特别是常规超声显示不清的病灶,在RFA 术中无法准确定位,影响治疗效果[6]。研究[7]表明,超声造影能客观反映肝肿瘤大小及对周围组织的浸润情况,可以准确界定肿瘤范围及边界。因此,使用超声造影实时引导RFA治疗能有效提高治疗效果。
直接穿刺肿瘤M-RFA 治疗的主要不足是仅能提供有限的坏死体积,可能会引起治疗边缘不足,且直接穿刺使肿瘤周围癌细胞受到挤压,导致肿瘤压力增大,更容易发生肿瘤局部残留和短期肝内转移[8]。No-touch RFA 是一种新兴的局部消融技术,其治疗方法是使用多根电极针穿刺到肝内,置于肿瘤周边,避免直接穿刺肿瘤,在技术层面,其超越了常规M-RFA治疗,要求引导治疗的超声医师准确测量病灶大小并定位肿瘤的边缘位置。文献[9]报道,No-touch RFA 可以降低肝肿瘤播散和腹腔出血的风险。Hocquelet等[2]报道,No-touch RFA 较直接穿刺技术能更好地控制肿瘤局部复发。本研究应用超声造影引导下MRFA 和No-touch RFA 两种方法治疗肝肿瘤患者,结果显示超声造影测量M-RFA 组肿瘤灭活范围平均值为38.36 mm×31.31 mm,No-touch RFA 组为46.70 mm×35.82 mm,为射频消融后制定合理的RFA 治疗方案提供了准确依据。
AFP 是判断肝细胞癌预后的一个重要指标,若术后半个月AFP 仍未降低或恢复到正常水平,预示体内可能存有残余癌灶。本研究结果显示,No-touch RFA组肿瘤完全灭活率明显高于M-RFA 组(98.00% vs.90.90%),差异有统计学意义(P<0.05);RFA治疗后随访24个月,No-touch RFA组无瘤生存率明显高于M-RFA组(68.00% vs. 47.72%),差异有统计学意义(P=0.041)。Seror 等[9]研究认为M-RFA 是从肿瘤的中心位置向肿瘤周边离心性消融,可能无法保证足够的消融安全边缘,而No-touch RFA 是从肿瘤周边到中心位置向心性消融,确保了足够的消融安全边缘。本研究也认为No-touch RFA 消融范围大,对病灶消融彻底,不容易产生残留,复发率低,与文献[9]报道一致。
超声造影不仅可用于RFA 术前评估、术中引导,还可作为评估疗效的一种有效手段。本研究所有患者RFA 治疗后3 d 内复查超声造影,将消融后坏死区域与原病灶位置进行比较,可以及时发现残留灶。本研究5例患者存在少许活性增强区,提示消融不完全,分析原因主要是病灶直径>20 mm且病灶邻近大血管。
本研究的局限性:①对于常规超声显示不清的病灶及靠近膈顶部或肠道的病灶,因超声造影动脉相持续时间短,无法对整个肝脏进行检查,检查敏感性不高;②样本量较小,且患者未随机分配,存在一定偏差;③目前国内开展No-touch RFA 技术的医院较少,缺乏多中心大规模的前瞻性研究作为对照。
综上所述,超声造影可以准确引导定位、监测RFA 治疗及有效评估术后疗效。与M-RFA 相比,超声造影引导下No-touch RFA 治疗方法疗效显著,可明显提高肝肿瘤患者的无瘤生存率,具有较高的临床应用价值。

