LYPD8在结直肠癌中的表达及其生物学功能
钱峻 严富国 陈文山 陈允 黄海平 叶明燕
近年来研究表明,含有Ly6/Plaur结构域的高度糖基化的磷脂酰肌醇锚定蛋白8(Ly6/Plaur domain-containing protein 8,LYPD8)有助于大肠细菌与肠上皮细胞的分离[1]。此外,LYPD8在结肠上皮细胞中表达,而在一些溃疡性结肠炎患者的结肠组织中LYPD8表达有所降低[2]。目前关于LYPD8在结直肠癌(colorectal cancer,CRC)中的生物学功能有待进一步阐明。笔者将CRC组织与相应的癌旁组织及正常组织进行了比较,检测了不同CRC组织中LYPD8的表达、信号传导与活化转录因子3(signal transducer and activator of transcrip-tion 3,STAT3)/NF-κB p65 的磷酸化作用以及 IL-6/TNF-α的分泌水平;并将LYPD8在CRC细胞中过表达,研究其对CRC细胞增殖和迁移的影响,以探讨LYPD8在CRC发生发展中的作用。
1 材料和方法
1.1 组织标本 组织标本来自于2015年3月至2016年9月在温州医科大学附属新昌医院接受CRC根治术的40例患者,其中男26例,女14例;年龄45~70(56.3±3.4)岁;临床TNM分期:Ⅰ期7例,Ⅱ期14例,Ⅲ期13例,Ⅳ期6例;所有患者术前未接受放疗、化疗和免疫治疗。取其手术切除的CRC组织、正常结直肠组织(距离癌组织边缘>3 cm)和癌旁结直肠组织(距离癌组织边缘≤3 cm)进行检测。本研究经医院伦理委员会审查通过,所有患者签署知情同意书。
1.3 组织标本病理学观察 采用免疫荧光染色法。将组织在4%多聚甲醛溶液中固定过夜、脱水、石蜡包埋、切片、二甲苯脱蜡,在梯度乙醇中水化,抗原修复。3% H2O2处理切片后用10%山羊血清封闭切片,4℃下用STAT3抗体(ab68153,英国Abcam公司)和p65抗体(ab32536,英国Abcam公司)孵育过夜,然后二抗温育 1 h。使用 4′,6-二脒基-2-苯基吲哚(C1002,中国碧云天生物技术公司)对细胞核染色5 min,在共聚焦激光显微镜(LSM780,德国ZEISS公司)下观察染色结果。
1.4 蛋白表达检测 采用Western blot法。按相关文献报道的方法进行组织或细胞的蛋白质提取和电泳分离[3]。电泳后,将蛋白质转移到聚偏二氟乙烯膜(IPVH00010,德国Millipore公司)上,再在5%脱脂牛奶中封闭 1 h,与 STAT3抗体、p-STAT3抗体(AF3294,美国 Affnity Biosciences公司)、p65抗体、p-p65抗体(AF2006,美国Affnity Biosciences公司)和甘油醛-3-磷酸脱氢酶抗体(AP0063,美国Bioworld Technology公司)4℃孵育过夜。然后与碱性磷酸酶标记的二抗(A0239,中国碧云天生物技术公司)室温下孵育2 h。洗涤后,将膜与显色底物在室温下孵育5 min,使用蛋白凝胶成像系统(VersaDoc 3000,美国 Bio-Rad Laboratories公司)进行检测和拍照;使用Image J软件分析条带强度,计算蛋白相对表达量[首先将图片转化为8位灰度图(去除背景),然后选择条带进行编号,通过软件分析绘制出选择条带的峰图,对每个峰的中间区域对应峰面积进行计算,用目标蛋白的面积值除以内参蛋白的面积值得到相对表达量]。
1.5 细胞因子检测 采用ELISA法。使用IL-6试剂盒(HM10205,中国贝茵莱生物科技公司)、TNF-α试剂盒(HM10001,中国贝茵莱生物科技公司)进行IL-6、TNF-α定量分析,具体操作步骤按照试剂盒说明书进行。
1.6 基因表达检测 采用RT-PCR法。使用Mini BEST Universal RNA Extraction试剂盒(9767,日本 Takara公司)提取总 RNA,NanoDrop One(ND-ONE-W,美国Thermo Scientific公司)进行定量分析。使用PCR基因扩增仪(KB0365006,美国 Bio-Rad Laboratories公司)、PrimeScriptRT试剂盒(6210A,日本Takara公司)获得反转录cDNA。使用RT-PCR系统(CFX96,美国Bio-Rad Laboratories公司)、SYBR Premix Ex Taq试剂盒(RR820A,日本Takara公司)进行RT-PCR。引物序列如下:LYPD8 为 5′-CGAAAGTTTGAGTGTGCAAATGT-3′和5′-CAGAGCAGGGAAAGAGGGTGT-3′,β-actin 为 5′-TGACGTGGACATCCGCAAAG-3′和 5′-CTGGAAGGTGGACAGCGAGG-3′。以β-actin为内参基因,使用2-ΔΔCt法计算 mRNA 相对表达量。
1.7 细胞增殖实验 采用CCK-8法。将上述不同处理组SW480细胞接种在96孔板中,按照CCK-8试剂盒(CK04,日本同仁化学公司)说明书进行操作,计算细胞存活凋亡百分比。
1.8 细胞迁移实验 采用Transwell法。下室含有FBS培养基,上室不含FBS培养基;待细胞迁移24 h后刮擦除去未迁移细胞。100%甲醇固定迁移细胞,0.05%结晶紫染色,在光学显微镜(CX23,日本OLYMPUS公司)下观察并统计迁移细胞数。
1.9 统计学处理 采用GraphPad Prism 7.0统计软件。计量资料多组间比较采用单因素方差分析,两两比较采用Bonferoni校正的t检验;两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同临床分期CRC患者组织标本病理学观察及蛋白表达水平比较 Ⅳ期患者CRC组织中STAT3、p65表达明显上调,且集中分布在细胞质和细胞核,见图1(插页)。与Ⅰ期比较,Ⅲ期患者CRC组织中p-p65/p65、p-STAT3/STAT3蛋白表达水平明显升高(均P<0.05),见图2。2.2 不同临床分期CRC患者癌组织与癌旁组织细胞因子水平比较 与癌旁组织比较,Ⅱ、Ⅲ期患者癌组织中 IL-6、TNF-α 水平明显升高(均 P<0.05),见图 3。
2.3 不同临床分期CRC患者癌组织、癌旁组织与正常组织LYPD8 mRNA表达水平比较 与正常组织、癌旁组织比较,Ⅰ、Ⅱ、Ⅲ期患者癌组织中LYPD8 mRNA表达水平均明显降低(均P<0.05)。与Ⅰ期患者癌组织比较,Ⅲ期患者癌组织中LYPD8 mRNA表达水平降低更明显(P<0.05),见图 4。
2.4 LYPD8过表达对SW480细胞中IL-6、TNF-α分泌和STAT3、p65去磷酸化的影响 LYPD8 OE组中LYPD8 mRNA表达水平明显升高,证明LYPD8过表达载体已成功用于诱导SW480细胞中LYPD8的过表达,见图5a。LYPD8 OE组中IL-6、TNF-α水平均明显降低(均P<0.05),提示LYPD8过表达可抑制SW480细胞中IL-6、TNF-α的分泌,见图5b。LYPD8 OE组中pp65/p65、p-STAT3/STAT3蛋白表达水平均明显降低(均P<0.05);但SW480细胞培养基中加入5 μg/L的TNF-α或50 μg/L的IL-6时,蛋白表达水平恢复至Control组相似水平。这说明SW480细胞中LYPD8过表达可诱导p65、STAT3的去磷酸化,进而抑制TNF-α、IL-6的分泌。
2.5 LYPD8过表达对SW480细胞增殖的影响 LYPD8 OE组细胞存活凋亡百分比明显低于Control组(P<0.05);当 SW480细胞培养基中加入 5 μg/L的 TNF-α或50 μg/L的IL-6时,细胞存活凋亡百分比均明显升高(均 P<0.05),见图 6。
2.6 LYPD8过表达对SW480细胞迁移的影响 与未处理组、Control组比较,LYPD8 OE组细胞迁移个数明显减少(均 P<0.05),见图 7(插页)。
3 讨论
在CRC组织中,大量炎症因子促进了肿瘤的发生、发展[4]。肿瘤组织与周围炎症微环境之间形成互动的网络,可促进癌细胞生长、增殖和迁移[5]。LYPD8在结肠上皮细胞中特异性表达,而其在溃疡性结肠炎患者的结肠上皮细胞中表达明显降低[6]。因此,LYPD8低表达可能是结肠炎发生的重要因素,也可能是CRC发生、发展过程中的重要调节蛋白。
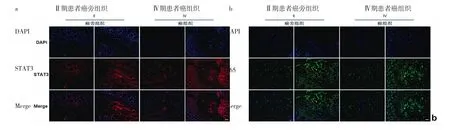
图1 共聚焦激光显微镜下CRC组织及癌旁组织病理学观察(CRC为结直肠癌,DAPI为4′,6-二脒基-2-苯基吲哚,STAT3为信号传导与活化转录因子3,Merge为合并重叠;a:STAT3表达;b:p65表达;免疫荧光染色,标尺100 μm)
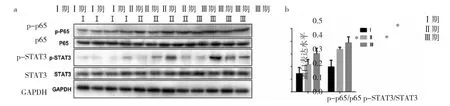
图2 不同临床分期患者CRC组织中p-p65、p65、p-STAT3、STAT3、p-p65/p65及p-STAT3/STAT3蛋白表达(CRC为结直肠癌,STAT3 为信号传导与活化转录因子 3;a:p-p65、p65、p-STAT3、STAT3 蛋白表达的电泳图;b:p-p65/p65、p-STAT3/STAT3 蛋白表达水平比较,与Ⅰ期比较,*P<0.05)
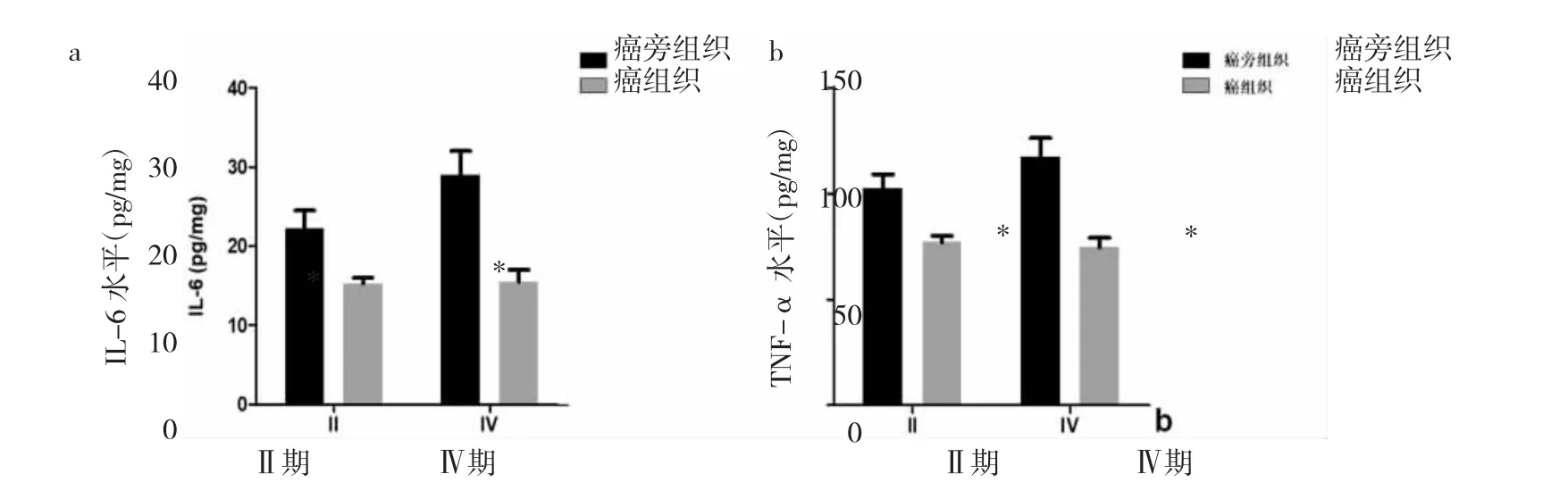
图3 不同临床分期CRC患者癌组织与癌旁组织细胞因子水平比较(CRC为结直肠癌;与癌旁组织比较,*P<0.05)
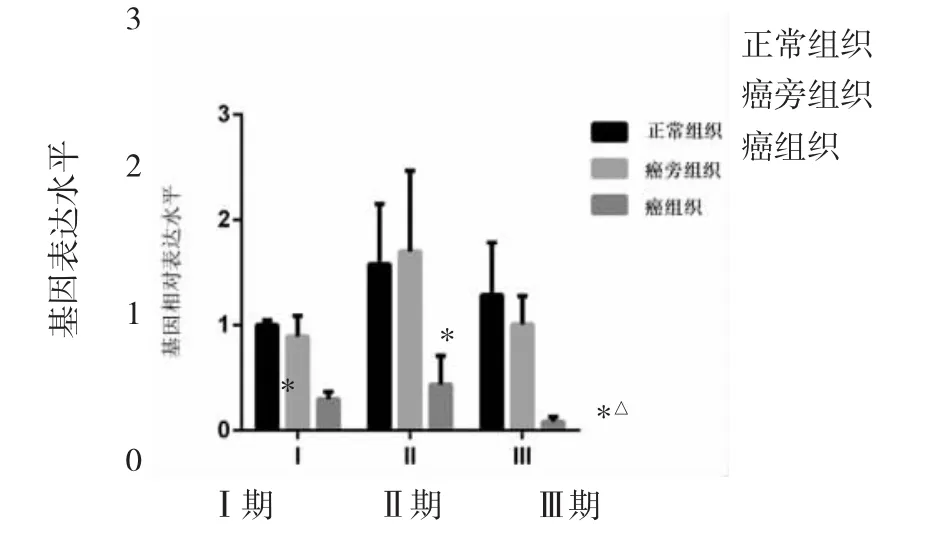
图4 不同临床分期CRC患者癌组织、癌旁组织与正常组织LYPD8 mRNA表达水平比较(CRC为结直肠癌,LYPD8为含有Ly6/Plaur结构域的高度糖基化的磷脂酰肌醇锚定蛋白8;与正常组织、癌旁组织比较,*P<0.05;与Ⅰ期癌组织比较,△P<0.05)
IL-6是一种具有广泛生物学功能的炎症因子,其表达受NF-κB调节,在多个细胞中表达并参与调节肿瘤增殖相关基因的转录[7]。TNF-α在CRC患者的血清和结肠黏膜中表达增加[8],可促进CRC的进展,其机制可能与NF-κB信号通路的激活有关[9]。本研究表明,与癌旁组织相比,CRC组织中IL-6、TNF-α水平明显增加。STAT3相关的信号通路在各种类型癌症(包括CRC、前列腺癌、肺癌、乳腺癌、胰腺癌和卵巢癌等)的发生、发展中起着正调节作用[10]。STAT3的激活可以诱导肿瘤细胞增殖以及肿瘤细胞凋亡和分化相关致癌基因的异常转录[11]。多种细胞因子(包括IL-6、TNF-α等)通过STAT3信号通路在癌细胞中发挥生物学作用[12]。IL-6通过STAT3信号通路介导相关转录因子的激活,进而调控肿瘤细胞的增殖和迁移[13]。当受到IL-6等细胞因子刺激时,STAT3的酪氨酸基团被磷酸化为p-STAT3,并通过SH2区域形成同源或异二聚体。本研究在对照组、LYPD8 OE组、LYPD8 OE+TNF-α组和LYPD8 OE+IL-6组的SW480细胞中均检测到p-STAT3,并且LYPD8过表达可降低STAT3磷酸化。研究表明,TNF-α可激活NF-κB信号通路[14]。NF-κB是一种具有转录功能的蛋白质,NF-κB的启动涉及病理过程的基因转录,并有细胞因子参与[15]。NF-κB在细胞中以二聚体的形式存在,p65、p50异二聚体是其最常见的状态,广泛分布于细胞中,参与多种基因的表达和调控[16]。本研究结果表明,LYPD8的过表达可促进p65磷酸化,导致细胞行为的改变;另外发现,与相应的癌旁组织相比,CRC组织中IL-6、TNF-α的分泌明显增加,并诱导了STAT3、p65磷酸化。相反,在Ⅰ、Ⅱ、Ⅲ期CRC组织中,LYPD8的表达明显降低。
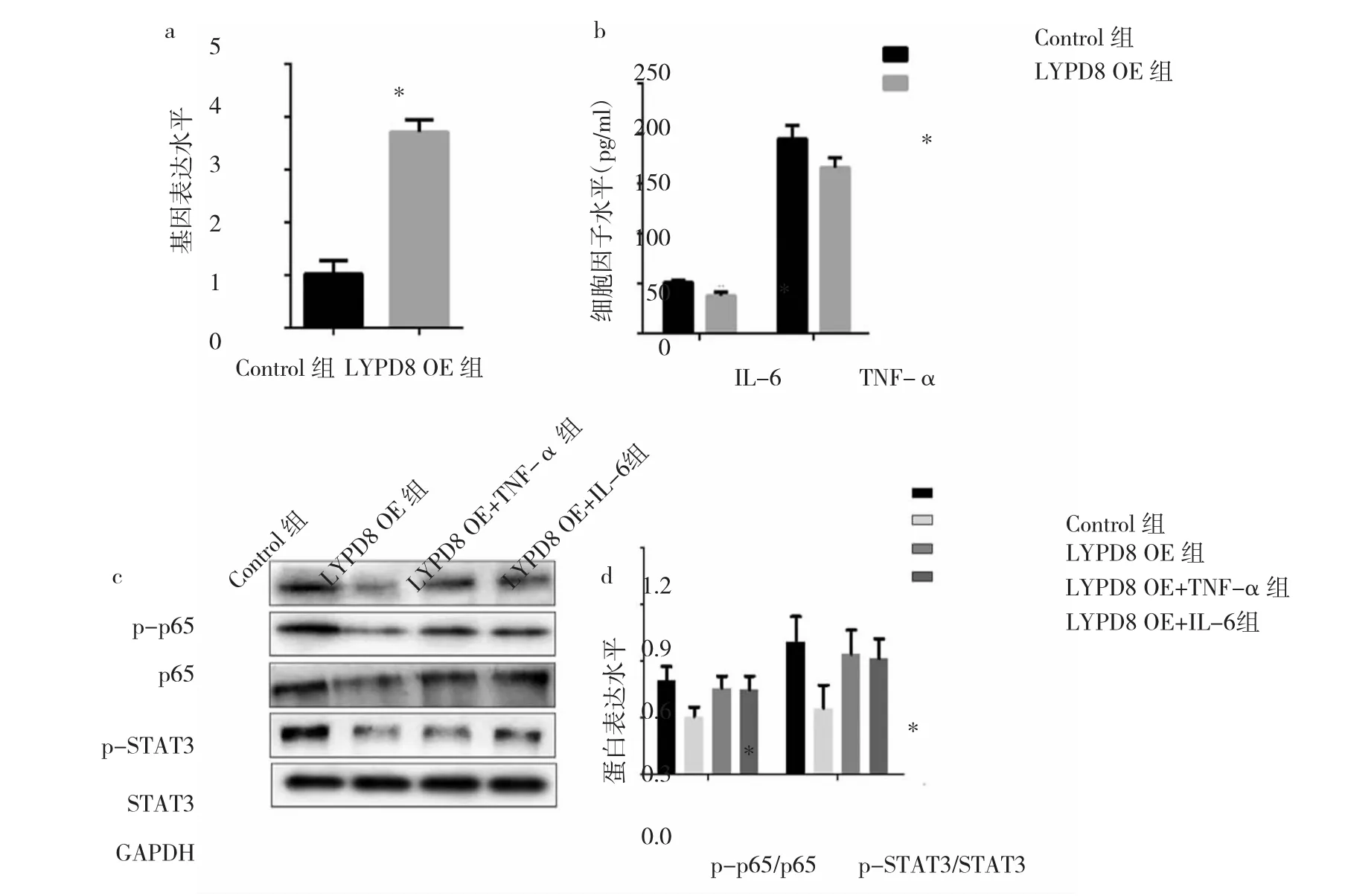
图5 LYPD8过表达对SW480细胞中IL-6、TNF-α分泌和STAT3、p65去磷酸化的影响(LYPD8为含有Ly6/Plaur结构域的高度糖基化的磷脂酰肌醇锚定蛋白8,STAT3为信号传导与活化转录因子3;a:LYPD8 mRNA表达水平比较,与Control组比较,*P<0.05;b:细胞因子水平比较,与 Control组比较,*P<0.05;c:p-p65、p65、p-STAT3、STAT3 蛋白表达的电泳图;d:p-p65/p65、p-STAT3/STAT3 蛋白表达水平比较,与 Control组比较,*P<0.05)
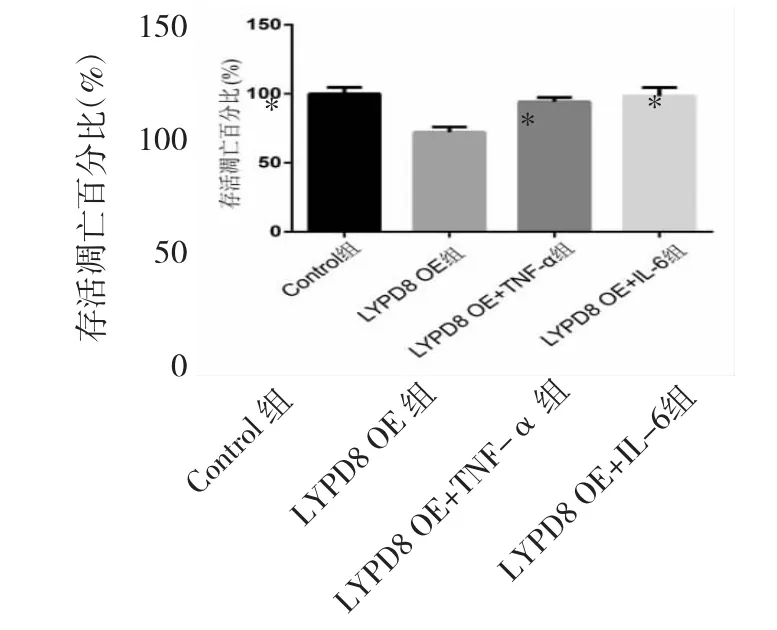
图6 LYPD8过表达对SW480细胞增殖的影响(LYPD8为含有Ly6/Plaur结构域的高度糖基化的磷脂酰肌醇锚定蛋白8;与LYPD8 OE 组比较,*P<0.05)
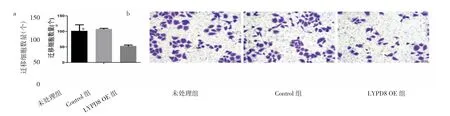
图7 LYPD8过表达对SW480细胞迁移的影响(LYPD8为含有Ly6/Plaur结构域的高度糖基化的磷脂酰肌醇锚定蛋白8;a:细胞迁移个数比较,与LYPD8 OE组比较,*P<0.05;b:细胞迁移实验,结晶紫染色,×200)
综上所述,本研究与之前的研究结果共同揭示了LYPD8与IL-6/TNF-α表达之间的相关性,探索了LYPD8参与调节CRC中STAT3信号通路的机制,以及LYPD8过表达对CRC细胞行为的影响[17]。LYPD8在Ⅰ、Ⅱ、Ⅲ期患者CRC组织中的表达较癌旁组织及正常组织明显降低;LYPD8在CRC细胞中通过诱导STAT3、p65去磷酸化,抑制TNF-α、IL-6的分泌,从而抑制CRC细胞的增殖和迁移。本研究对阐明炎症微环境与CRC之间的关系具有重要意义,为CRC的抗炎靶向治疗的设计提供了理论和实验依据。

