鸡源IFN-λ3的克隆表达及抗病毒活性分析
宋彦莹,王 鹏,戴 玉,刘 聪,刘 雨,王方昆
(山东农业大学动物医学院/山东省动物生物工程与疾病防治重点实验室,山东 泰安 271018)
鸡 源 IFN-λ3(Chicken Interferon-Lambda3 ,ChIFN-λ3)是归类于Ⅲ型干扰素中的新型细胞因子,与I型干扰素相比,Ⅲ型干扰素具有特定组织作用靶向性及毒副作用小的特点[1,2]。它不同于I型干扰素和II型干扰素,III型干扰素(IFN-λ)的研究已经落后,而目前利用原核表达系统体外表达纯化干扰素的技术相对比较成熟。因此,本研究拟利用大肠杆菌原核表达系统体外表达和纯化ChIFN-λ3。进一步研究重组蛋白的抗病毒活性,为ChIFN-λ3在畜牧兽医领域的应用、抗病毒生物制剂的研发以及基础免疫学实验研究奠定基础[3];对构建动物干扰素基因重组疫苗,提高其免疫效力、降低病毒载体毒性等方面有着重要的意义。
1 材料与方法
1.1 主要材料 PCR试剂、限制性内切酶、IPTG、抗生素均购于TaKaRa公司(大连);DNA标记、核酸燃料购于全式金有限公司;转染试剂(Lipo2000)、细胞培养用胎牛血清(FBS)购自Hyclone公司;Ni2+琼脂糖凝胶柱购于Ge Healthcare Bio Sciences Ab;凝胶回收(小)试剂盒、质粒(小)提取试剂盒、RHA提取试剂盒均购于GeneMark;BCA蛋白浓度测定试剂盒购于北京Solabao科技有限公司。文中所用Top10、E.coliBL21、商品化pMD18-T、pET-32a(+)均由流行病及病原分子生物学实验室保存。
1.2 引物合成与设计 根据NCBI网站GenBank中已经发表的ChIFN-λ3基因序列(登陆号NM_001128496.1)和pET32a(+)载体的克隆位点,设计并合成一对含有BamHI和Sal I两个酶切位点寡核苷酸引物F(5’-TTTGGATCCATGGTATGCTAC-3’)和R(5’-TTTGTCCGACCTAAGTGCAATC-3’)。
1.3 ChIFN-λ3基因的扩增、克隆和表达 以鸡脾脏组织提取的总RNA为模板,利用RT-PCR方法扩增ChIFN-λ3,退火温度55℃。将扩增产物回收,克隆到pMD18-T载体中进行测序验证。将测序正确的质粒用BamHI和Sal I双酶切,回收酶切产物,将其克隆入原核表达载体pET-32a中,构建原核表达载体pET-32a(+)-ChIFN-λ3,验证正确后转化BL21感受态细胞,次日挑取经PCR验证后的阳性菌落,37℃/220r过夜培养。将新鲜菌液按照1:100接种培养基,37℃摇床培养至OD600=0.4~0.6,加IPTG调终浓度为1mM,诱导培养4h,收集菌体加入1/10体积的PBSBuffer(pH7.4),超声破碎;高速离心后,分别收集上清和沉淀,进行SDS-PAGE蛋白质电泳分析。
1.4 重组蛋白的纯化、复性及浓度测定 将诱导表达产物用0.22µm滤膜过滤,滤液装入预装的Ni2+琼脂糖凝胶柱,柱平衡后,用含不同浓度咪唑(30-200mmol/L)的洗脱缓冲液(含6M尿素)进行梯度洗脱。将纯化的ChIFN-λ3蛋白在6、4、2、0mol/L尿素复性缓冲液(pH9.0)中透析,每隔4h换1次复性缓冲液,最后在缓冲液(pH9.0)中透析12~24h,将透析袋放入PEG-20000中浓缩,将浓缩好的蛋白过滤除菌并测定浓度,于-80℃保存备用。运用Bradford测定法以BSA作为标准蛋白质测定ChIFN-λ3相对蛋白质浓度。
1.5 病毒活性检测 将纯化后的ChIFN-λ3蛋白过滤除菌,用培养基原液分别梯度稀释成10-1、10-2、10-3,分别加到长满单层的DF-1细胞的12孔板中孵育12h,每个稀释度设3个重复,设不添加ChIFN-λ3蛋白的病毒组为对照。PBS冲洗2遍,阳性孔接种VSV-EGFP病毒(MOI=0.01),孵育1h后换完全培养液,24h后荧光显微镜观察实验结果。
2 结果与分析
2.1 ChIFN-λ3基因的扩增、克隆和表达 琼脂糖凝胶电泳分析,以鸡脾脏RNA反转录成cDNA作为模板,成功扩增出561bp左右的单一目的条带,与预期片段大小相符。经测序分析该扩增片段与GeneBank中登录的鸡源IFN-λ3基因序列同源性为100%.将以上扩增出的目的片段与pET-32a(+)载体连接,成功获得重组质粒pET-32a(+)-ChIFN-λ3。利用pET-32a(+)上原有的酶切位点(BamHI和Sal I两个酶切位点)进行双酶切,分别得到载体、目的片段,与预测大小相符(图1)。
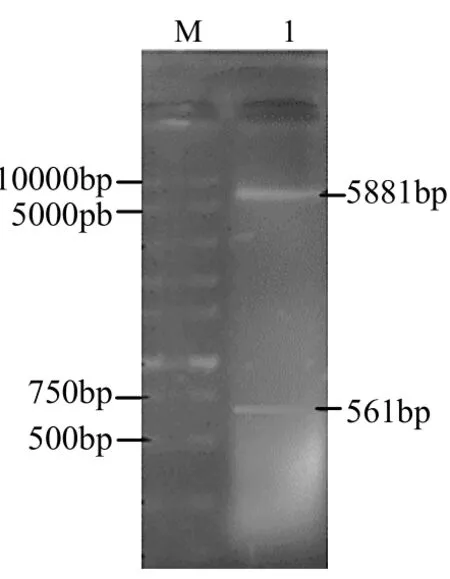
图1 重组质粒酶切鉴定结果

图2 纯化的IFN-λ3蛋白的SDS-PAGE分析
2.2 重组蛋白的纯化、复性及浓度测定 大量诱导成功转入重组质粒pET-32a(+)-ChIFN-λ3的E.coli BL21表达菌,利用目的蛋白结合His的镍柱纯化蛋白样品,并进行SDS-PAGE分析。SDSPAGE结果显示,该重组蛋白能够和His层析柱结合并被纯化,重组ChIFN-λ3蛋白35KD左右,与预期的蛋白片段大小一致,如图2。绘制标准曲线得到线性方程(附表,图3),根据方程求出纯化的蛋白浓度为0.191mg/ml。
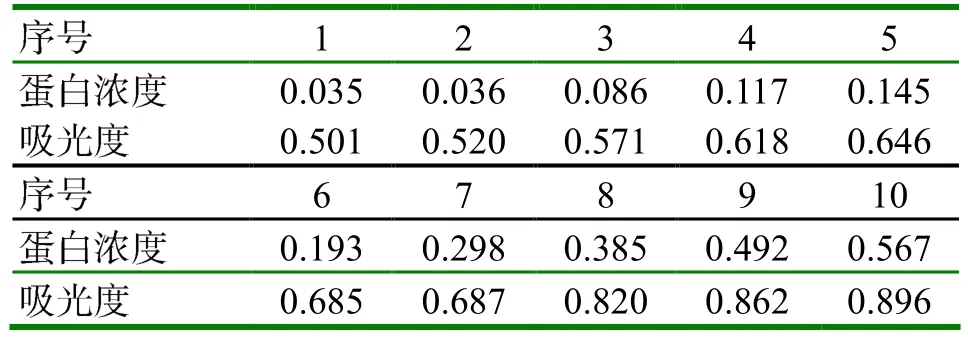
附表 蛋白标准品吸光度与对应浓度 (mg/ml)
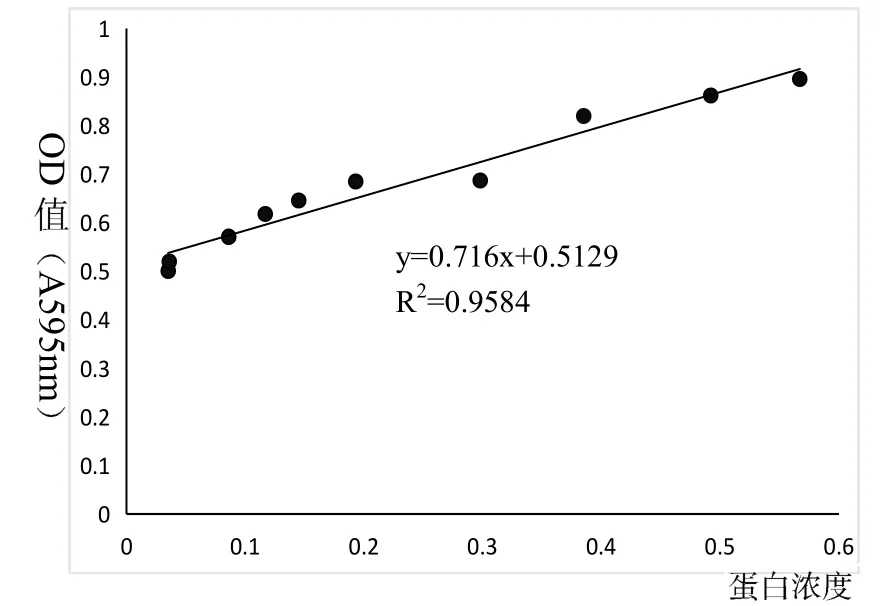
图3 蛋白质浓度标准曲线
2.3 抗病毒活性检测 利用VSV-EGFP/DF-1系统测定重组ChIFN-λ3的抗病毒活性,以不同浓度纯化的重组ChIFN-λ3干扰素作用DF-1细胞12h后,感染VSV-EGFP,24h后用荧光显微镜观察结果,并运用Image Pro Plus软件对荧光强度进行数据分析,各组IOD(sum)/Area(sum)数值结果如图4所示。可以明显看到,加入重组ChIFN-λ3的各组光密度平均值都比阳性对照组低;其中,10倍稀释孔(0.0191mg/ml)的光密度平均值显著性降低(P<0.01);同时,随着重组ChIFN-λ3的浓度升高,抗病毒效果逐渐增强,上述结果表明重组ChIFN-λ3具有较高的抗病毒活性。

图4 鸡源IFN-λ3抗病毒活性检测结果
3 讨论
3.1 IFN-λ的研究现状 干扰素是一种为人们所公认的广谱抗病毒生物制剂,可用于治疗许多病毒性疾病[4]。禽Ⅲ型干扰素是近年来被鉴定出的禽类新型干扰素。Adam等[5]在2008年从鸡的体内首次克隆鉴定出了鸡的IFN-λ,利用大肠杆菌表达ChIFN-λ3,证明了其对流感病毒具有一定的抑制作用,但是对于其相关的生物特性、作用机制等研究较少。2014年,Antje等[6]利用鸟类逆转录病毒载体系统研究ChIFN-λ3,结果显示ChIFN-λ3,可以对AIV,NDV和IBV产生抑制作用。在本研究中,我们检测到IFN-λ3对VSV体外复制产生抑制作用,进一步说明了干扰素作为抗病毒制剂的应用的潜力。
3.2 IFN-λ的原核表达 目前,禽类干扰素的生产主要以原核系统表达为主。因此我们选择利用大肠杆菌原核表达系统表达重组ChIFN-λ3。通过大肠杆菌表达的重组干扰素程序化加工纯度更高、性能更加稳定、作用更加持久广泛,这就使得重组干扰素在畜牧业基础研究应用上,能够发挥卓越的作用。为了使重组蛋白呈现分泌和高效表达,我们在ChIFN-λ3的C端添加了His标签,利用目的蛋白能与His柱结合的原理进行纯化。在重组蛋白以分泌形式存在于上清的情况下,提取重组蛋白时,可以省去对细胞做破碎处理等环节,进而减少对蛋白的破坏以及损失,使后期纯化重组蛋白的操作更为简单,有效节省蛋白纯化的时间,提高纯化效率,为体外大量制备高效廉价的重组ChIFN-λ3奠定基础。利用细胞病变抑制法测定重组ChIFN-λ3抗病毒活性,发现重组ChIFN-λ3具有显著的抗病毒作用。
3.3 IFN-λ的应用前景 IFN是一种类重要的细胞因子佐剂,被广泛的应用于兽医临床。随着禽类干扰素基因的成功克隆及表达技术的不断发展,重组产品的研究逐渐向临床过渡,展现出广阔的应用前景。Plachy等[7]进行了鸡重组干扰素防治劳斯肉瘤病毒(RSV)的研究,Marcus等[8]采用饮水给药的方法进行了重组ChIFN—Q抗新城疫病毒(NDV)的研究,均获得了显著的抗病毒效果。此外,干扰素能够预防和治疗某些细菌、病毒及混合感染引发的腹泻,并可作为良好的佐剂发挥作用。在畜牧业生产中,滥用抗生素已经引起大量耐药菌的出现和药物残留,新型抗生素的开发速度远远跟不上细菌耐药发生的步伐。干扰素作为免疫应答的自然介导物和调节物之一,具有广谱的抗病毒活性、抑制细胞分化和增殖及广泛的免疫调节能力,在临床上具有良好的应用前景。随着基因工程技术的发展,干扰素的生产成本大大降低,使其在畜禽业具有巨大的应用潜力。干扰素的进一步研究对加强我国畜禽传染病防控的技术,推动畜牧业发展有极大的作用。

